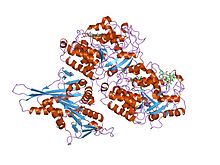
Tubulin
| Tubulin | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 kif1a huvud-mikrotubuli komplex struktur i atp-form
| |||||||||
| identifierare | |||||||||
| Symbol | Tubulin | ||||||||
| Pfam | PF00091 | ||||||||
| Pfam klan | CL0442 | ||||||||
| InterPro | IPR003008 | ||||||||
| PROSITE | PDOC00201 | ||||||||
| SCOP2 | 1 badkar / SCOPe / SUPFAM | ||||||||
| |||||||||
Tubulin i molekylärbiologi kan hänvisa antingen till tubulinproteinsuperfamiljen av globulära proteiner , eller ett av medlemsproteinerna i den superfamiljen. α- och β-tubuliner polymeriseras till mikrotubuli , en huvudkomponent i det eukaryota cytoskelettet . Mikrotubuli fungerar i många väsentliga cellulära processer, inklusive mitos . Tubulinbindande läkemedel dödar cancerceller genom att hämma mikrotubulidynamiken, som krävs för DNA- segregering och därför celldelning .
I eukaryoter finns det sex medlemmar av tubulinsuperfamiljen, även om inte alla är närvarande i alla arter. Både α- och β-tubuliner har en massa på cirka 50 kDa och ligger således i ett liknande intervall jämfört med aktin (med en massa på ~42 kDa). Däremot tenderar tubulinpolymerer ( mikrotubuli) att vara mycket större än aktinfilament på grund av deras cylindriska natur.
Tubulin ansågs länge vara specifikt för eukaryoter. På senare tid har dock flera prokaryota proteiner visats vara relaterade till tubulin.
Karakterisering
Tubulin kännetecknas av den evolutionärt konserverade Tubulin/FtsZ-familjen, GTPase- proteindomänen .
Denna GTPase-proteindomän finns i alla eukaryota tubulinkedjor, såväl som det bakteriella proteinet TubZ, det arkeala proteinet CetZ och FtsZ -proteinfamiljen som är utbredd i bakterier och archaea .
Fungera
Mikrotubuli
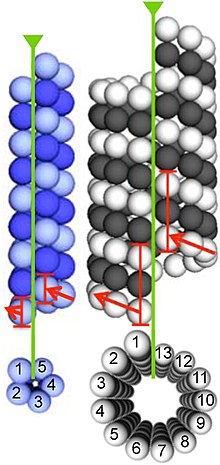
α- och β-tubulin polymeriserar till dynamiska mikrotubuli. I eukaryoter är mikrotubuli en av huvudkomponenterna i cytoskelettet och fungerar i många processer, inklusive strukturellt stöd, intracellulär transport och DNA -segregering.
Mikrotubuli är sammansatt av dimerer av α- och β-tubulin. Dessa underenheter är lätt sura, med en isoelektrisk punkt mellan 5,2 och 5,8. Var och en har en molekylvikt på cirka 50 kDa.
För att bilda mikrotubuli binder dimererna av α- och β-tubulin till GTP och sätts samman på (+) ändarna av mikrotubuli medan de är i det GTP-bundna tillståndet. β-tubulinsubenheten exponeras på plusänden av mikrotubulin, medan α-tubulinsubenheten exponeras på minusänden. hydrolyseras molekylen av GTP bunden till β-tubulinsubenheten så småningom till GDP genom interdimerkontakter längs mikrotubuliprotofilamentet . GTP-molekylen bunden till α-tubulinsubenheten hydrolyseras inte under hela processen. Huruvida β-tubulinmedlemmen i tubulindimeren är bunden till GTP eller GDP påverkar dimerens stabilitet i mikrotubuli. Dimerer bundna till GTP tenderar att samlas till mikrotubuli, medan dimerer bundna till BNP tenderar att falla isär; sålunda är denna GTP-cykel väsentlig för mikrotubulus dynamiska instabilitet .
Bakteriella mikrotubuli
Homologer av α- och β-tubulin har identifierats i bakteriesläktet Prosthecobacter . De betecknas BtubA och BtubB för att identifiera dem som bakteriella tubuliner. Båda uppvisar homologi med både a- och p-tubulin. Även om de strukturellt mycket liknar eukaryota tubuliner, har de flera unika egenskaper, inklusive chaperonfri vikning och svag dimerisering. Kryogen elektronmikroskopi visade att BtubA/B bildar mikrotubuli in vivo , och föreslog att dessa mikrotubuli endast består av fem protofilament, till skillnad från eukaryota mikrotubuli, som vanligtvis innehåller 13. Efterföljande in vitro -studier har visat att BtubA/B bildar fyrsträngade 'mini' -mikrotubuli'.
DNA-segregering
Celldelning
Prokaryotisk division
FtsZ finns i nästan alla bakterier och Archaea , där det fungerar i celldelning , lokaliseras till en ring i mitten av den delande cellen och rekryterar andra komponenter i divisomen, gruppen av proteiner som tillsammans drar ihop cellhöljet för att klämma av cell, vilket ger två dotterceller. FtsZ kan polymerisera till rör, ark och ringar in vitro och bildar dynamiska filament in vivo .
plasmider med lågt kopietal under bakteriell celldelning. Proteinet bildar en struktur ovanlig för en tubulinhomolog; två spiralformade filament omsluter varandra. Detta kan återspegla en optimal struktur för denna roll eftersom det icke-relaterade plasmidfördelningsproteinet ParM uppvisar en liknande struktur.
Cellform
CetZ fungerar i cellformsförändringar i pleomorphic Haloarchaea . I Haloferax volcanii bildar CetZ dynamiska cytoskelettstrukturer som krävs för differentiering från en plattformad cellform till en stavformad form som uppvisar simmotilitet.
Typer
Eukaryot
Tubulinsuperfamiljen innehåller sex familjer (alfa-(α), beta-(β), gamma-(γ), delta-(δ), epsilon-(ε) och zeta-(ζ)-tubuliner).
a-tubulin
Humana α-tubulinsubtyper inkluderar: [ citat behövs ]
p-tubulin

Alla läkemedel som är kända för att binda till humant tubulin binder till β-tubulin. Dessa inkluderar paklitaxel , kolchicin och vinca -alkaloiderna , som var och en har ett distinkt bindningsställe på β-tubulin.
Flera antimaskläkemedel riktar sig dessutom företrädesvis mot kolchicinstället för β-Tubulin i mask snarare än i högre eukaryoter. Medan mebendazol fortfarande behåller viss bindningsaffinitet till humant och Drosophila β-tubulin, binder albendazol nästan uteslutande till β-tubulin från maskar och andra lägre eukaryoter.
Klass III β-tubulin är ett mikrotubulielement som uteslutande uttrycks i neuroner och är en populär identifierare som är specifik för neuroner i nervvävnad. Det binder kolchicin mycket långsammare än andra isotyper av β-tubulin.
β1-tubulin , ibland kallat klass VI β-tubulin, är det mest divergerande på aminosyrasekvensnivå. Det uttrycks uteslutande i megakaryocyter och blodplättar hos människor och verkar spela en viktig roll i bildandet av blodplättar. När klass VI β-tubulin uttrycktes i däggdjursceller orsakar de avbrott i mikrotubulinätverket, bildning av mikrotubulifragment och kan i slutändan orsaka marginalbandliknande strukturer som finns i megakaryocyter och blodplättar.
Katanin är ett proteinkomplex som bryter mikrotubuli vid β-tubulinsubenheter och är nödvändigt för snabb mikrotubulitransport i neuroner och i högre växter.
Humana β-tubuliner undertyper inkluderar: [ citat behövs ]
y-Tubulin
γ-Tubulin, en annan medlem av tubulinfamiljen, är viktig vid kärnbildning och polär orientering av mikrotubuli. Det finns främst i centrosomer och spindelpolkroppar , eftersom dessa är områdena för rikligast mikrotubuluskärnbildning. I dessa organeller finns flera γ-tubulin- och andra proteinmolekyler i komplex kända som γ-tubulinringkomplex (γ-TuRCs), som kemiskt efterliknar (+)-änden av en mikrotubuli och därmed tillåter mikrotubuli att binda. γ-tubulin har också isolerats som en dimer och som en del av ett γ-tubulin litet komplex (γTuSC), mellan storleken mellan dimeren och γTuRC. γ-tubulin är den bäst förstådda mekanismen för mikrotubuli-kärnbildning, men vissa studier har visat att vissa celler kan anpassa sig till dess frånvaro, vilket indikeras av mutations- och RNAi -studier som har hämmat dess korrekta uttryck. Förutom att bilda en γ-TurC för att kärna och organisera mikrotubuli, kan γ-tubulin polymerisera till filament som sätts samman till buntar och nätverk.
Humana y-tubulin subtyper inkluderar:
Medlemmar av γ-tubulinringkomplexet:
5 och e-Tubulin
Delta (δ) och epsilon (ε) tubulin har visat sig lokaliseras till centrioler och kan spela en roll i centriolstruktur och funktion, även om ingen av dem är lika väl studerad som α- och β-formerna.
Humana δ- och ε-tubulingener inkluderar: [ citat behövs ]
ζ-Tubulin
Zeta-tubulin ( IPR004058 ) finns i många eukaryoter, men saknas från andra, inklusive placenta däggdjur. Det har visat sig vara associerat med den basala fotstrukturen hos centrioler i multicilierade epitelceller.
Prokaryot
BtubA/B
BtubA () och BtubB () finns i vissa bakteriearter i Verrucomicrobiota -släktet Prosthecobacter . Deras evolutionära förhållande till eukaryota tubuliner är oklart, även om de kan ha härstammat från en eukaryot härstamning genom lateral genöverföring . Jämfört med andra bakteriehomologer är de mycket mer lika eukaryota tubuliner. I en sammansatt struktur fungerar BtubB som α-tubulin och BtubA fungerar som β-tubulin.
FtsZ
Många bakteriella och euryarchaeotalceller använder FtsZ för att dela sig via binär fission . Alla kloroplaster och vissa mitokondrier , båda organeller som härrör från endosymbios av bakterier, använder också FtsZ. Det var det första prokaryota cytoskelettproteinet som identifierades.
TubZ
TubZ (; pBt156) identifierades i Bacillus thuringiensis som väsentligt för plasmidupprätthållande . Det binder till ett DNA-bindande protein som kallas TubR (; pBt157) för att dra runt plasmiden.
CetZ
CetZ () finns i de euryarchaeal clades av Methanomicrobia och Halobacteria , där den fungerar i cellformsdifferentiering.
Fagtubuliner
Fager av släktet Phikzlikevirus , såväl som en Serratia -fag PCH45, använder ett skalprotein () för att bygga en kärnliknande struktur som kallas fagkärnan. Denna struktur omsluter DNA såväl som replikations- och transkriptionsmaskineri. Det skyddar fag-DNA från värdförsvar som restriktionsenzymer och typ I CRISPR -Cas-system. Ett spindelbildande tubulin, omväxlande benämnt PhuZ () och gpl87 , centrerar kärnan i cellen.
Odinarchaeota tubulin
Asgard archaea tubulin från hydrotermiskt levande Odinarchaeota (OdinTubulin) identifierades som ett äkta tubulin. OdinTubulin bildar protomerer och protofilament som mest liknar eukaryota mikrotubuli, men sätts ändå samman till ringsystem som mer liknar FtsZ , vilket indikerar att OdinTubulin kan representera en evolution mellan FtsZ och mikrotubulibildande tubuliner.
Farmakologi
Tubuliner är måltavlor för läkemedel mot cancer som vinblastin och vinkristin och paklitaxel . Antimaskläkemedlen mebendazol och albendazol samt antigiktmedlet kolchicin binder till tubulin och hämmar bildningen av mikrotubuli . Medan den förra i slutändan leder till celldöd hos maskar, stoppar den senare neutrofil motilitet och minskar inflammation hos människor. Det svampdödande läkemedlet griseofulvin riktar sig mot bildning av mikrotubuli och har tillämpningar inom cancerbehandling.
Post-translationella modifieringar
När tubulin införlivas i mikrotubuli ackumuleras ett antal posttranslationella modifieringar, av vilka många är unika för dessa proteiner. Dessa modifieringar inkluderar detyrosinering , acetylering , polyglutamylering , polyglycylering , fosforylering , ubiquitinering , sumoylering och palmitoylering . Tubulin är också benäget att oxidativ modifiering och aggregering vid till exempel akut cellskada.
Nuförtiden finns det många vetenskapliga undersökningar av acetyleringen som görs i vissa mikrotubuli, speciellt den av α-tubulin N-acetyltransferas (ATAT1) som har visat sig spela en viktig roll i många biologiska och molekylära funktioner och därför är den också associerad med många mänskliga sjukdomar, speciellt neurologiska sjukdomar .
Se även
externa länkar
- Tubulin vid US National Library of Medicine Medical Subject Headings (MeSH)
- EC 3.6.5.6
- Protokoll för tubulinförsök
- Högupplöst tubulininfografik