Perifert verkande μ-opioidreceptorantagonist
Perifert verkande μ-opioidreceptorantagonister ( ( PAMORAs ) är en klass av kemiska föreningar som används för att vända biverkningar orsakade av opioider som interagerar med receptorer utanför det centrala nervsystemet CNS), främst de som finns i mag-tarmkanalen . PAMORAs är utformade för att specifikt hämma vissa opioidreceptorer i mag-tarmkanalen och med begränsad förmåga att passera blod-hjärnbarriären . Därför påverkar PAMORA inte de smärtstillande effekterna av opioider i det centrala nervsystemet.
Upptäckt och utveckling
Opioidläkemedel är kända för att orsaka opioidinducerad förstoppning (OIC) genom att hämma magtömning och minska peristaltiska vågor som leder till försenad absorption av mediciner och mer vattenabsorption från avföringen . Det kan resultera i hård och torr avföring och förstoppning för vissa patienter.
OIC är en av de vanligaste biverkningarna som orsakas av opioider, så upptäckten av PAMORA kan förhindra de effekter som ofta äventyrar smärtbehandling .
Metylnaltrexonbromid var det första läkemedlet i läkemedelsklassen som godkändes av FDA . Det upptäcktes 1979 av Leon Goldberg, en farmakolog vid University of Chicago . Efter att ha sett lidandet av en döende vän med OIC, testade Goldberg olika derivat av naltrexon , ett läkemedel som är känt för att blockera effekterna av opioider. Hans mål var att hitta ett läkemedel som inte kunde passera blod-hjärnbarriären utan att påverka de smärtstillande effekterna av opioiderna. Efter att Goldberg dog fortsatte hans kollegor vid universitetet att utveckla föreningen. Det godkändes av FDA i april 2008, ursprungligen för OIC hos vuxna patienter med avancerad sjukdom och senare hos vuxna patienter med kronisk icke-cancersmärta.
-talet forskade Dennis M. Zimmerman och hans medarbetare från Lilly Research Laboratories, Indiana, om strukturella koncept för narkotiska antagonister definierade i en 4-fenylpiperidinserie. De rapporterade att N -metyl- trans -3,4-dimetyl-4-fenylpiperidin var en ren opioidreceptorantagonist med en ny farmakofor . För att öka styrkan fäste de en fenolgrupp till den aromatiska ringen , N -metyl- trans -3,4-dimetyl-4-(3-hydroxifenyl)piperidin. Den strukturen användes för att designa och utveckla andra opioidreceptorantagonister som alvimopan . Alvimopan godkändes senare under 2008 för användning på sjukhus för att öka den gastrointestinala funktionen efter en partiell tjock- eller tunntarmsresektion med primär anastomos . Naloxegol godkändes i september 2014 och naldemedin i mars 2017, båda för behandling av OIC hos vuxna patienter med kronisk cancer.
Handlingsmekanism
PAMORAs verkar genom att hämma bindningen av opioidagonister till μ -opioidreceptorn ( MOR). Målet med PAMORAs behandling är att återställa det enteriska nervsystemets funktion (ENS). MOR finns på flera ställen i kroppen och PAMORAs är en kompetitiv antagonist för bindning till receptorn. MOR i mag-tarmkanalen är de huvudsakliga receptorerna som PAMORAs är avsedda att blockera och förhindra bindningen av opioidagonister. PAMORA används vid behandling av opioidinducerad tarmdysfunktion (OIBD), en potentiell negativ effekt orsakad av kronisk opioidanvändning. PAMORAs verkar på de tre patofysiologiska mekanismerna för denna negativa effekt. De verkar på tarmens rörlighet , tarmsekretion och sfinkterfunktion .
PAMORAs effekt på tarmens motilitet är att den kan öka vilotonen i det cirkulära muskellagret. Antagonisten förstärker effekten på tonisk hämning av muskeltonus . Detta kommer att normalisera tonen i det cirkulära muskellagret och därför förhindra opioid-inducerade rytmiska sammandragningar. När dessa två faktorer kombineras resulterar det i minskad transporttid . Underförstått kommer dessa effekter att minska den passiva absorptionen av vätskor, vilket hjälper till att minska OIBD-symtom som förstoppning, tarmspasmer och magkramper .
PAMORAs effekt på tarmsekretion kommer att hjälpa till att vända den minskade cAMP- bildningen som opioidagonister inducerar. Dessutom kommer antagonisten att etablera en normal utsöndring av klorid . Opioidagonister kan också minska utsöndringen av peptider genom att öka det sympatiska nervsystemet genom μ-receptorerna i ENS, vilket kan leda till torrare och hårdare avföring. PAMORAs motverkar det så att avföringen blir mjukare och mindre torr.
sfinkterns funktion är i teorin att reglera rörelsekoordinationen. Antagonisten kan förhindra sfinkter av Oddi-dysfunktion som orsakas av opioider. Antagonister kan också minska opioidinducerad analsfinkterdysfunktion. Dysfunktionen är kopplad till ansträngning , hemorrojder och ofullständig tömning.
Struktur–aktivitet relation
Även om μ-opioid receptor (MOR) målinriktade läkemedel har använts under lång tid, är inte mycket känt om struktur-aktivitetssambandet och ligand -receptor-interaktionerna på basis av väldefinierade biologiska effekter på receptoraktivering eller hämning. Dessutom är skillnaden i receptor-ligandinteraktionsmönstren för agonister och antagonister inte känd med säkerhet. En teori säger att morfinans biologiska aktivitet kan bestämmas av storleken på N-substituenterna. Till exempel har antagonister vanligtvis större substituenter, såsom allyl- eller cyklopropylmetyl vid morfinan-kvävet, medan agonister i allmänhet innehåller en metylgrupp . Å andra sidan visas agonistaktivitet även i ligander med större grupper vid morfinankvävet, och därför utmanas denna hypotes.
Strukturera
Metylnaltrexonbromid, naloxegol och naldemedin har alla liknande strukturer, vilket inte är långt borta från den kemiska strukturen hos morfin och andra MOR-agonister. Alla innehåller en stel pentacyklisk struktur som involverar bensenring (A), tetrahydrofuranring (B), två cyklohexanringar (C och D) och en piperidinring (E). De viktigaste funktionella grupperna för den biologiska verkan av opioider är hydroxylgruppen på fenolen , N-metylgruppen, eterbryggan mellan C4 och C5, dubbelbindningen mellan kolnummer C7 och C8 och hydroxylgrupperna vid C3 och C6. Fenolringen och dess 3-hydroxylgrupp är avgörande för de smärtstillande effekterna eftersom avlägsnandet av OH-gruppen minskar den smärtstillande aktiviteten 10 gånger. Det finns en annan princip för hydroxylgruppen på C6 eftersom avlägsnandet ökar dess aktivitet. Den ökade aktiviteten beror främst på den ökade lipofilicitet och den ökade förmågan att passera blod-hjärnbarriären. Naldemedin har hydroxylgruppen medan metylnaltrexonbromid har en ketongrupp och naloxegol har en ester . Dubbelbindningen mellan C7 och C8 krävs inte för den analgetiska effekten och reduktion av dubbelbindningen kommer att öka aktiviteten. Ingen av antagonisterna har en dubbelbindning i sin struktur. N-substituenten på skelettet tros bestämma det farmakologiska beteendet och dess interaktion med MOR. Det anses också spela en nyckelroll för att skilja antagonister från agonister. Allylgrupp, en metylcyklopropylgrupp eller en metylcyklobutyl som N-substituentgrupper tros leda antagonistaktivitet.
Bindande webbplats
Agonister och antagonister bildar vissa kemiska bindningar med aminosyror som konstruerar MOR. Majoriteten av antagonister, såväl som agonister, förutsägs bilda laddad interaktion med Asp147 och en vätebindning med Tyr148. Emellertid bildar majoriteten av antagonisterna ytterligare polära interaktioner med andra aminosyrarester såsom Lys233, Gln124, Gln229, Asn150, Trp318 och Tyr128. Endast en liten minoritet av agonister bildar samma ytterligare polära interaktioner. Både agonister och antagonister är kända för att bilda vätebindningar med His297.
Man kan dra slutsatsen att interaktioner med aminosyraresterna, Asp147 och Tyr148, är väsentliga för att liganden ska binda till receptorn och de molekyler som bildar ytterligare polära interaktioner med andra rester är oftare antagonister än agonister.
N-substituentgruppen kan bilda hydrofoba bindningar med Tyr326 och Trp293 och de aromatiska och cyklohexanringarna kan bilda liknande bindningar som Met151. Baksidan av liganden kan också bilda en hydrofob bindning, men med Val300 och Ile296.
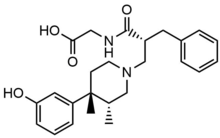
Metylnaltrexonbromid
Metylnaltrexonbromid är bromidsaltformen av metylnaltrexon, ett kvartärt metylderivat av noroximorfon . Metylgruppen och den kvartära saltbildningen ökar polariteten och minskar lipidlösligheten och begränsar därmed penetreringen av blod-hjärnbarriären. Metylnaltrexon har åtta gånger högre affinitet för MOR än för κ-opioidreceptor (KOR) och δ-opioidreceptor (DOR). Naltrexon bildar interaktion med Asp147 och Tyr148 tillsammans med en vätebindning med Lys233.
Alvimopan
Perifert selektiva trans-3,4-dimetyl-4-(3-hydroxylfenyl)piperidinopioidantagonister utvecklades för behandling av gastrointestinal motilitetsstörning av Zimmerman och hans medarbetare. Från det härledde de 4-(3-hydroxifenyl)-3,4-dimetylpiperidinställningen med funktionella grupper som spänner över olika storlekar, laddning och polaritet för att nå perifer opioidreceptorantagonism samtidigt som de minskar CNS-läkemedelsexponeringen. In vitro μ-Ki, in vivo AD50 och ED50 och perifert index (kvot) undersöktes för flera selektiva analoger, och från det fann de att trans-3,4-dimetyl-4-(3-hydroxifenyl) piperidin, Alvimopan, gav bäst resultat. Den stora zwitterjoniska strukturen och den höga polariteten hindrar Alvimopan från att passera blod-hjärnbarriären, styrkan vid bindning av perifera MOR är därmed 200 gånger den för centrala MOR.
Naloxegol
Naloxegol är ett polyetylenglykol -modifierat derivat av α- naloxol . Naloxegol har en liknande form som naloxon som en heteropentacyklisk förening som båda har en allylgrupp bunden till aminen i piperidinringen . Naloxegol har emellertid en monometoxi-terminerad n=7- oligomer av PEG kopplad till 6-alfa-hydroxylgruppen av ɑ-naloxol via en eterbindning . PEG-delen ökar molekylvikten och begränsar därför upptaget av naloxegol i CNS . Dessutom blir pegylerat naloxegol ett substrat för P-glykoproteinutflödestransportören som transporterar föreningen ut ur CNS.
Naldemedine
Naldemedin har en liknande kemisk struktur som naltrexon men med en ytterligare sidokedja som ökar ämnets molekylvikt och polära yta . Liksom naloxegol är naldemedin ett substrat för P-glykoproteinutflödestransportören. Dessa egenskaper resulterar i mindre penetration i CNS och minskar möjliga slutsatser av effekterna av opioidagonister. Naldemedine är en dubbel antagonist för MOR och DOR. Aktivering av DOR har varit känt för att orsaka illamående och/eller kräkningar, så en dubbel antagonist kan minska både OIC och illamående/kräkningar.
Farmakokinetik
Molekylvikten , biotillgängligheten , proteinbindningen , eliminationshalveringstiden , tiden för att uppnå maximal plasmakoncentration och bindningsaffiniteten finns i tabellen nedan .
| Kemiskt namn | Kemisk struktur | Molekylvikt (g/mol) | Biotillgänglighet (%) | Plasmaproteinbindning (%) | t 1/2 (h) | t max | Ki μ (nM) | Ki κ (nM) | Ki δ (nM) |
|---|---|---|---|---|---|---|---|---|---|
| Metylnaltrexonbromid _ |
 |
436,3 | Låg | 11-15 | 8 | 30 minuter | 5,50 | 32.1 | 3453,8 |
| Alvimopan | 424,53 | 6 | 80-90 | 10-17 | 2 h | 0,77 | 40 | 4.4 | |
| Naloxegol | 651,798 | NA | 4,2 | 6-11 | 2 h | 7,42 | 8,65 | 203,0 | |
| Naldemedine | 570,6 | 29 | 93-94 | 11 | 45 min | 0,34 | 0,94 | 0,43 |
- t 1/2 : Biologisk halveringstid
- t max : Tid för att uppnå maximal plasmakoncentration
- pKi : mätning av ligandbindningsaffinitet
Metylnaltrexonbromid har dålig oral biotillgänglighet och av den anledningen administreras det varannan dag subkutant . Ungefär hälften av dosen utsöndras i urinen och något mindre i avföring med 85 % eliminerad oförändrad.
Alvimopan har avsevärt låg biotillgänglighet (6%) på grund av dess höga bindningsaffinitet och låga dissociationshastighet . I huvudsak medieras alvimopan av gallsekretion med en genomsnittlig plasmaclearance på 400 ml/min. Metabolism av alvimopan sker via tarmfloran, vilket resulterar i hydrolys av alvimopan till den aktiva amidmetaboliten (ADL 08-0011). Emellertid anses metaboliten vara kliniskt irrelevant på grund av dess låga bindningsaffinitet.
När naloxegol ges tillsammans med en fet måltid ökar absorptionen . Clearance sker mestadels via levermetabolism (P450-CYP3A) med okänd verkan av metaboliterna. Naloxegol har små fragment som elimineras genom renal utsöndring .
Naldemedin metaboliter huvudsakligen via CYP3A till nor-naldemedin, det metaboliter också via UDP-glukuronosyltransferas 1A3 till naldemedin 3-G, men i mindre utsträckning. Dessa metaboliter är båda opioidreceptorantagonister men är mindre potenta än modersubstansen .
PAMORAs under utveckling

Axelopran är en oral PAMORA som är under utveckling av Theravane Biopharma. Den har avslutat fas II i kliniska prövningar på mer än 400 patienter med OIC. Axelopran har en annan kemisk struktur än andra PAMORA men med en liknande verkningsmekanism . Den fungerar som en antagonist för MOR, KOR och DOR, men med högre affinitet för MOR och KOR än för DOR. Liksom andra PAMORA är huvudmålet behandlingen av OIC. Axelopran undersöks också i kombination med fast dos (FDC) med oxikodon . Det görs genom att använda spraybeläggningsteknik för att skapa en FDC av axelopran och oxikodon med kontrollerad frisättning.
Det finns ett behov av optimering av receptorselektiviteten och affiniteten åtföljd av en utforskning av kandidatföreningar angående deras administreringsväg . Dessa är huvudmålen och framtida strategier för läkemedelsupptäckt och utveckling av PAMORA. Övervägande uppvisar MOR:erna funktionellt selektiv agonism. Därför är framtida möjliga kandidatföreningar som är inriktade på OIC PAMORAs med optimerad selektivitet och affinitet.