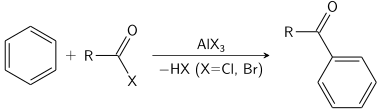Elektrofil aromatisk substitution
Elektrofil aromatisk substitution är en organisk reaktion där en atom som är fäst vid ett aromatiskt system (vanligtvis väte) ersätts med en elektrofil . Några av de viktigaste elektrofila aromatiska substitutionerna är aromatisk nitrering , aromatisk halogenering , aromatisk sulfonering och alkylerings- och acyleringsfriedel -Crafts-reaktion .
Illustrativa reaktioner
Det mest utövade exemplet på denna reaktion är etylering av bensen.
produceras plasten polystyren .) I denna process används syror som katalysator för att generera den begynnande karbokaten. Många andra elektrofila reaktioner av bensen utförs, fastän i mycket mindre skala; de är värdefulla vägar till viktiga mellanprodukter. Nitreringen av bensen uppnås genom verkan av nitroniumjonen som elektrofil. Sulfoneringen med rykande svavelsyra ger bensensulfonsyra . Aromatisk halogenering med brom , klor eller jod ger motsvarande arylhalider. Denna reaktion katalyseras typiskt av motsvarande järn- eller aluminiumtrihalogenid.
Friedel -Crafts-reaktionen kan utföras antingen som en acylering eller som en alkylering . Ofta används aluminiumtriklorid , men nästan vilken stark Lewis-syra som helst kan appliceras. För acyleringsreaktionen krävs en stökiometrisk mängd aluminiumtriklorid.
Reaktionsmekanism
Den övergripande reaktionsmekanismen, betecknad med Hughes-Ingolds mekanistiska symbol S E Ar , börjar med att den aromatiska ringen angriper elektrofilen E + (2a). Detta steg leder till bildandet av en positivt laddad och delokaliserad cyklohexadienylkatjon , även känd som en areniumjon , Wheland-intermediär eller aren σ-komplex (2b) . Många exempel på denna karbokatjon har karakteriserats, men under normala driftsförhållanden kommer dessa mycket sura arter att donera protonen fäst vid sp 3 -kolet till lösningsmedlet (eller någon annan svag bas) för att återupprätta aromaticiteten. Nettoresultatet är ersättningen av H med E i arylringen (3).
Ibland kommer andra elektrofuger (grupper som kan lämna utan sitt elektronpar ) bredvid H + att avgå för att återupprätta aromaticiteten; dessa arter inkluderar silylgrupper (som SiR3 + ) , karboxigruppen (som CO2 + H + ), jodgruppen (som I + ) och tertiära alkylgrupper som t -butyl (som R + ). Kapaciteten hos dessa typer av substituenter att lämna utnyttjas ibland syntetiskt, särskilt vid ersättning av silyl med en annan funktionell grupp ( ipso -attack). Men förlusten av grupper som jod eller alkyl är oftare en oönskad bireaktion.
Effekt av substituentgrupper
Både regioselektiviteten — de olika arenesubstitutionsmönstren — och hastigheten för en elektrofil aromatisk substitution påverkas av de substituenter som redan är bundna till bensenringen. När det gäller regioselektivitet främjar vissa grupper substitution vid orto- eller parapositionerna , medan andra grupper föredrar substitution vid metapositionen. Dessa grupper kallas antingen orto-para-dirigering eller meta-dirigering . Dessutom kommer vissa grupper att öka reaktionshastigheten ( aktivera ) medan andra kommer att minska hastigheten ( avaktivera ). Medan regionselektivitetsmönstren kan förklaras med resonansstrukturer , kan påverkan på kinetiken förklaras av både resonansstrukturer och den induktiva effekten .
Reaktionshastighet
Substituenter kan generellt delas in i två klasser vad gäller elektrofil substitution: aktiverande och deaktiverande mot den aromatiska ringen. Aktiverande substituenter eller aktiverande grupper stabiliserar den katjoniska mellanprodukten som bildas under substitutionen genom att donera elektroner till ringsystemet, antingen genom induktiv effekt eller resonanseffekter . Exempel på aktiverade aromatiska ringar är toluen , anilin och fenol .
Den extra elektrontätheten som levereras till ringen av substituenten är inte jämnt fördelad över hela ringen utan är koncentrerad till atomerna 2, 4 och 6, så aktiverande substituenter är också orto/para-styrningar (se nedan).
Å andra sidan deaktiverar deaktiverande substituenter den mellanliggande katjonen och minskar således reaktionshastigheten genom antingen induktiva eller resonanseffekter. De gör det genom att dra tillbaka elektrontätheten från den aromatiska ringen. Deaktiveringen av det aromatiska systemet innebär att generellt sett krävs hårdare förhållanden för att driva reaktionen till fullbordan. Ett exempel på detta är nitrering av toluen vid framställning av trinitrotoluen (TNT). Medan den första nitreringen, på den aktiverade toluenringen, kan göras vid rumstemperatur och med utspädd syra, behöver den andra, på den deaktiverade nitrotoluenringen, redan långvarig uppvärmning och mer koncentrerad syra, och den tredje, på mycket kraftigt deaktiverad dinitrotoluen, måste göras i kokande koncentrerad svavelsyra . Grupper som är elektronbortdragande genom resonans minskar elektrontätheten speciellt vid positionerna 2, 4 och 6, vilket lämnar positionerna 3 och 5 som de med jämförelsevis högre reaktivitet, så dessa typer av grupper är meta-direktörer (se nedan). Halogener är elektronegativa, så de avaktiveras genom induktion, men de har ensamma par, så de är resonansdonatorer och därför orto/para-direktörer.
Ortho/para regissörer
Grupper med odelade elektronpar, såsom aminogruppen i anilin , är starkt aktiverande och orto/para -styrande genom resonans. Sådana aktiverande grupper donerar de odelade elektronerna till pi -systemet, vilket skapar en negativ laddning på orto- och parapositionerna. Dessa positioner är således de mest reaktiva mot en elektronfattig elektrofil. Denna ökade reaktivitet kan kompenseras av steriskt hinder mellan aktiverande grupp och elektrofil men å andra sidan finns det två ortopositioner för reaktion men bara en paraposition. Följaktligen är det slutliga resultatet av den elektrofila aromatiska substitutionen svårt att förutsäga, och det fastställs vanligtvis endast genom att utföra reaktionen och observera förhållandet mellan orto kontra para substitution.
Förutom den ökade nukleofila naturen hos den ursprungliga ringen, när elektrofilen angriper orto- och parapositionerna för anilin, kan kväveatomen donera elektrontäthet till pi- systemet (bildar en iminiumjon ), vilket ger fyra resonansstrukturer (i motsats till tre i grundreaktionen). Detta förbättrar avsevärt stabiliteten hos den katjoniska mellanprodukten.
När elektrofilen attackerar metapositionen kan kväveatomen inte donera elektrontäthet till pi- systemet, vilket bara ger tre resonansbidragsgivare. Detta resonemang överensstämmer med låga utbyten av meta-substituerad produkt.
Andra substituenter, såsom alkyl- och arylsubstituenterna , kan också donera elektrondensitet till pi- systemet; men eftersom de saknar ett tillgängligt odelat elektronpar är deras förmåga att göra detta ganska begränsad. Således aktiverar de endast svagt ringen och missgynnar inte metapositionen starkt .
Riktad ortometallering är en speciell typ av EAS med speciella orto-direktörer .
Meta regissörer
Icke-halogengrupper med atomer som är mer elektronegativa än kol, såsom en karboxylsyragrupp (-CO 2 H), drar ut avsevärd elektrondensitet från pi - systemet. Dessa grupper är starkt inaktiverande grupper . Dessutom, eftersom det substituerade kolet redan är elektronfattigt, är varje struktur som har en resonansbidragsfaktor där det finns en positiv laddning på kolet som bär den elektronbortdragande gruppen (dvs. orto- eller para - attack ) mindre stabil än de andra. Därför är dessa elektronbortdragande grupper meta -riktade eftersom detta är positionen som inte har lika mycket destabilisering.
Reaktionen är också mycket långsammare (en relativ reaktionshastighet på 6×10 −8 jämfört med bensen) eftersom ringen är mindre nukleofil.
Reaktion på pyridin
Jämfört med bensen är hastigheten för elektrofil substitution på pyridin mycket långsammare, på grund av den högre elektronegativiteten hos kväveatomen. Dessutom får kvävet i pyridin lätt en positiv laddning antingen genom protonering (från nitrering eller sulfonering ) eller Lewis-syror (som AlCl3 ) som används för att katalysera reaktionen. Detta gör reaktionen ännu långsammare genom att ha intilliggande formella laddningar på kol och kväve eller 2 formella laddningar på en lokaliserad atom. Att göra en elektrofil substitution direkt i pyridin är nästan omöjligt.
För att göra reaktionen kan de göras av 2 möjliga reaktioner, som båda är indirekta.
Ett möjligt sätt att göra en substitution på pyridin är nukleofil aromatisk substitution. Även utan katalysatorer kan kväveatomen, som är elektronegativ, hålla den negativa laddningen av sig själv. Ett annat sätt är att göra en oxidation före den elektrofila substitutionen. Detta gör pyridin N -oxid , som på grund av den negativa syreatomen, gör reaktionen snabbare än pyridin, och även bensen. Oxiden kan sedan reduceras till den substituerade pyridinen.
Ipso attack
Fästningen av en ingående grupp till en position i en aromatisk förening som redan bär en substituentgrupp (annan än väte). Den inkommande gruppen kan ersätta den substituentgruppen men kan också själv fördrivas eller migrera till en annan position i ett efterföljande steg. Termen " ipso -substitution" används inte, eftersom det är synonymt med substitution. Ett klassiskt exempel är reaktionen mellan salicylsyra och en blandning av salpetersyra och svavelsyra för att bilda pikrinsyra . Nitreringen av 2-positionen innebär förlust av CO 2 som den lämnande gruppen. Desulfonering där en sulfonylgrupp är substituerad med en proton är ett vanligt exempel. Se även Hayashi omarrangemang . I aromater substituerade med kisel reagerar kislet genom ipso- substitution.
Femledade heterocykler
Jämfört med bensen är furaner , tiofener och pyrroler mer mottagliga för elektrofil attack. Dessa föreningar innehåller alla en atom med ett odelat elektronpar ( syre , svavel eller kväve ) som en del av den aromatiska ringen, vilket väsentligt stabiliserar den katjoniska mellanprodukten. Exempel på elektrofila substitutioner till pyrrol är Pictet-Spengler-reaktionen och Bischler-Napieralski-reaktionen .
Asymmetrisk elektrofil aromatisk substitution
Elektrofila aromatiska substitutioner med prokirala kolelektrofiler har anpassats för asymmetrisk syntes genom att byta till kirala Lewis- syrakatalysatorer, särskilt i reaktioner av Friedel-Crafts-typ . Ett tidigt exempel gäller tillsatsen av kloral till fenoler katalyserade av aluminiumklorid modifierad med (–)-mentol . En glyoxylatförening har tillsatts till N,N-dimetylanilin med en kiral bisoxazolinligand – koppar(II)triflatkatalysatorsystem också i en Friedel-Crafts hydroxialkylering :
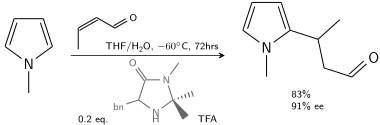
I en annan alkylering reagerar N-metylpyrrol med krotonaldehyd katalyserad av trifluorättiksyra modifierad med en kiral imidazolidinon :
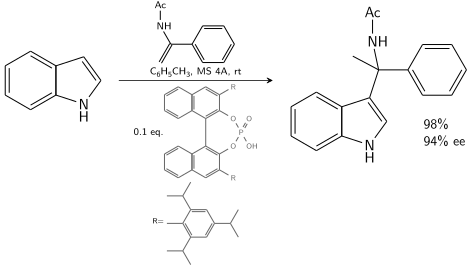
Indol reagerar med en enamid katalyserad av en kiral BINOL - härledd fosforsyra :
I närvaro av 10–20 % kiral katalysator kan 80–90 % ee uppnås.
Andra reaktioner
- Andra reaktioner som följer ett elektrofilt aromatiskt substitutionsmönster är en grupp aromatiska formyleringsreaktioner inklusive Vilsmeier-Haack-reaktionen , Gattermann Koch-reaktionen och Reimer-Tiemann-reaktionen .
- Andra elektrofiler är aromatiska diazoniumsalter i diazoniumkopplingar , koldioxid i Kolbe–Schmitt-reaktionen och aktiverade karbonylgrupper i Pechmann-kondensationen , hydroxikarbeniumjon i Blanc-klormetyleringen via en mellanprodukt (hydroximetyl)aren (bensylalkohol), klorylkatjon (ClO 3 + ) för elektrofil perklorylering .
- I flerstegsreaktionen Lehmstedt–Tanasescu är en av elektrofilerna en N-nitroso-mellanprodukt.
- I Tscherniac–Einhorn-reaktionen (uppkallad efter Joseph Tscherniac och Alfred Einhorn ) är elektrofilen ett N-metanolderivat av en amid