Bureffekt
Inom kemi beskriver bureffekten (även känd som geminate recombination ) hur egenskaperna hos en molekyl påverkas av dess omgivning . Bureffekten, som först introducerades av Franck och Rabinowitch 1934, tyder på att istället för att fungera som en individuell partikel, beskrivs molekyler i lösningsmedel mer exakt som en inkapslad partikel. De inkapslade molekylerna eller radikalerna kallas burpar eller geminatpar . För att interagera med andra molekyler måste den inkapslade partikeln diffundera från sin lösningsmedelsbur. Den typiska livslängden för en lösningsmedelsbur är 10-11 sekunder . Många manifestationer av bureffekten finns.
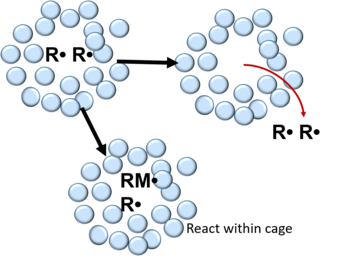
Vid friradikalpolymerisation omges radikaler som bildas från sönderdelningen av en initiatormolekyl av en bur som består av lösningsmedels- och/eller monomermolekyler. Inuti buren genomgår de fria radikalerna många kollisioner som leder till att de rekombineras eller ömsesidigt deaktiveras. Detta kan beskrivas med följande reaktion:
Efter rekombination kan fria radikaler antingen reagera med monomermolekyler inom burens väggar eller diffundera ut ur buren. I polymerer är sannolikheten för ett par fria radikaler att undkomma rekombination i buren 0,1 – 0,01 och 0,3-0,8 i vätskor. Inom unimolekylär kemi har geminatrekombination först studerats i lösningsfasen med jodmolekyler och hemproteiner . I fast tillstånd har geminate rekombination visats med små molekyler fångade i ädelgas fasta matriser och i trijodid kristallina föreningar.
Burrekombinationseffektivitet
Bureffekten kan kvantitativt beskrivas som burrekombinationseffektiviteten Fc där :
Här definieras Fc som förhållandet mellan hastighetskonstanten för burrekombination (kc ) och summan av hastighetskonstanterna för alla burprocesser. Enligt matematiska modeller är Fc beroende av förändringar på flera parametrar inklusive radikalstorlek, form och lösningsmedelsviskositet. Det rapporteras att bureffekten kommer att öka med en ökning av radikalstorlek och en minskning av radikalmassa.
Initiativtagarens effektivitet
Vid friradikalpolymerisation beror initieringshastigheten på hur effektiv initiatorn är. Låg initiatoreffektivitet, ƒ, tillskrivs till stor del bureffekten. Initieringshastigheten beskrivs som:
där Ri är initieringshastigheten, kd är hastighetskonstanten för initiatordissociation, [I] är den initiala koncentrationen av initiator. Initiatoreffektivitet representerar den del av primära radikaler R·, som faktiskt bidrar till kedjeinitiering. På grund av bureffekten kan fria radikaler genomgå ömsesidig deaktivering vilket ger stabila produkter istället för att initiera spridning – vilket minskar värdet på ƒ.


![{\displaystyle R_{i}=2fk_{d}[I]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2936da4d0aabb5a11998aa807c6c5b1e446bd966)