Elektrofila aromatiska styrgrupper
I elektrofila aromatiska substitutionsreaktioner påverkar existerande substituentgrupper på den aromatiska ringen den totala reaktionshastigheten eller har en styrande effekt på positionsisomeren av de bildade produkterna . En elektrondonerande grupp ( EDG ) eller elektronfrigörande grupp ( ERG , Z i strukturformler) är en atom eller funktionell grupp som donerar en del av sin elektrontäthet till ett konjugerat π-system via resonans (mesomerism) eller induktiva effekter (eller induktion)— kallas +M- respektive +I -effekter - vilket gör π-systemet mer nukleofilt . Som ett resultat av dessa elektroniska effekter är det mer sannolikt att en aromatisk ring som en sådan grupp är fäst vid deltar i en elektrofil substitutionsreaktion . EDG är därför ofta kända som aktiverande grupper , även om steriska effekter kan störa reaktionen.
En elektronåtdragande grupp (EWG) kommer att ha motsatt effekt på ringens nukleofilicitet. EWG tar bort elektrontäthet från ett π-system, vilket gör det mindre reaktivt i denna typ av reaktion, och kallas därför deaktiverande grupper .
EDG och EWG bestämmer också positionerna (i förhållande till sig själva) på den aromatiska ringen där substitutionsreaktioner är mest sannolika att äga rum; denna egenskap är därför viktig i processer för organisk syntes .
Elektrondonerande grupper är i allmänhet orto/para-direktörer för elektrofila aromatiska substitutioner , medan elektronbortdragande grupper i allmänhet är meta-direktörer med undantag för halogenerna som också är orto / para -direktörer eftersom de har ensamma elektronpar som delas med den aromatiska ringen.
Kategorier
Elektrondonerande grupper är vanligtvis indelade i tre nivåer av aktiveringsförmåga (kategorin "extrem" kan ses som "stark".) Elektronutdragande grupper tilldelas liknande grupper. Aktiverande substituenter gynnar elektrofil substitution kring orto- och parapositionerna . Svagt deaktiverande grupper riktar elektrofiler att attackera bensenmolekylen vid orto- och parapositionerna , medan starkt och måttligt deaktiverande grupper riktar attacker mot metapositionen . Detta är inte ett fall av att gynna metapositionen som para- och ortostyrande funktionella grupper, utan snarare missgynna orto- och para - positionerna mer än att de missgynnar metapositionen .
Aktivera grupper
De aktiverande grupperna är mestadels resonansdonatorer (+M). Även om många av dessa grupper också induktivt drar sig tillbaka (–I), vilket är en deaktiverande effekt, är resonanseffekten (eller mesomerisk) nästan alltid starkare, med undantag för Cl, Br och I.
| Storleken på aktivering |
Ersättande namn (i ungefärlig ordning av aktiverande styrka) |
Strukturera | Typ av elektronisk effekt | Riktande effekt |
|---|---|---|---|---|
| Extrem | oxidogrupp | -O − | +I, +M | ortho , para |
| Stark | (substituerade) aminogrupper | -NH 2 , -NHR, -NR 2 |
–Jag, +M | |
| hydroxi- och alkoxigrupper | -ÅH, -ELLER |
|||
| Måttlig | acylamidogrupper | -NHCOR | ||
| acyloxigrupper | -OCOR | |||
| (di)alkylfosfino- , alkyltio- och sulfhydrylgrupper | -PR 2 , -SR, -SH |
+M (svag) | ||
| Svag | fenyl (eller aryl) grupp | -C6H5 _ _ _ | -I, +M; även om andra interaktioner också kan vara inblandade | |
| vinylgrupp | -CH= CH2 | |||
|
alkylgrupper
( t.ex. -CH3 , -C2H5 ) _ |
-R | |||
| karboxylatgrupp | -CO 2 − | +I |
Generellt sett är resonanseffekten av element i den tredje perioden och därefter relativt svag. Detta beror främst på den relativt dåliga orbitala överlappningen av substituentens 3p (eller högre) orbital med 2p orbital av kolet.
På grund av en starkare resonanseffekt och induktiv effekt än de tyngre halogenerna är fluor anomal. Partialhastighetsfaktorn för elektrofil aromatisk substitution på fluorbensen är ofta större än en i para -positionen, vilket gör den till en aktiverande grupp. Omvänt är den måttligt deaktiverad vid orto- och metapositionerna , på grund av närheten av dessa positioner till den elektronegativa fluorsubstituenten.
Inaktiverar grupper
Medan alla inaktiverande grupper induktivt drar sig tillbaka (–I), drar de flesta av dem också tillbaka genom resonans (–M). Halogensubstituenter är ett undantag: de är resonansdonatorer (+M). Med undantag för halogeniderna är de metastyrande grupper.
Halider är orto- , paradirigerande grupper, men till skillnad från de flesta orto- , para- regissörer, deaktiverar halogenider arenen milt. Detta ovanliga beteende kan förklaras av två egenskaper:
- Eftersom halogenerna är mycket elektronegativa orsakar de induktivt uttag (uttag av elektroner från kolatomen i bensen).
- Eftersom halogenerna har icke-bindande elektroner kan de donera elektrontäthet genom pi-bindning (resonansdonation).
De induktiva och resonansegenskaperna konkurrerar med varandra men resonanseffekten dominerar i syfte att styra reaktivitetsställena. För nitrering, till exempel, riktar fluor starkt till para -positionen eftersom orto- positionen är induktivt deaktiverad (86% para , 13% orto , 0,6% meta ). Å andra sidan styr jod till orto- och para- positioner jämförbart (54 % para och 45 % orto , 1,3 % meta ).
| Storleken på avaktivering |
Ersättande namn (i ungefärlig ordning av inaktiverande styrka) |
Strukturera | Typ av elektronisk effekt | Riktande effekt |
|---|---|---|---|---|
| Stark | trifluormetylsulfonylgrupp | -SO 2 CF 3 | -JAG ÄR | meta |
| (substituerade) ammoniumgrupper | -NR3 + (R = alkyl eller H ) | –Jag | ||
| nitrogrupp | -NEJ 2 | -JAG ÄR | ||
| sulfonsyror och sulfonylgrupper | -SO3H , _ -SO 2R _ |
|||
| cyanogrupp | -C≡N | |||
| trihalometylgrupper (starkast för -CF3 - grupp ) | -CX3 (X = F, Cl, Br, I ) | –Jag | ||
| Måttlig | haloformylgrupper | -COX (X = Cl, Br, I) |
-JAG ÄR | |
| formyl- och acylgrupper | -CHO, -COR |
|||
| karboxyl- och alkoxikarbonylgrupper | -CO2H , _ -CO 2R _ |
|||
| (substituerade) aminokarbonylgrupper | -CONH 2 , -CONHR, -CONR 2 |
|||
| Svag | fluorgrupp ( orto- , metapositioner ) | -F | –I, +M ( orto ) | ortho , para |
| nitroso grupp | -N=O | –I, +M (dimer) eller –M (monomer) |
||
| halogrupper | -F(para), -Cl, -Br, -I | –I, +M (svag) |
Olika gruppers effekter på bensen
Karbonyler, sulfonsyror och nitro
På grund av den fullständiga eller partiella positiva laddningen på elementet som är direkt anslutet till ringen för var och en av dessa grupper, har de alla en måttlig till stark elektronbortdragande induktiv effekt (känd som -I-effekten). De uppvisar också elektronbortdragande resonanseffekter, (känd som -M-effekten):
Således gör dessa grupper den aromatiska ringen mycket elektronfattig (δ+) i förhållande till bensen och därför deaktiverar de kraftigt ringen (dvs. reaktioner går mycket långsammare i ringar som bär dessa grupper jämfört med reaktionerna i bensen.)
Aniliner , fenoler och etrar (som anisol )
På grund av elektronegativitetsskillnaden mellan kol och syre/kväve, kommer det att finnas en liten elektronbortdragande effekt genom induktiv effekt (känd som –I-effekten). Den andra effekten som kallas resonans lägger dock tillbaka elektrontätheten till ringen (känd som +M-effekten) och dominerar över den induktiva effekten. Därför är resultatet att de är EDGs och orto / para- direktörer.
Fenol är en orto/para-direktör, men i närvaro av bas är reaktionen snabbare. Det beror på den högre reaktiviteten hos fenolatanjonen . Det negativa syret 'tvingades' för att ge elektrontäthet till kolen (eftersom det har en negativ laddning har det en extra +I-effekt). Även när den är kall och med neutrala (och relativt svaga) elektrofiler sker reaktionen fortfarande snabbt.
Alkylgrupper
Alkylgrupper är elektrondonerande grupper. Kolet på det är sp 3 hybridiserat och mindre elektronegativt än de som är sp 2 hybridiserat . De har överlappning på kol-vätebindningarna (eller kol-kolbindningarna i föreningar som tert -butylbensen) med ringen p-orbital. Därför är de mer reaktiva än bensen och är orto / para- direktörer.
Karboxylat
Induktivt stöter den negativt laddade karboxylatjonen måttligt bort elektronerna i bindningen som fäster den vid ringen. Det finns alltså en svag elektrondonerande +I-effekt. Det finns en nästan noll -M effekt eftersom karbonylgruppens elektronbortdragande resonansförmåga effektivt avlägsnas genom delokalisering av anjonens negativa laddning på syret. Sålunda har totalt sett karboxylatgruppen (till skillnad från karboxylgruppen ) ett aktiverande inflytande.
Alkylammonium- och trifluormetylgrupp
Dessa grupper har en stark elektronbortdragande induktiv effekt (-I) antingen på grund av sin positiva laddning eller på grund av halogenernas kraftfulla elektronegativitet. Det finns ingen resonanseffekt eftersom det inte finns några orbitaler eller elektronpar som kan överlappa med ringens. Den induktiva effekten verkar så för karboxylatanjonen men i motsatt riktning (dvs den producerar små positiva laddningar på orto- och para - positionerna men inte på metapositionen och den destabiliserar Wheland-intermediären .) Därför är dessa grupper deaktiverande och metastyrande :
Haliderar konkurrerande effekter
Induktion kontra resonans
Fluor är något av en anomali i denna omständighet. Ovan beskrivs den som en svag elektronbortdragande grupp men detta är bara delvis sant. Det är korrekt att fluor har en -I-effekt, vilket resulterar i att elektroner dras in induktivt. En annan effekt som dock spelar en roll är +M-effekten som lägger till elektrontätheten tillbaka till bensenringen (och har alltså motsatt effekt av -I-effekten men med en annan mekanism). Detta kallas den mesomeriska effekten (därav +M) och resultatet för fluor är att +M-effekten ungefär tar bort -I-effekten. Effekten av detta för fluorbensen i para -positionen är reaktivitet som är jämförbar med (eller till och med högre än) den för bensen . Eftersom induktiva effekter beror starkt på närhet, meta- och ortopositionerna för fluorbensen avsevärt mindre reaktiva än bensen. Således är elektrofil aromatisk substitution på fluorbensen starkt paraselektiv .
Denna -I- och +M-effekt är sant för alla halogenider - det finns en viss elektrondragande och donerande karaktär hos var och en. För att förstå varför reaktivitetsförändringarna inträffar måste vi överväga de orbitala överlappningar som förekommer i var och en. Valensorbitalerna för fluor är 2p-orbitalerna som är samma för kol - därför kommer de att vara mycket nära i energi och orbital överlappning kommer att vara gynnsam. Klor har 3p valensorbitaler, därför kommer orbitalenergierna att vara längre ifrån varandra och geometrin mindre gynnsam, vilket leder till mindre donation och stabiliserar den karbokatjoniska intermediären, därför är klorbensen mindre reaktiv än fluorbensen . Emellertid brombensen och jodbensen ungefär lika eller lite mer reaktiva än klorbensen, för även om resonansdonationen är ännu värre, försvagas även den induktiva effekten på grund av deras lägre elektronegativitet. Således är den övergripande reaktivitetsordningen U-formad, med ett minimum vid klorbensen/brombensen (relativa nitreringshastigheter jämfört med bensen = 1 inom parentes): PhF (0,18) > PhCl (0,064) ~ PhBr ( 0,060 ) < PhI ( 0,12) . Men ändå reagerar alla halobensener långsammare än bensen själv.
Lägg märke till att jodbensen fortfarande är mindre reaktiv än fluorbensen eftersom polariserbarhet också spelar en roll. Detta kan också förklara varför fosfor i fosfaner inte kan donera elektrontäthet till kol genom induktion (dvs +I-effekt) även om det är mindre elektronegativt än kol (2,19 mot 2,55, se elektronegativitetslista ) och varför jodvätesyra ( pKa = -10) är mycket surare än fluorvätesyra (pKa = 3). (Det är 10 13 gånger surare än fluorvätesyra)
Riktande effekt
På grund av det ensamma elektronparet finns halogengrupper tillgängliga för att donera elektroner. Därför är de därför orto / para -direktörer.
Nitroso grupp
Induktion
På grund av elektronegativitetsskillnaden mellan kol och kväve har nitrosogruppen en relativt stark -I-effekt, men inte lika stark som nitrogruppen. (Positivt laddade kväveatomer på alkylammoniumkatjoner och på nitrogrupper har en mycket starkare -I-effekt)
Resonans
Nitrosogruppen har både en +M- och -M-effekt, men -M-effekten är mer gynnsam.
Kväve har ett ensamt elektronpar. Det ensamma paret av sin monomerform är dock ogynnsamt att donera genom resonans. Endast dimerformen är tillgänglig för +M-effekt. Emellertid är dimerformen mindre stabil i en lösning. Därför är nitrosogruppen mindre tillgänglig för att donera elektroner.
I motsats till detta är borttagande av elektrondensitet mer fördelaktigt: (se bilden till höger).
Som ett resultat är nitrosogruppen en deaktiverare. Den har dock tillgänglig för att donera elektrontäthet till bensenringen under Wheland-intermediären , vilket gör att den fortfarande är en orto / para -direktör .
Steriska effekter
Det finns 2 ortopositioner , 2 metapositioner och 1 paraposition på bensen när en grupp är kopplad till den. När en grupp är en orto/para -direktör med orto- och para -positioner som reagerar med samma partialhastighetsfaktor, skulle vi förvänta oss dubbelt så mycket orto - produkt som paraprodukt på grund av denna statistiska effekt. Emellertid är partialhastighetsfaktorerna vid orto- och parapositionerna i allmänhet inte lika. I fallet med en fluorsubstituent, till exempel, orto- partialhastighetsfaktorn mycket mindre än para , på grund av en starkare induktiv borttagningseffekt vid ortopositionen . Bortsett från dessa effekter finns det ofta också en sterisk effekt , på grund av ökat steriskt hinder vid ortopositionen men inte parapositionen , vilket leder till en större mängd av paraprodukten .
Effekten illustreras för elektrofila aromatiska substitutioner med alkylsubstituenter med olika steriskt behov för elektrofil aromatisk nitrering.
| Substrat | toluen [ -CH3 ] |
etylbensen
[ -CH2CH3 ] _ _ |
kumen
[-CH( CH3 ) 2 ] |
tert -butylbensen [-C( CH3 ) 3 ] |
|---|---|---|---|---|
| ortho produkt | 58 | 45 | 30 | 16 |
| metaprodukt _ | 5 | 6 | 8 | 11 |
| para produkt | 37 | 59 | 62 | 73 |
| orto/para- förhållande | 1,57 | 0,76 | 0,48 | 0,22 |
Metylgruppen i toluen är liten och kommer att leda till att ortoprodukten är huvudprodukten. Å andra sidan t -butylgruppen mycket skrymmande (det finns 3 metylgrupper bundna till ett enda kol) och kommer att leda para- produkten som den huvudsakliga. Även med toluen är produkten inte 2:1 utan har en något mindre ortoprodukt .
Riktande effekt på flera substituenter
När två substituenter redan finns på ringen, kommer den tredje substituentens plats att vara på en lokaliserad plats. Reglerna för substituenten är följande:
- När två orto / para- direktörer är meta till varandra, kommer den tredje substituenten inte att vara placerad mellan dem.
- När både en orto / para- direktör och en meta- direktör finns på ringen, beror den tredje substituentens plats på orto / para -direktören.
- När båda grupperna är av samma typ av regissör (dvs båda orto/para eller båda meta), beror den tredje substituenten på den starkare.
- När båda grupperna har liknande styreffekt och är para till varandra, beror den tredje substituenten på den mindre hindrade.
Rationalisering av styreffekter
Även om steriska effekter är ett övervägande, är den största rationaliseringen av elektrondonerande och elektronbortdragande grupper deras störning av den elektroniska fördelningen av den aromatiska ringen, mestadels via mesomeriska effekter som sträcker sig genom hela det konjugerade systemet, för att skapa områden med överdriven eller bristfällig π elektrondensitet. Övervägandet av resonansformer är användbart i detta avseende, eftersom de tillhandahåller ett bekvämt sätt att bestämma platserna för dessa störningar. Mer specifikt, alla formella negativa eller positiva laddningar i mindre resonansbidragsgivare (de som överensstämmer med den naturliga polarisationen men inte nödvändigtvis följer oktettregeln) reflekterar platser som har en större respektive mindre koefficient i den/de högenergiupptagna π molekylorbital(erna) ). En kolatom med en större koefficient kommer företrädesvis att attackeras, på grund av mer gynnsam orbital överlappning med elektrofilen.
Störningen av en konjugerande elektronbortdragande eller elektrondonerande grupp gör att π-elektronfördelningen liknar den för den elektrondefekta bensylkatjonen respektive elektronöverdriven bensylanjon, även om förändringen i elektronfördelning sker i mindre grad än i dessa begränsningsfall. Således kan vi använda dessa enkla arter, vars π-elektronfördelning kan beräknas med hjälp av enkel Hückel-teori , som modeller för att rationalisera det regiokemiska resultatet av elektrofil aromatisk substitution. Som kan ses är π-elektronpopulationen vid orto- och parapositionerna uttömd för fallet med en elektronbortdragande grupp, vilket gör att meta -attack inträffar som det minst ogynnsamma alternativet. Däremot, när en elektrondonerande grupp är närvarande, orto- och parapositionerna en ökad π-elektronpopulation jämfört med metapositionen , vilket gynnar attacker vid orto- och parapositionerna framför metapositionen .
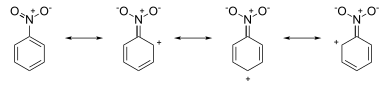
Detta är just det resultat som ritningen av resonansstrukturer skulle förutsäga. Till exempel, i nitrobensen har resonansstrukturerna positiva laddningar runt ringsystemet (se bilden nedan):
Attack inträffar vid metapositionen , eftersom orto- och parapositionerna har (partiella) formella positiva laddningar som tyder på π-elektronbrist vid dessa positioner, vilket lämnar metapositionerna en något högre elektrondensitet. Å andra sidan, i anilin har resonansstrukturerna negativa laddningar runt ringsystemet (se bilden nedan):
Attack inträffar vid orto- och parapositionerna , som har (delvis) formella negativa laddningar som indikerar π-elektronöverskott vid dessa positioner.
Ett annat vanligt argument, som gör identiska förutsägelser, betraktar stabiliseringen eller destabiliseringen av substituenter av Wheland-intermediärerna som ett resultat av elektrofil attack vid orto / para- eller metapositionerna . Hammondpostulatet dikterar sedan att de relativa övergångstillståndsenergierna kommer att återspegla skillnaderna i grundtillståndsenergierna för Wheland-mellanprodukterna. ( Se elektrofil aromatisk substitution för detaljer om detta argument. )
Selektiviteterna som observerades med EDGs och EWGs beskrevs först 1892 och har varit kända som Crum Brown-Gibson-regeln.