Vitamin B 12 total syntes
Den totala syntesen av den komplexa biomolekylen vitamin B 12 åstadkoms på två olika sätt av de samarbetande forskargrupperna Robert Burns Woodward vid Harvard och Albert Eschenmoser vid ETH 1972. Genomförandet krävde ansträngning från inte mindre än 91 postdoktorala forskare (Harvard: 77, ETH: 14), och 12 Ph.D. studenter (vid ETH) från 19 olika nationer under en period på nästan 12 år. Syntesprojektet inducerade och innebar en stor paradigmförändring inom området för syntes av naturliga produkter .
Molekylen
Vitamin B 12 , C 63 H 88 CoN 14 O 14 P, är det mest komplexa av alla kända vitaminer . Dess kemiska struktur hade bestämts genom röntgenkristallstrukturanalys 1956 av forskargruppen Dorothy Hodgkin ( Oxford University ) i samarbete med Kenneth N. Trueblood vid UCLA och John G. White vid Princeton University . Kärnan i molekylen är corrinstrukturen , ett kvävehaltigt tetradentatligandsystem . Detta är biogenetiskt besläktat med porfyriner och klorofyller , men skiljer sig från dem i viktiga avseenden: kolskelettet saknar ett av de fyra mesokolen mellan de femledade ringarna, två ringar (A och D, fig. 1) är direkt förbundna med en kol-kol enkelbindning . Corrinkromoforsystemet är således icke-cykliskt och expanderar endast över tre mesopositioner, och innefattar tre vinylogena amidinenheter . Uppradade vid periferin av den makrocykliska ringen finns åtta metylgrupper och fyra propion- och tre ättiksyrasidokedjor . Nio kolatomer i corrinperiferin är kirogena centra . Den tetradentate, monobasiska corrin-liganden är ekvatorialt koordinerad med en trivalent koboltjon som bär ytterligare två axiella ligander .
flera naturliga varianter av B12- strukturen som skiljer sig åt i dessa axiella ligander. I själva vitaminet bär kobolten en cyanogrupp på översidan av corrinplanet ( cyanokobalamin ) och en nukleotidslinga på den andra. Denna slinga är ansluten på sin andra ände till den perifera propionsyraamidgruppen vid ring D och består av strukturella element som härrör från aminopropanol , fosfat , ribos och 5,6-dimetylbensimidazol . En av kväveatomerna i imidazolringen är axiellt koordinerad till kobolten, nukleotidslingan bildar således en nitton-ledad ring. Alla karboxylgrupper i sidokedjorna är amider.
Kobyrinsyra, ett av de naturliga derivaten av vitamin B12, saknar nukleotidloopen; beroende på naturen hos de två axiella liganderna visar den istället sin propionsyrafunktion vid ring D som karboxylat (som visas i fig. 1), eller karboxylsyra (med två cyanidligander vid kobolt).
De två synteserna
Strukturen av vitamin B 12 var den första naturliga produkten med låg molekylvikt som bestämdes genom röntgenanalys snarare än genom kemisk nedbrytning. Sålunda, medan strukturen för denna nya typ av komplex biomolekyl etablerades, förblev dess kemi väsentligen okänd; utforskning av denna kemi blev en av uppgifterna för vitaminets kemiska syntes . På 1960-talet utgjorde syntesen av en så exceptionellt komplex och unik struktur den stora utmaningen vid frontlinjen för forskning inom syntes av organiska naturprodukter.
Redan 1960 hade forskargruppen till biokemisten Konrad Bernhauer i Stuttgart rekonstituerat vitamin B 12 från ett av dess naturligt förekommande derivat, kobyrinsyra, genom stegvis konstruktion av vitaminets nukleotidslinga. Detta arbete uppgick till en partiell syntes av vitamin B 12 från en naturlig produkt innehållande alla strukturella beståndsdelar av vitamin B 12 förutom nukleotidslingan . Därför valdes kobyrinsyra som målmolekyl för en total syntes av vitamin B12 .
Samarbete mellan forskargrupper vid Harvard och ETH resulterade i två kobyrinsyrasynteser, båda genomförda samtidigt 1972, en vid Harvard och den andra vid ETH. Ett "konkurrenskraftigt samarbete" av den storleken, som involverar 103 doktorander och postdoktorala forskare under totalt nästan 177 årsverken, är hittills unikt i den organiska syntesens historia . De två synteserna är intrikat sammanflätade kemiskt, men de skiljer sig i grunden i hur det centrala makrocykliska corrinligandsystemet är konstruerat. Båda strategierna är mönstrade efter två modell-corrinsynteser utvecklade vid ETH. Den första, publicerad 1964, uppnådde konstruktionen av corrin-kromoforen genom att kombinera en AD-komponent med en BC-komponent via iminoester / enamin -C,C- kondensationer , varvid den slutliga korrin-ringförslutningen uppnåddes mellan ringarna A och B. Den andra modellsyntesen, publicerad 1969, utforskade en ny fotokemisk cykloisomeriseringsprocess för att skapa den direkta A/D-ringövergången som slutlig korrinringförslutning mellan ringarna A och D.
A/B-metoden för kobyrinsyrasynteserna eftersträvades i samarbete och genomfördes 1972 vid Harvard. Den kombinerade en bicyklisk Harvard AD-komponent med en ETH BC-komponent och stängde den makrocykliska korrinringen mellan ringarna A och B. A/D-metoden för syntesen, genomförd vid ETH och avslutades samtidigt som A/B tillvägagångssätt, även 1972, lägger successivt till ringarna D och A till BC-komponenten i A/B-metoden och uppnår korrinringen mellan ringarna A och D. Banorna för de två synteserna möttes i en gemensam korrinoidmellanprodukt. De sista stegen från denna intermediär till kobyrinsyra utfördes i de två laboratorierna igen i samarbete, varvid varje grupp arbetade med material framställt via sitt eget tillvägagångssätt.
Sammanfattning av Harvard/ETH-samarbetet
Början
Woodward och Eschenmoser inledde projektet med en kemisk syntes av vitamin B 12 oberoende av varandra. ETH-gruppen började med en modellstudie om hur man syntetiserar ett corrin-ligandsystem i december 1959. I augusti 1961 började Harvard-gruppen attackera uppbyggnaden av B 12 -strukturen direkt genom att sikta på den mest komplexa delen av B 12 -molekylen, den "västra halvan" som innehåller den direkta förbindelsen mellan ringarna A och D (AD-komponenten). Redan i oktober 1960 hade ETH-gruppen påbörjat syntesen av en ring-B-prekursor för vitamin B 12 .
I början var framstegen vid Harvard snabba, tills ett oväntat stereokemiskt förlopp av ett centralt ringbildningssteg avbröt projektet. Woodwards erkännande av den stereokemiska gåtan som kom i dagen genom det irriterande beteendet i ett av hans noggrant planerade syntetiska steg blev, enligt hans egna skrifter, en del av utvecklingen som ledde till reglerna för orbitalsymmetri .
Efter 1965 fortsatte Harvard-gruppen arbetet mot en AD-komponent enligt en modifierad plan, med (−)-kamfer som källa till ring D.
Förenade krafter: A/B-metoden för kobyrinsyrasyntes
År 1964 hade ETH-gruppen åstadkommit den första syntesen av corrinmodellen , och även framställningen av en ring-B-prekursor som en del av en konstruktion av själva B 12 -molekylen. Eftersom de två gruppernas oberoende framsteg mot deras långsiktiga mål så klart kompletterade varandra, beslöt Woodward och Eschenmoser 1965 att slå sig samman och att från och med då fortsätta projektet med en B 12-syntes i samarbete och planerade att använda ligandkonstruktionen ( ring koppling av komponenter) strategi för ETH-modellsystemet.
År 1966 hade ETH-gruppen lyckats syntetisera BC-komponenten ("östra halvan") genom att koppla deras ring-B-prekursor till ring-C-prekursorn. Den sistnämnda hade också framställts vid Harvard från (−)-kamfer genom en strategi som utarbetades och användes tidigare av A. Pelter och JW Cornforth 1961. Vid ETH involverade syntesen av BC-komponenten implementeringen av C,C- kondensationsreaktion via sulfidkontraktion . Denna nyutvecklade metod visade sig ge en allmän lösning på problemet med att konstruera de karakteristiska strukturella elementen i corrin-kromoforen, de vinylloga amidinsystemen som överbryggar de fyra perifera ringarna.
Tidigt 1967 genomförde Harvard-gruppen syntesen av modell AD-komponenten, med f-sidokedjan odifferentierad, med en metylesterfunktion som alla andra sidokedjor. Därefter utbytte de två grupperna systematiskt prover av sina respektive halvor av den korrinoida målstrukturen. År 1970 hade de i samarbete kopplat Harvards odifferentierade AD-komponent med ETH:s BC-komponent, vilket producerade dicyano-kobolt(III)-5,15-bisnor-heptametyl-kobyrinat 1 ( fig . 4). ETH-gruppen identifierade denna helt syntetiska korrinoid-mellanprodukt genom direkt jämförelse med ett prov framställt av naturligt vitamin B 12 .
I denna avancerade modellstudie fastställdes reaktionsförhållanden för de krävande processerna av C/D-kopplingen och A/B-cykliseringen via sulfidkontraktionsmetoden. De för C/D-kopplingen undersöktes framgångsrikt i båda laboratorierna, de överlägsna förhållandena var de som hittades vid Harvard, medan metoden för A/B-ringförslutning via en intramolekylär version av sulfidkontraktionen utvecklades vid ETH . Senare visades det vid Harvard att A/B-ringförslutningen också kunde uppnås genom tio- iminoester/enaminkondensation.
I början av 1971 hade Harvard-gruppen åstadkommit syntesen av den slutliga AD-komponenten, innehållande f-sidokedjekarboxylfunktionen vid ring D differentierad från alla karboxylfunktioner som en nitrilgrupp (som visas i 2 i fig . 4 ; se även fig. 3 ). A/D-delen av B12- strukturen innefattar den konstitutionellt och konfigurationsmässigt mest invecklade delen av vitaminmolekylen; dess syntes betraktas som apoteosen av Woodwards konst i naturlig produkt total syntes.
Det alternativa tillvägagångssättet för kobyrinsyrasyntes
Redan 1966 hade ETH-gruppen börjat utforska, återigen i ett modellsystem, en alternativ strategi för corrinsyntes där corrinringen skulle slutas mellan ringarna A och D. Projektet var inspirerat av den tänkbara existensen av en hittills okänd obligationsrekonstruktionsprocess. Detta – om det finns – skulle göra det möjligt att bygga kobyrinsyra från ett enda utgångsmaterial. Viktigt är att den hypotetiska processen, som tolkades som att den innebar två sekventiella omarrangemang, erkändes vara formellt täckt av de nya reaktivitetsklassificeringarna av sigmatropiska omarrangemang och elektrocykliseringar som föreslagits av Woodward och Hoffmann i samband med deras orbitalsymmetriregler !
I maj 1968 hade ETH-gruppen i en modellstudie visat att den tänkta processen, en fotokemisk A/D-seko-korrinat→korrinat cykloisomerisering, faktiskt existerar. Denna process visade sig först fortsätta med Pd-komplexet, men inte alls med motsvarande Ni(II)- eller kobolt(III)-A/D-seko-korrinatkomplex. Det gick även smidigt i komplex av metalljoner som zink och andra fotokemiskt inerta och löst bundna metalljoner. Dessa skulle efter ringslutning lätt kunna ersättas med kobolt. Dessa upptäckter öppnade dörren till vad som så småningom blev den fotokemiska A/D-metoden för kobyrinsyrasyntes.
Från och med hösten 1969 med BC-komponenten av A/B-metoden och en ring-D-prekursor framställd av enantiomeren av utgångsmaterialet som ledde till ring-B-prekursorn, tog det doktoranden Walter Fuhrer mindre än en och en halv år för att översätta den fotokemiska modellen corrinsyntes till en syntes av dicyano-kobolt(III)-5,15-bisnor-a,b,d,e,g-pentametyl-kobyrinat-c-N,N-dimetylamid-f - nitril 2 ( fig. 4 ), den vanliga korrinoidmellanprodukten på vägen mot kobyrinsyra. Vid Harvard erhölls samma mellanliggande 2 ungefär samtidigt genom att koppla den ring-D differentierade Harvard AD-komponenten (tillgänglig våren 1971) med ETH BC-komponenten, med tillämpning av de kondensationsmetoder som utvecklats tidigare med den odifferentierade AD-komponenten .
Sålunda, våren 1971, hade två olika vägar till en gemensam korrinoid intermediär 2 ( fig. 4 ) längs vägen till kobyrinsyra blivit tillgängliga, en som krävde 62 kemiska steg ( Harvard/ETH A/B-metoden) , den andra 42 ( ETH) A/D-metoden ). I båda tillvägagångssätten är de fyra perifera ringarna härledda från enantiopura prekursorer som har den korrekta känslan av kiral , och kringgår därigenom stora stereokemiska problem i uppbyggnaden av ligandsystemet. Vid konstruktionen av A/D-övergången genom A/D-secocorrin→ corrin cykloisomerisering, var bildning av två A/D- diastereomerer tvungen att förväntas. Användning av kadmium(II) som den koordinerande metalljonen ledde till en mycket hög diastereoselektivitet till förmån för den naturliga A/D- trans -isomeren.
När corrinstrukturen väl hade formats med endera tillvägagångssättet visade sig de tre CH- kirogena centra i periferin intill kromoforsystemet vara benägna att epimeriseras med exceptionell lätthet. Detta krävde en separation av diastereomerer efter de flesta av de kemiska stegen i detta avancerade steg av synteserna. Det var verkligen tur att precis runt den tiden hade tekniken för högtrycksvätskekromatografi (HPLC) utvecklats inom analytisk kemi. HPLC blev ett oumbärligt verktyg i båda laboratorierna; dess användning i B 12 -projektet, som pionjärer av Jakob Schreiber vid ETH, var den tidigaste tillämpningen av tekniken i syntes av naturliga produkter.
De gemensamma sista stegen
Den slutliga omvandlingen av den gemensamma korrinoidintermediären 2 (fig. 6) från de två tillvägagångssätten till målkobyrinsyran krävde införandet av de två saknade metylgrupperna vid mesopositionerna av corrinkromoforen mellan ringarna A/B och C/D, såväl som omvandlingen av alla perifera karboxylfunktioner till deras amidform, utom den kritiska karboxylen vid ring-D f-sidokedjan (se fig. 6). Dessa steg undersöktes tillsammans på ett strikt parallellt sätt i båda laboratorierna, Harvard-gruppen använde material som producerats via A/B-metoden, ETH-gruppen sådan framställd genom den fotokemiska A/D-metoden.
Den första avgörande identifieringen av en helt syntetisk intermediär på vägen mot kobyrinsyra genomfördes i februari 1972 med ett kristallint prov av helsyntetisk dicyano-kobolt(III)-hexametyl-kobyrinat-f-amid 3 ( fig . 6), funnen. att vara identisk i alla data med ett kristallint reläprov tillverkat av vitamin B 12 genom metanolys till cobester 4 , följt av partiell ammonolys och separation av den resulterande blandningen. När Woodward tillkännagav "Total Synthesis of Vitamin B 12 " vid IUPAC-konferensen i New Delhi i februari 1972, var det helt syntetiska provet av f-amid ett som hade gjorts vid ETH genom den fotokemiska A/D-metoden , medan det första provet av syntetisk kobyrinsyra, identifierat med naturlig kobyrinsyra, hade erhållits vid Harvard genom partiell syntes från B 12 -härlett f-amidrelämaterial. Sålunda hade Woodward/Eschenmoser-prestationen runt den tiden varit, strängt taget, två formella totala synteser av kobyrinsyra, såväl som två formella totalsynteser av vitaminet.
Under senare delen av 1972, två kristallina epimerer av helt syntetisk dicyano-kobolt(III)-hexametyl-kobyrinat-f- amid 3 , samt två kristallina epimerer av den helt syntetiska f-nitril, alla framställda via båda syntetiska metoder, identifierades strängt kromatografiskt och spektroskopiskt med motsvarande B 12 -härledda substanser. Vid Harvard tillverkades sedan kobyrinsyra också av helt syntetisk f-amid 3 framställd via A/B-metoden. , 1976 vid Harvard, omvandlades helt syntetisk kobyrinsyra till vitamin B 12 via den väg som Konrad Bernhauer [ .
Publiceringsprotokollet
Under de nästan 12 år som det tog de två grupperna att nå sitt mål, rapporterade både Woodward och Eschenmoser med jämna mellanrum om scenen för samarbetsprojektet i föreläsningar, några av dem visades i tryck. Woodward diskuterade A/B-metoden i föreläsningar publicerade 1968 och 1971, som kulminerade i tillkännagivandet av "Total Synthesis of Vitamin B 12 " i New Delhi i februari 1972 publicerad 1973. Denna publikation och föreläsningar med samma titel Woodward som levererades under den senare delen av året 1972 är begränsade till A/B-metoden i syntesen och diskuterar inte ETH A/D-metoden.
Eschenmoser hade diskuterat ETH:s bidrag till A/B-metoden 1968 vid den 22:a Robert A. Welch Foundation- konferensen i Houston, såväl som i sin 1969 RSC Centenary Lecture "Roads to Corrins", publicerad 1970. Han presenterade ETH:s fotokemiska A/D-inställning till B 12 -syntesen vid den 23:e IUPAC- kongressen i Boston 1971. Zürich-gruppen tillkännagav genomförandet av syntesen av kobyrinsyra genom den fotokemiska A/D-metoden i två föreläsningar som hölls av doktoranderna Maag och Fuhrer kl. Swiss Chemical Societys möte i april 1972, presenterade Eschenmoser en föreläsning "Total Synthesis of Vitamin B 12 : the Photochemical Route" för första gången som Wilson Baker-föreläsning vid University of Bristol, Bristol/UK den 8 maj 1972.

Eftersom en gemensam fullständig publikation av synteserna av Harvard- och ETH-grupperna (tillkännagiven i och förväntad i) inte hade dykt upp 1977, publicerades en artikel som beskrev den slutliga versionen av den fotokemiska A/D-metoden som redan genomfördes 1972 i Science 1977. Den här artikeln är en utökad engelsk översättning av en som redan hade dykt upp 1974 i Naturwissenschaften, baserad på en föreläsning som hölls av Eschenmoser den 21 januari 1974 vid ett möte i Zürcher Naturforschende Gesellschaft. Fyra decennier senare, 2015, publicerade äntligen samma författare en serie av sex fullständiga artiklar som beskrev ETH-gruppens arbete med corrinsyntes . Del I av serien innehåller ett kapitel med titeln "The Final Phase of the Harvard/ETH Collaboration on the Synthesis of Vitamin B 12 ", i vilket ETH-gruppens bidrag till det samarbetsarbete om syntesen av vitamin B 12 mellan 1965 och 1972 är inspelade.
Hela ETH -arbetet dokumenteras i full experimentell detalj i offentligt tillgänglig Ph.D. avhandlingar, nästan 1 900 sidor, alla på tyska. Bidrag från de 14 postdoktorala ETH-forskarna som är involverade i kobyrinsyrasynteserna är till största delen integrerade i dessa avhandlingar. Det detaljerade experimentella arbetet vid Harvard dokumenterades i rapporter från de 77 inblandade postdoktorala forskarna, med en total volym på mer än 3 000 sidor.
Representativa recensioner av de två metoderna för den kemiska syntesen av vitamin B 12 har publicerats i detalj av AH Jackson och KM Smith, T. Goto, RV Stevens, KC Nicolaou & EG Sorensen, sammanfattade av J. Mulzer & D. Riether, och GW Craig, förutom många andra publikationer där dessa epokala synteser diskuteras.
Harvard/ETH-metoden för syntesen av kobyrinsyra: vägen till den gemensamma korrinoidmellanprodukten via A/B-korrin-ringförslutning
I A/B-metoden för kobyrinsyra kopplades Harvard AD-komponenten till ETH BC-komponenten mellan ringarna D och C, och stängdes sedan till en korrin mellan ringarna A och B. Båda dessa kritiska steg utfördes av C, C-koppling via sulfidkontraktion , en ny reaktionstyp utvecklad i syntesen av BC-komponenten vid ETH. AD-komponenten syntetiserades vid Harvard från en ring-A-prekursor (framställd från akirala utgångsmaterial), och en ring-D-prekursor framställd från (−)-kamfer . En modell AD-komponent användes för att utforska kopplingsförhållandena; denna komponent skilde sig från AD-komponenten som användes i den slutliga syntesen genom att som funktionell grupp vid ring-D f-sidokedjan hade en metylestergrupp ( som alla andra sidokedjor) istället för en nitrilgrupp .
| Harvard-syntesen av AD-komponenterna för A/B-metoden |
|---|
|
Syntes av ring-A-prekursorn Utgångspunkten för syntesen av ring-A-prekursorn var metoxidimetyl-indol H-1 syntetiserad genom kondensation av Schiff-basen från m-anisidin och acetoin . Reaktion med Grignard-reagenset av propargyljodid gav racemisk propargylindolenin rac - H-2 ; ringslutning till aminoketonen rac - H-3 åstadkoms av BF3 cis och HgO i MeOH genom intermediär rac - H-2a ( elektrofil addition) med de två metylgrupperna tvingade till ett - förhållande av kinetiska såväl som termodynamiska skäl. Upplösning av den racemiska aminoketonen i de två enantiomererna . Reaktion av rac - H-3 med (−)-etylisocyanat möjliggjorde isolering genom kristallisation av ett av de två bildade diastereomera ureaderivaten (det andra kristalliserar inte). Behandling av racemisk keton rac - H-3 (eller av moderlutar från föregående kristallisation) med (+)-etylisocyanat gav enantiomeren av det första ureaderivatet . Pyrolytisk sönderdelning av vart och ett av dessa ureaderivat ledde till enantiorena aminoketoner, de önskade (+)-H-3 och (-)-H-3 . Den "onaturliga" (−)-enantiomeren (−)-H-3 användes för att bestämma den absoluta konfigurationen ; i olika senare steg användes (−)-H-3 och enantio-intermediärer härledda från det som modellföreningar i explorativa experiment. Woodward skrev om den onaturliga enantiomeren "vår erfarenhet har varit sådan att detta är nästan den enda typ av modellstudie som vi betraktar som helt tillförlitlig". Bestämning av den absoluta konfigurationen av ring-A-prekursor (+)-H-3. För denna bestämning användes den levo-roterande ("onaturliga") enantiomeren av aminoketon (−)-H-3 för att spara värdefullt material: Acylering av aminogruppen i ( −)-H-3 med kloracetylklorid , följde genom behandling av produkten H-3a med kalium -t -butoxid i t -butanol , gav tetracyklisk keto-laktam H-3b . Dess ketokarbonyl omvandlades till en metylengrupp genom avsvavling av ditioketalen av H-3b med Raney-nickel för att ge laktam H-3c . Förstörelse av den aromatiska ringen genom ozonolys , innefattande förlust av en karboxylfunktion genom spontan dekarboxylering , ledde till bicyklisk laktam-karboxylsyra H-3d . Detta material identifierades med en produkt H-3h härledd från (+)-kamfer , med samma konstitution och den absoluta konfigurationen som visas i formel H-3d . Materialet för denna identifiering av H-3d syntetiserades från (+)-kamfer enligt följande: cis -isoketopinsyra H-3e , erhållen från (+)-kamfer genom en etablerad väg beskriven i litteraturen, omvandlades via motsvarande klorid azid och isocyanat till metyluretan H - 3f . När den behandlades med kalium- t -butoxid i t -butanol och därefter med KOH, omvandlades H-3f till H-3h , tydligt med hjälp av mellanprodukten H-3g . Identiteten för de två proverna av H-3d och H-3h erhållna genom de två beskrivna vägarna etablerade den absoluta konfigurationen av (+)-H-3 , enantiomeren av ring-A-prekursorn. Syntes av ring-D-prekursorn från (-)-kamfer (−)-Camphor nitroserades i a-positionen av karbonylgruppen för att ge oxim H-4 , Beckmann-klyvning gav via motsvarande nitril amiden H-5 . Hofmann-nedbrytning via en intermediär amin och dess ringslutning ledde till laktam H-6 . Omvandling av dess N - nitroso -derivat H-7 gav diazoförening H-8 . Termisk sönderdelning av H-8- inducerad metylmigrering för att ge cyklopenten H-9 . Reduktion till H-10 ( LiAlH4 ) , , oxidation ( kromsyra ) till aldehyd H-11 Wittig-reaktion ( karbometoximetylentrifenylfosforan ) till H-12 och hydrolys av estergruppen gav slutligen trans -karboxylsyra H-13 . Koppling av ring-A- och ring-D-prekursorer till "pentacyklenon" N -acylering av tricyklisk aminoketon (+)-H-3 med kloriden H-14 av karboxylsyra H-13 gav amid H-15 , som vid behandling med kalium- t -butoxid i t -butanol stereoselektivt producerade pentacyklisk keto-laktam H -16 via en intramolekylär Michael-reaktion som riktar de angivna väteatomerna i transrelation till varandra. I väntan på Björk-reduktionen av den aromatiska ringen krävdes skyddsgrupper för de två karbonylfunktionerna i H-16 , en för ketonkarbonylgruppen som ketal H-17 och den andra för laktamkarbonyl som den mycket känsliga enoletern H-20 . Det senare skyddet uppnåddes genom behandling av H-17 med Meerwein-salt (trietyloxoniumtetrafluoroborat) för att ge iminiumsalt H-18 , följt av omvandling till ortoamid H-19 ( NaOMe /MeOH), och slutligen utdrivning av en molekyl metanol genom upphettning i toluen. Björkreduktion av H-20 ( litium i flytande ammoniak , t -butanol, THF ) gav tetraen H-21 . Behandling med syra under noggrant kontrollerade förhållanden ledde först till en mellanliggande dion med dubbelbindningen i β,y-position som flyttade till den konjugerade positionen i dion H-22 , kallad pentacyklenon . Från "pentacyklenon" till "corrnorsteron" Etenketalskyddsgruppen i pentacyklenon H-22 omvandlades till ketongruppen i H-23 genom syrakatalyserad hydrolys . Dioximen som primärt bildades genom reaktion av diketon H-23 med hydroxylammoniumklorid hydrolyserades regioselektivt ( salpetersyrlighet /ättiksyra ) till den önskade monooximen H-24 . Detta är oximen av den steriskt mer hindrade ketongruppen, vars kväveatom är avsedd att bli kväve i målmolekylens ring D. Avgörande för detta ändamål är konfigurationen vid monoximdubbelbindningen, varvid hydroxylgruppen upptar de steriskt mindre hindrad position. C,C-dubbelbindningarna av både cyklopenten- och cyklohexenonringen i H-24 klyvdes sedan genom ozonolys (ozon vid 80 °C i MeOH, perjodsyra ), och den bildade karboxylgruppen förestrades med CH 2 N 2 ) till diketon H-25 . En intramolekylär aldolkondensation av 1,5-dikarbonylenheten i MeOH med användning av pyrrolidinacetat som bas, följt av tosylering av oximens hydroxylgrupp, gav cyklohexenonderivatet H-26 . En andra ozonolys i vått metylacetat följt av behandling med perjodsyra och CH2N2 gav H - 27 . Beckmann-omlagring (MeOH, natriumpolystyrensulfonat, 2 timmar, 170 °C) producerade regioselektivt laktam H-27a (ej isolerad) som reagerade vidare i en amin-karbonylkondensation → aldolkondensationskaskad till tetracykeln H-28 , kallad α-kornorsteron , vilket implicerar det som en "hörnsten" i syntesen av den önskade AD-komponenten. Denna förening krävde starkt alkaliska betingelser för att öppna sin laktamring , men det upptäcktes att en mindre isomer , också isolerad från reaktionsblandningen, β-korrnorsteron H-29 , genomgår denna laktamringöppning under alkaliskt tillstånd med stor lätthet. Strukturellt skiljer sig de två isomererna endast i orienteringen av propionsyrasidokedjan vid ring A: β-isomeren har den mer stabila trans-orienteringen av denna kedja i förhållande till den närliggande ättiksyrakedjan som bildas efter öppnandet av laktamringen. Utjämning av α-korrnorsteron H-28 genom uppvärmning i stark bas, följt av surgöring och behandling med diazometan , ledde till isolering av rent β-korrnorsteron H-29 med 90 % utbyte. Den korrekta absoluta konfigurationen av de sex angränsande asymmetriska centran i β-korrnorsteron bekräftades genom en röntgenkristallstrukturanalys av brom-β-korrnorsteron med den "onaturliga" konfigurationen. Syntes av AD-komponenten som bär propionsyrafunktionen vid ring D som metoxikarbonylgrupp (modell AD-komponent) Behandling av β-korrnorsteron H-29 med metanolisk HCl klöv laktamringen och producerade ett enoleterderivat benämnt hesperimine H-30u . Ozonolys till aldehyd H-32u , reduktion av aldehydgruppen med NaBH4 slutligen i MeOH till den primära alkoholen H-33u och omvandling av hydroxigruppen via motsvarande mesylat gav bromid H-34u . Detta utgör modell AD-komponenten, den med en odifferentierad propionsyrafunktion vid ring D (dvs bärande en metylestergrupp som alla andra sidokedjor). Syntes av AD-komponenten som bär propionsyrafunktionen vid ring D som nitrilgrupp Omvandling av β-korrnorsteron H-29 till den korrekta AD-komponenten H-34 innehållande karboxylfunktionen i ring D-propionsyrasidokedjan som en nitrilgrupp , differentierad från alla andra metoxikarbonylgrupper, involverade följande steg: behandling av H -29 med en metanolisk lösning av tiofenol och HCl gav fenyl-tioenoleterderivat H-30 , som vid ozonolys vid låg temperatur gav motsvarande tioester - aldehyd H-31 och, när den följdes av behandling med flytande ammoniak, amiden H-32 . Reduktion av aldehydgruppen med NaBH 4 till H-33 , mesylering av den primära hydroxigruppen med metansulfonsyraanhydrid under förhållanden som även omvandlar den primära amidgruppen till den önskade nitrilgruppen och slutligen ersättning av metansulfonyloxigruppen med bromid producerad AD- komponent H-34 med propionsyrafunktionen vid ring D som nitril, differentierad från alla andra sådana sidokedjor. |
| Koppling av Harvard AD-komponenter med ETH BC-komponenten |
|---|
|
Konstruktionen av corrin- kromoforen med dess tre vinylogena amidinenheter utgör – förutom den direkta enkelbindningsförbindelsen mellan ringarna A och D – den centrala utmaningen för alla försök att syntetisera vitamin B 12 . Det allra första tillvägagångssättet för en total syntes av vitamin B 12 som lanserades av Cornforth avbröts när man konfronterades med uppgiften att koppla syntetiserade ringprekursorer. Att koppla Harvard AD-komponenterna med ETH BC-komponenten krävde omfattande utforskande arbete, detta trots den kunskap som erhållits i ETH-modellsynteserna av mindre komplexa (dvs mindre perifert substituerade) corriner. Det som kan kallas ett episkt engagemang för att formellt skapa bara två C,C-obligationer varade från början av 1967 till juni 1970. Både vid ETH och Harvard har omfattande modellstudier av kopplingen av förenklade enaminoidanaloger av AD-komponenten med (ring C) imino- och tio-iminoesterderivat av den fullfjädrade BC-komponenten genomgående visat att en koppling av Harvard och ETH-komponenterna kunde knappast uppnås med metoden som hade varit så framgångsrik i syntesen av de enklare corrinerna, nämligen genom en intermolekylär enamino-imino(eller tio-imino)esterkondensation. Resultatet av dessa modellstudier avgjorde den slutliga strukturtyp av en Harvard AD-komponent: en struktur som kan fungera som en komponent i en C/D-koppling genom sulfidkontraktion via alkylativ koppling , dvs bromiden H-34u . Denna metod hade redan implementerats av ETH-gruppen i syntesen av BC-komponenten . En omfattande sökning efter optimala förhållanden, först efter en C/D-koppling av en AD-komponent med ETH BC-komponenten E-19 , sedan efter tillstånden för den efterföljande intramolekylära A/B-korrinringförslutningen genomfördes i båda laboratorierna , med användning av den f-odifferentierade modellen AD-komponent H-34u som modell. Som ett resultat av arbete av Yoshito Kishi vid Harvard och Peter Schneider vid ETH, fann man så småningom optimala förhållanden för C/D-kopplingen vid Harvard, medan den första och mest pålitliga metoden för korrin-ringförslutning mellan ringarna A och B utvecklades vid ETH. Procedurerna för C/D-koppling och A/B-korrin-ringförslutning som utvecklats i denna modellserie tillämpades senare på motsvarande steg i den f-differentierade serien som delar av kobyrinsyrasyntesen. Syntes av dicyano-kobolt(III)-5,15-bisnor-a,b,c,d,e,f,g-heptametyl-kobyrinat från den ring-D odifferentierade modellen AD-komponenten D/C-koppling. Nyckelproblemet i detta steg var labiliteten hos den primära kopplingsprodukten, tioeter HE-35u , som isomeriserade till andra tioetrar till en början inte mottaglig för sulfidkontraktion i ett reproducerbart förfarande med acceptabla utbyten. Inducerad av kalium t -butoxid i THF/ t -butanol under noggrant kontrollerade förhållanden med strikt uteslutning av luft och fukt, reagerade modellen AD-komponent H-34u smidigt med BC-komponenten E-19 för att ge den svavelbryggade kopplingsprodukten HE-35u , benämnd "tioeter typ I", i väsentligen kvantitativt utbyte. Denna produkt kunde dock endast isoleras under mycket noggrant kontrollerade förhållanden, eftersom den jämvikts med extrem lätthet (t.ex. kromatografi eller spår av trifluorättiksyra i metylenkloridlösning) till den mer stabila isomera tioetern HE-36u (tioeter typ II) som innehåller i motsats till tioeter typ I, π-systemet av en konjugativt stabiliserad vinylogen amidin. Beroende på förhållandena observerades ytterligare en isomer HE-37u (den andra typ III). Med utgångspunkt i sådana blandningar av kopplingsprodukter, BF3 vid ETH visade sig en mängd olika betingelser (t.ex. metyl-kvicksilverkomplex, , trifenylfosfin ) inducera (via HE-38u ) kontraktionssteget till HE-39u i måttliga utbyten. Med valet av lösningsmedel som befunnits vara avgörande var det optimala förfarandet vid Harvard att värma tioter typ II HE-36u i sulfolan i närvaro av 5,3 ekvivalenter trifluorättiksyra och 4,5 ekvivalenter tris-(β-cyanoetyl)-fosfin vid 60 ° C i 20 timmar, vilket ger HE-39u med upp till 85 % utbyte. Senare upptäcktes att nitrometan också kunde användas som lösningsmedel. A/B-ring stängning. Problemet med korrin-ringförslutning mellan ringarna A och B löstes på två olika sätt, det ena utvecklat vid ETH och det andra vid Harvard. Båda metoderna motsvarar förfaranden som utvecklats tidigare vid syntes av metallkomplex såväl som fria ligander av enklare corriner. I utforskningar av ringslutningsprocedurer för den mycket mer substituerade A/B-seko-korrinoid-intermediären HE-39u fokuserade ETH-gruppen på den intramolekylära versionen av den oxidativa sulfidkontraktionsmetoden, vilket så småningom ledde till dicyano-kobolt(III) )-komplex HE48u . Denna första helt syntetiska korrinoidmellanprodukt identifierades med ett motsvarande prov som härrörde från vitamin B 12 . Vid Harvard visades det att förslutningen till corrin-makrocykeln också kunde realiseras med metoden tioiminoester/enaminkondensation. Alla reaktioner som beskrivs här måste utföras i mycket liten skala, med "... yttersta rigor i uteslutningen av syre från reaktionsblandningarna", och de flesta av dem också under strikt uteslutning av fukt och ljus, vilket kräver mycket höga standarder av experimentell expertis. Det största hindret för att uppnå en A/B-korrin-ringförslutning var exponeringen av den mycket instabila ring B exocykliska metylidendubbelbindningen, som tenderar att isomerisera till en mer stabil, oreaktiv endocyklisk position med stor lätthet. Problemet löstes vid ETH genom att konstatera att behandling av tiolakton-tiolaktam-intermediären HE-40u (erhållen från HE-39u genom att reagera med P 2 S 5 ) med dimetylamin i torr MeOH (rumstemperatur, uteslutning av luft och ljus) öppnar sig smidigt tiolaktonringen vid ring B, som genom eliminering av H2S bildar den exocykliska metylidendubbelbindningen såväl som en dimetylaminoamidgrupp i ättiksyrasidokedjan. Dessa betingelser är milda nog för att förhindra dubbelbindningstautomerisering till den termodynamiskt mer stabila isomera positionen i ringen. I2 ) -komplex i metanol till zinkkomplex HE-41u följt av oxidativ koppling (0,05 mM lösning av / KI i MeOH, 3 h) gav HE-42u . Sulfidsammandragning (trifenylfosfin, trifluorättiksyra, 85 °C, uteslutning av luft och ljus) följt av återkomplexbildning med Zn(ClO4) 2 ( KCl , MeOH, diisopropylamin ) ledde till klor-zinkkomplexet HE-43u . CoCl2 Det fria korriniumsaltet som bildades när HE-43u behandlades med trifluorättiksyra i acetonitril komplexbildades på nytt med vattenfri i THF till dicyano-kobolt(III)-komplexet HE-44u . Omvandling av dimetylaminoamidgruppen i ättiksyrasidokedjan i ring B till motsvarande metylestergrupp ( O -metylering med trimetyloxoniumtetrafluorborat , följt av sönderdelning av iminiumsaltet med vattenhaltig NaHCO 3 ) gav helt syntetisk 5,15-bisnor- heptametylkobyrinat HE-48u . Ett kristallint prov av HE-48u identifierades via UV/VIS- , IR- och ORD -spektra med ett motsvarande kristallint prov härlett från vitamin B 12 Senare på Harvard uppnåddes även A/B-corrin-ringförslutningen genom att omvandla tiolakton-tiolaktam-intermediären HE-40u till tiolakton-tioiminoester HE-45u genom S -metylering av tiolaktamsvavel (MeHgOi-Pr, sedan trimetyloxoniumtetrafluoroborat) . Produkten HE-45u utsattes för behandling med dimetylamin (som i ETH-varianten), vilket bildade det mycket labila metylidenderivatet HE-46u , som sedan omvandlades med vattenfri CoCl2 i THF till dicyano-kobolt(III)-komplex HE-47u , substratet redo att genomgå (A⇒B)-ringförslutningen genom en tioiminoester/enaminkondensation. En noggrann sökning vid Harvard efter reaktionsförhållanden ledde till en procedur (KO- t -Bu, 120 °C, två veckor) som gav corrin Co-komplex HE-44u , identisk med och i totala utbyten jämförbara med HE-44u erhållen av ETH variant av sulfidkontraktionsproceduren. Eftersom en sådan C,C-kondensation i corrinmodellsynteser krävde induktion av en stark bas, var dess applicering i ett substrat innehållande sju metylestergrupper inte problemfritt; i en, mildare reaktionsförhållanden tillämpades. Syntes av dicyano-kobolt(III)-5,15-bisnor-a,b,d,e,g-pentametyl-kobyrinat-c- N,N -dimetylamid-f-nitril (den vanliga korrinoidmellanprodukten) från ringen- D-differentierad AD-komponent AD-komponenten H-34 med sin propionsyrafunktion vid ring D differentierad från alla andra karboxylfunktioner som nitrilgrupp hade blivit tillgänglig på Harvard våren 1971. Som ett resultat av det omfattande undersökningsarbete som hade gjorts med modellen AD -komponent vid Harvard och ETH, förenar den riktiga AD-komponenten H-34 med BC-komponenten E-19 genom tre operationer H-34 + E-19 →→ HE-36 → HE-39 . Stängning av corrinringen uppnåddes i sekvensen HE-39 (P 2 S 5 , xylen , γ-pikolin ) → HE-40 → HE-41 → HE-42 → HE-43 (totalt utbyte "ca 60 %"), och slutligen till koboltkomplexet HE-44 . Reaktioner i denna sekvens baserades på de procedurer som utvecklats i den odifferentierade modellserien . Två metoder var tillgängliga för A/B-ringförslutningen: oxidativ sulfidkontraktion inom ett zinkkomplex, följt av utbyte av zink med kobolt (ETH), eller Harvard-alkylativa varianten av en sulfidkontraktion, tioiminoester / enaminkondensation av koboltkomplex (förbättrade reaktionsbetingelser: diazabicyklononanon i DMF, 60 °C, flera timmar). Woodward föredrog den förra: "...den oxidativa metoden är något överlägsen, eftersom den är relativt lättare att reproducera, .... ". Korrinkomplexet dicyano-kobolt(III)-5,15-bisnor-pentametyl-kobyrinat-c- N,N -dimetylamid-f-nitril HE-44 tog upp rollen som den vanliga korrinoidintermediären i de två metoderna för kobyrinsyra syntes: HE-44 ≡ E-37 . På grund av den höga konfigurationslabiliteten hos CH- kirogena centra C-3, C-8 och C-13 vid ligandperiferin i basisk eller sur miljö, var separation med HPLC oumbärlig för isolering, rening och karakterisering av rena diastereomerer av denna och följande korrinoida mellanprodukter. |
| Framställning av ring-C-prekursor från (+)-kamfer av Harvard-gruppen |
|---|
|
Utgångsmaterial för syntesen av en ring-C-prekursor var (+)- kamferkinon H-35 som omvandlades till acetoxi-trimetylcyklohexen-karboxylsyran H-36 av BF 3 i ättiksyraanhydrid , en reaktion som Manasse & Samuel startade 1902. ,, redan framgångsrikt tillämpat i en tidigare syntes av ring-C-prekursorn av Pelter och Cornforth. Omvandling av H-36 till amid H-37 följdes av dess ozonolys till peroxid H-38 som reducerades till keto- succinimiden H-46 med zink och MeOH. Behandling med metanolisk HCl gav laktam H-40 , följt av termisk eliminering av metanol till ring-C-prekursorn H-41. Detta visade sig vara identiskt med ring-C-prekursorn E-13 framställd genom en annan väg vid ETH. |
ETH-metoden för syntesen av kobyrinsyra: vägen till den vanliga korrinoidmellanprodukten via A/D-korrin-ringförslutning
I A/D-metoden för syntesen av kobyrinsyra härrör de fyra ringprekursorerna (ring-C-prekursor endast formellt så) från de två enantiomererna av ett gemensamt kiralt utgångsmaterial . Alla tre vinylloga amidinbryggor som förbinder de fyra perifera ringarna konstruerades med sulfidkontraktionsmetoden, där BC-komponenten – redan förberedd för A/B-metoden – fungerade som en mellanprodukt. Den fotokemiska A/D-sekokorrin→korrincykloisomeriseringen, genom vilken korrinringen stängdes mellan ringarna A och D, är en ny process, målinriktad och befunnits existera i en modellstudie (jfr fig. 2 ) .
| Syntes av ETH BC-komponenten (en del av A/B- såväl som A/D-metoden) |
|---|
|
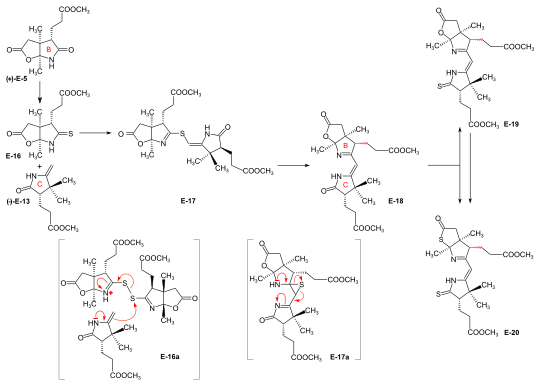
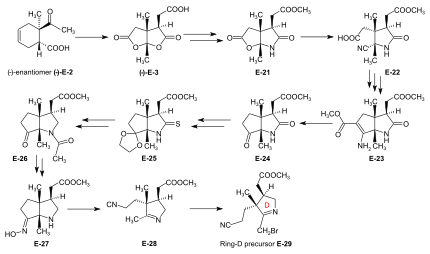
Synteser av ring-B-prekursorn Två synteser av ring-B-prekursor (+)-E-5 realiserades; den som utgick från 2-butanon användes vidare. Två vägar för omvandlingen av ring-B-prekursorn till ring-C-prekursorn (+)-E-5 → (−)-E-13 ≡ H-41 utvecklades, en vid ETH , och en vid Harvard. Dessa omvandlingar visade sig vara otillräckliga för att producera stora mängder ring-C-prekursor. Den väg som utvecklades vid ETH tjänade emellertid syftet att bestämma den absoluta konfigurationen av ring-B-prekursorn. Bulkmängder av ring-C-prekursor som ska användas för produktion av BC-komponenten vid ETH framställdes vid Harvard från (+)-kamfer genom en väg som ursprungligen utvecklades av Pelter och Cornforth . Ring-B-prekursor från 2-butanon och glyoxylsyra. Aldolkondensation mellan 2-butanon och glyoxylsyra genom behandling med koncentrerad fosforsyra ) gav stereoselektivt ( trans )-3-metyl-4-oxo-2-pentensyra E-1 . Diels-Alder- reaktion av E-1 med butadien i bensen i närvaro av SnCl 4 gav racematet av den kirala Diels-Alder-addukten E-2 som löstes upp i enantiomererna genom sekventiell saltbildning med både (−)- och (+) ) -1-fenyletylamin . De chirogena centran av (+)- enantiomeren (+)-E-2 hade den absoluta konfigurationen av ring B i vitamin B12 . Oxidation av denna (+)-enantiomer med kromsyra i aceton i närvaro av svavelsyra gav dilaktonen (+)-E-3 av den intermediära trikarboxylsyran E-3a . Termodynamisk kontroll av dilaktonbildning leder till cis -konfigurationen av ringövergången. Förlängning av ättiksyrasidokedjan av (+)-E-3 genom Arndt-Eistert-reaktionen (via motsvarande syraklorid och diazoketon) gav dilakton (+)-E-4 . Behandling av (+)-E-4 med NH3 , i MeOH vid rumstemperatur bildade en dubbelblandning av isomera laktam - laktoner i ett förhållande av 2:1 med ring-B-prekursor (+)-E-5 dominerande (isolerad i 55 % utbyte). Den isomera laktam-laktonen kunde isomeriseras till (+)-E-5 genom behandling i metanolisk HCl. Alternativ syntes av racemisk ring-B-prekursor från Hagemanns ester: implementering av amidacetal-Claisen-omlagringen. Fem steg behövdes för att omvandla Hagemanns ester -rac - E-6 till racematet av laktam-lakton- rac - E-5- formen av ring-B-prekursorn. Produkten från C-metyleringssteget CH3I rac - E - 6 → rac - E-7 ( NaH , ) renades via dess kristallina oxim . Cis NaBH4 säkerställd genom laktonbildning) resulterande från reduktionssteget rac - E-7 -> rac - E-8 ( ) måste separeras från trans - isomeren. Den termiska omarrangeringen rac - E-8 → rac - E-9 utgör implementeringen av amidacetal-Claisen-omlagringen i organisk syntes, ett prejudikat till Johnsons ortoester-Claisen och Irlands ester-enolat-omläggning . Ozonolys ( O 3 /MeOH, HCOOH / H 2 O 2 ) av N,N -dimetylamidester rac - E-9 gav dilaktonsyra rac - E-10 , från vilken två reaktioner ledde till laktam-lakton metylester rac - E- 7 , racematet av ring-B-prekursor (+)-E-7 . Bestämning av absolut konfiguration av (+)-ring-B-prekursorn via dess omvandling till (+)-ring-C-prekursorn Omvandlingen av ring-B-prekursorn till ring-C-prekursorn baserades på en reduktiv dekarbonylering av tiolakton E-12 med klor-tris-(trifenylfosfino)-rodium(I). Behandling av en metanollösning av ring-B-prekursor (+)-E-5 med diazometan i närvaro av katalytiska mängder natriummetoxid , följt av termisk eliminering av metanol, gav metylidenlaktam E-11 , som omvandlades till tiolaktonen E -12 med flytande . H2S innehållande en katalytisk mängd trifluorättiksyra Upphettning av E-12 i toluen med Rh(I)-komplexet gav ring-C-prekursor (−)-E-13 förutom motsvarande cyklopropanderivat E-14 . Ring-C-prekursorer framställda via denna väg och från (+)-kamfer vid Harvard visade sig vara identiska: (−)-E-13 ≡ H-41 . Ozonolys av ring-C-prekursor (−)-E - 13 gav succinimidderivat (−)-E-15 . Denna succinimid visade sig vara identisk i konstitution och optisk rotation (dvs. konfiguration) med motsvarande succinimid härledd från ring C av vitamin B12, isolerad efter ozonolys av kristallint heptametyl-kobyrinat (cobester) framställt från vitamin B12 . Tillvägagångssättet vid Harvard för omvandling av ring-B-prekursor till ring-C-prekursor baserades på en fotokemisk nedbrytning av ättiksyrasidokedjans karboxylgrupp, utgående från (+)-E-7 framställd vid ETH. Koppling av ring-B och ring-C prekursorer till BC-komponenten. Implementering av sulfidkontraktion C,C-kondensationsmetoden Iminoester /enamin C,C- kondensationsmetoden för att konstruera det vinylogena amidinsystemet , utvecklad i modellstudierna på korrinsyntes , misslyckades fullständigt i försöken att skapa den riktade C,C-bindningen mellan ring-B prekursor ( +)-E- 5 med ring-C-prekursor (−)-E-13 för att ge BC-komponenten E-18 . Problemet löstes genom "intramolekylarisering" av bindningsbildningsprocessen mellan det elektrofila (tio)iminoesterkolet och det nukleofila metylidenkolet i enaminsystemet genom att först oxidativt förbinda dessa två centra med en svavelbrygga och sedan uppnå C,C- bindningsbildning genom en nu intramolekylär tio- iminoester/enaminkondensation med åtföljande överföring av svavlet till en tiofil. Omvandling av laktam (+)-E-5 till motsvarande tiolaktam E-16 (P 2 S 5 ), oxidation av E-16 med bensoylperoxid i närvaro av ring-C-prekursor (−)-E-13 ( framställd kl. Harvard via Cornforth-vägen), följt av upphettning av reaktionsprodukten E-17 i trietylfosfit (som både lösningsmedel och tiofil) gav BC-komponent E-18 som en (ej separerad) blandning av två epimerer (avseende konfigurationen av propionsidan kedja vid ring B) i upp till 80 % utbyte. Formlerna inom parentes i reaktionsschemat illustrerar typen av mekanism som fungerar i processen: E-16a = primär koppling av E-12 och E-10 till E-13 ; E-17a = extrudering av svavelatomen (fångad av tiofil) till E-14 , där det lämnas öppet om denna senare process sker i episulfidens stadium. Detta reaktionskoncept som utvecklades i detta skede, kallat sulfidkontraktion , visade sig möjliggöra konstruktionen av alla tre meso-kolbryggor av vitaminets corrinligand i båda syntesmetoderna. Omvandlingen av bicyklisk lakton-laktam E-18 till motsvarande tiolakton-tiolaktam E-20 åstadkoms genom upphettning med P2S5 / C ; 4 -metylpyridin i xylen vid 130° mildare tillstånd producerade tiolaktam-lakton E-19 , som används för koppling med Harvard AD-komponenterna . |
| Koppling av BC-komponenten med ring-D och ring-A prekursorer |
|---|
|
Syntes av ring-D-prekursor för A/D-metoden Utgångsmaterialet för ring-D-prekursorn, (−)- enantiomeren av dilakton-karboxylsyran (−)-E-3 , framställdes från (−)-enantiomeren av Diels -Alder- addukten (−)-E -2 genom oxidation med kromsyra /svavelsyra i aceton. Behandling av (−)-E-3 med NH3 i MeOH gav en lakton-laktamsyra som förestrades med diazometan till estern E-21 , vars laktonring öppnades med KCN i MeOH för att ge E-22 . Konventionella förhållanden för en Arndt-Eistert-reaktion ( SOCl 2 : syraklorid, sedan CH 2 N 2 i THF: diazoketon, behandlad med Ag 2 O i MeOH) ledde till en – oförutsedd, men ändå användbar – ringslutning av den ursprungligen bildade kedjan- långsträckt ester genom deltagande av cyanogruppen som en närliggande elektrofil , vilket ger det bicykliska enaminoesterderivatet E-23 . Hydrolys med vattenhaltig HCl, åtföljd av dekarboxylering, och återförestring med diazometan gav keto-laktam-ester E-24 . Ketalisering ( (CH2OH ) 2 , CH (OCH3 ) 3 , TsOH ) av E-24 och av omvandling av denna laktamester till tiolaktam E-25 (P2S5 ) reduktivt följdes av avlägsnande svavlet med Raney nickel , acetylering av aminogruppen och hydrolys av ketalen (AcOH) för att ge E-26 . Detta omvandlades genom deacetylering av aminogruppen med HCl och sedan genom behandling med . NH2OH /HCl , MeOH/ NaOAc till oxim E-27 Beckmann-fragmentering (HCl, SOCl2 i CHCl3 , N-polystyryl-piperidin) av denna oxim E-27 producerade imino-nitril E-28 , som, när den behandlades med brom (i MeOH, fosfatbuffert pH 7,5, -10 °C gav ring-D-prekursor E-29 . Omvandling av ring-B-prekursorn till ring-A-prekursorn för A/D-metoden Ring-A-prekursorn (−)-E-31 som krävs i A/D-metoden är en nära derivata av ring-B-prekursorn ( +)-E-5 . Dess framställning från (+)-E-5 krävde öppning av laktongruppen ( KCN i MeOH), följt av återförestring med diazometan till E-30 , sedan omvandling av laktamgruppen till en tiolaktamgrupp med P2S5 till utbyte (-)-E-31 . Koppling av BC-komponenten med ring-D och ring-A prekursorer fästa de två ringarna D och A till BC-komponenten E-18 var att omvandla E-18 direkt till dess tiolaktamtiolaktonderivat E -20 och sedan fortsätta genom att först koppla ring-D prekursor E-29 till ring C, och sedan ring-A-prekursor E-31 till ring B, båda genom sulfidkontraktionsmetoden. Sökandet efter reaktionsbetingelserna för dessa fästen underlättades avsevärt av undersökande arbete som gjorts på de två sulfidkontraktionsstegen i A/B-modellstudien . Bindning av ring-D-prekursor E-29 till ring-C tiolaktamet i E-20 genom sulfidkontraktion via alkylativ koppling ( t -BuOK i t -BuOH/THF, tris-(β-cyano-etyl)-fosfin/ CF 3 COOH i sulfolan ) gav B/C/D-sesqui-korrinoiden E-32 . För att fästa ring-A-prekursor E-31 , inducerades ringen B av E-32 att exponera sin exocykliska metylidendubbelbindning genom behandling med dimetylamin i MeOH (med användning av metoden utvecklad av Schneider) och bildade E -33 som utsattes för följande operationskaskad: jodering ( N -jodsuccinimid , CH 2 Cl 2 , 0°), koppling med tiolaktamsvavel från ring-A-prekursorn E-31 [(CH 3 ) 3 Si] 2 N-Na i bensen/ t - BuOH), komplexbildning (Cd(ClO 4 ) 2 i MeOH), behandling med trifenylfosfin /CF 3 COOH i kokande bensen (sulfidkontraktion) och slutligen återkomplexbildning med Cd(ClO 4 ) 2 / N,N -diisopropyletylamin i bensen/MeOH). Dessa sex operationer, alla utförda utan isolering av intermediärer , gav A/D-seco-corrin-komplex E-34 som en blandning av perifera epimerer (separerbara via HPLC ) i 42-46 % totalt utbyte. |
| A/D-korrin-ringförslutning genom fotokemisk A/D-seco-corrin→korrincykloisomerisering |
|---|
|
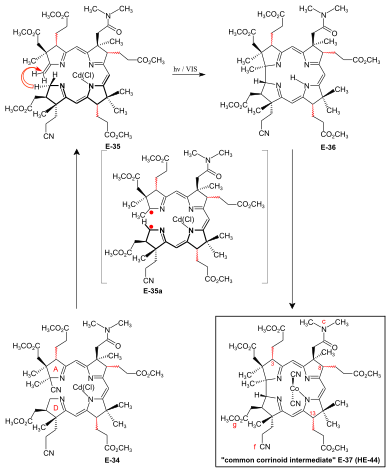
A/D-korrin-ringförslutning genom den fotokemiska A/D-seco-corrin→korrincykloisomeriseringen till dicyano-kobolt(III)-5,15-bisnor-a,b,d,e,g-pentametyl-kobyrinat-c - N,N -dimetylamid-f-nitril (den vanliga korrinoidmellanprodukten) Villkoren och förutsättningarna för den slutliga (A⇒D) -corrin -ringförslutningen togs över från omfattande corrinmodellstudier. Problem specifika för kobyrinsyrasyntesen som måste åtgärdas var: möjlig bildning av två diastereomera A/D- trans -övergångar i ringslutningen, exponering av metylidendubbelbindningen vid ring A av A/D-seko-corrin E-34 i ett labilt Cd-komplex och epimeriserbarhet av de perifera stereogena centra C-3, C-8 och C-13 före och efter ringslutning. Vid tillämpningen av denna nya process i A/D-metoden för kobyrinsyrasyntesen fortskred reaktionen mest effektivt och med högsta spiralstereoselektivitet till förmån för den naturliga A/D- trans -övergången i en A/D-seco-corrin kadmium komplex. Behandling av Cd-komplex E-34 som blandning av perifera epimerer med 1,8-Diazabicyklo(5.4.0)undec-7-en i sulfolan vid 60 °C under strikt skydd mot ljus för att eliminera cyanogruppen vid ring A, direkt följt av återbehandling med Cd(ClO4 ) 2 , ledde till labilt A/D-seco-corrin-komplex E-35 som en blandning av perifera epimerer. Detta utsattes direkt för nyckelsteget, den fotokemiska ringslutningsreaktionen under rigorös uteslutning av luft: synligt ljus, under Argon , MeOH, AcOH, 60°C. Produkten av A/D-ringförslutningen var den fria corrinliganden E- 36 , eftersom det ursprungligen bildade Cd-korrinatet – i motsats till Cd- seco -korrinatet E-35 – dekomplexerar i reaktionsmediet. Corrin E-36 komplexbildades omedelbart ( CoCl2 : , KCN , luft, H2O , CH2Cl2 ) och isolerades slutligen (tjockskiktskromatografi ) som en blandning av perifera epimerer i 45-50 % utbyte över fyra operationer den vanliga corrinoid intermediär dicyano-kobolt(III)-komplex E-37 ≡ HE-44 . HPLC- analys av denna blandning E-37 visade närvaron av sex epimerer med naturlig ligandhelicitet ( Σ 95%, CD-spektra ), bland dem 26% naturlig diastereomer 3α,8α,13α, och en lika stor mängd av dess C-13 neo -epimer 3a,8a,13p. Två HPLC-fraktioner (Σ 5%) innehöll diastereomerer med onaturlig ligandhelicitet, vilket visas av omvända CD-spektra. Produktblandningar från flera sådana cykloisomeriseringar kombinerades för preparativ HPLC-separation och fullständig karakterisering av de 14 isolerade diastereomererna av E-37 (av 16 teoretiskt möjliga, vad gäller helicitet och epimera centra C-3, C-8, C-13). separerades blandningen av kadmium-seco-complex epimerer E-35 med HPLC (i mörker) i den naturliga kloro-kadmium-3α,8α,13α-A/D-seco-corrinate diastereomeren (ααα) -E-35 och fyra andra epimerfraktioner Vid bestrålning och efter koboltering producerade (ααα)-E-35 E-37 i utbyte av 70-80 % som en väsentligen dubbel blandning av huvudsakligen 3α,8α,13α epimeren, förutom vissa 3a,8a,13p-epimer. Mindre än 1 % av fraktionerna med onaturlig spiral bildades (HPLC, UV/VIS, CD ). Mekanistiskt involverar den fotokemiska A/D-seco-corrin corrin cykloisomeriseringen en antarafacial sigmatropisk förskjutning av α-väte i CH 2 position C-19 vid ring D till CH 2 position av metylidengruppen vid ring A inom en triplett exciterad tillstånd , vilket skapar ett transient 15-center-16-elektron π-system (se E-35a i fig. 27 ) som antarafaciellt kollapsar mellan positionerna C-1 och C-19 till corrinsystemet. Ringslutningens spiralselektivitet till förmån för corrinligandens naturliga helicitet tolkas som relaterad till skillnaden i steriskt hinder mellan g-metoxikarbonylättiksyrakedjan vid ring D och metylidenregionen av ring A i de två möjliga spiralformade spiralkonfigurationerna av A/D-seco-corrin-komplexet (fig. 28). |
ETH/Harvard: de gemensamt utförda sista stegen från den vanliga korrinoidintermediären till kobyrinsyra
De sista stegen från den vanliga korrinoidintermediären E-37/HE-44 till kobyrinsyra E-44/HE-51 utfördes av de två grupperna i samarbete och parallellt, ETH -gruppen arbetade med material som producerats med A/D-metoden , och Harvard -gruppen med det från A/B-metoden . Vad de två grupperna faktiskt åstadkom var alltså de gemensamma slutstegen i två olika synteser.
Uppgifterna i denna slutfas av projektet var det regioselektiva införandet av metylgrupper vid de två mesopositionerna C-5 och C-15 i E-37/HE-44 , följt av omvandling av alla dess perifera karboxylfunktioner till primära amidgrupper , förutom det i sidokedjan f vid ring D, som måste sluta som fri karboxyl. Dessa konceptuellt enkla efterbehandlingssteg visade sig vara ganska komplexa i utförande, inklusive oförutsedda fallgropar som en dramatisk förlust av dyrbart syntetiskt material i den så kallade "Black Friday" (9 juli 1971).
| Införande av metylgrupper i två mesopositioner |
|---|
|
Denna introduktion av metylgrupper skulle kunna bygga på explorativa studier på modell corrins såväl som på explorativa experiment utförda vid ETH på cobester och dess (c→C-8)-laktonderivat. Klormetylbensyleter alkylerade mesopositionen C-10 i cobester, men inte den för motsvarande lakton , varvid skillnaden i beteende återspeglar skillnaden i steriskt hinder som utövas på mesopositionen C-10 av dess närliggande substituenter. Detta fynd var avgörande för valet av substrat som skulle användas för att introducera metylgrupper vid mesopositionerna C-5 och C-10 i E-37/HE-44 . I denna slutfas av syntesen HPLC återigen vara absolut oumbärlig för separation, isolering, karakterisering och framför allt identifiering av rena isomerer av dicyano-kobolt(III)-komplex av helt såväl som delvis syntetiskt ursprung. Det första steget var att omvandla c- N,N -dimetylkarboxamidgruppen i E-37/HE-44 till (c→C-8)-laktonderivatet E-38/HE-45 genom behandling med jod /AcOH som åstadkommer jodering vid C-8, följt av intramolekylär O -alkylering av karboxamidgruppen till ett iminiumsalt som hydrolyserar till laktonen. Denna laktonisering leder till cis -fusionerade ringar. Reaktion av (c-→C-8)-lakton E-38/HE-45 med klormetylbensyleter i acetonitril i närvaro av LiCl gav, förutom monoaddukt, bis-bensyloxiaddukten E-39/HE-46 . När det behandlades med tiofenol producerade detta bis-fenyltio-derivatet E-40/HE-47 . Behandling med Raney-nickel i MeOH frigjorde inte bara de två metylgrupperna vid mesopositionerna, utan öppnade också reduktivt laktonringen till den fria c-karboxylgruppen vid ring B, vilket gav den korrekta α- konfigurationen vid C-8. Förestring av c-karboxyl med diazometan gav hexametylester-f-nitril E-41/HE-48 . Av steriska skäl reagerade endast den dominerande C-3 α-epimeren (med C-3 sidokedjan under korrinringens plan) på en 5,15- disubstituerad produkt E-38/H-45 , varvid reaktionen således uppgick till till en kemisk separation av C-3-epimererna. I förbättrade förfaranden utvecklade vid Harvard senare 1972 ersattes reagenset klormetylbensyleter med formaldehyd /sulfolan/HCl i acetonitril för alkyleringssteget, och Raney-nickel i reduktionssteget ersattes med zink/ättiksyra för att ge E-41/ HE-48 . |
| Dicyano-kobolt(III)-3α,8α,13α-a,b,c,d,e,g-hexamethyl-cobyrinate-f-amid: Identifiering med material som härrör från vitamin B 12 |
|---|
|
Koncentrerad H2SO4 vid rumstemperatur omvandlade nitrilfunktionen av ren (3α,8α,13α)-E-41/HE-48 till den primära f- amidgruppen av E -42/HE-49 , förutom partiell epimerisering vid C -13; ett alternativt förfarande för den selektiva omvandlingen av f-nitril→f-amid ( BF3 i CH3COOH ) som senare utvecklades vid Harvard fortsatte utan epimerisering vid C-13. Ett kristallint prov av 3a,8a,13a-epimeren av dicyano-kobolt (III)-a,b,c,d,e,g-hexametyl-kobyrinat-f-amid E-42/HE-49, isolerad med HPLC , var den första helt syntetiska mellanprodukten som kromatografiskt och spektroskopiskt identifierades med ett reläprov tillverkat av vitamin B 12 . I de återstående stegen av syntesen spelade endast epimerisering vid C-13 en viktig roll, där 13α är konfigurationen av de naturliga korrinoiderna, och 13β känd som neo -epimerer av vitamin B 12 och dess derivat; dessa kan lätt separeras med HPLC. Under loppet av 1972 utfördes omfattande identifieringar (HPLC, UV/VIS , IR , NMR , CD , masspektra ) av kristallina prover av helt syntetiska intermediärer med motsvarande föreningar härledda från vitamin B 12 i båda laboratorierna: individuellt jämfört och identifierade var 3a,8a,13a och 3a,8a,13β neo -epimeren av f-amid E-42/HE-49 , såväl som motsvarande par av C-13-epimera nitriler E-41/HE-48 . Alla dessa dicyano-kobolt(III)-komplex är lösliga i organiska lösningsmedel i vilka separationsförmågan för HPLC vida överstiger den hos analytiska metoder som arbetar i vatten, lösningsmedlet i vilket kobyrinsyra skulle identifieras, och där den existerar som två lätt utjämnande aquo-cyanokomplex, epimeriska avseende positionen för de två icke-identiska axiella Co- liganderna . Dessa grundliga identifieringar av det helt syntetiska med delvis syntetiska material markerar genomförandet av de två synteserna. De gav också ömsesidigt strukturbevis för en specifik konstitutionell isomer isolerad från en blandning av isomera monoamider bildade i den partiella ammonolysen av den B 12 -härledda cobestern, preliminärt tilldelad till 3α,8α,13α-f-amiden E-42 /HE-49 (se fig. 30). |
| Syntetisk kobyrinsyra |
|---|
|
Den sista uppgiften att nå kobyrinsyra från f-amid E-42/HE-49 krävde det kritiska steget att hydrolysera den singulära amidfunktionen till en fri karboxylfunktion utan att röra någon av de sex metoxikarbonylgrupperna runt molekylens periferi. Eftersom utforskande försök med den konventionella metoden för amidhydrolys via nitrosering ledde till skadliga sidoreaktioner vid kromoforen , uttänktes och utforskades ett nytt sätt att " hydrolysera " f-amidgruppen utan att röra de sex metylestergrupperna vid ETH: behandling av f- amid E-42/HE-49 (B 12 -härlett relämaterial) med det ovanliga reagenset α-klor-propyl-(N-cyklohexyl) -nitron och AgBF 4 i CH 2 Cl 2 , sedan med HCl i H 2 O/ dioxan , och slutligen med dimetylamin i isopropanol gav f-syran E-43/HE-50 i 57 % utbyte. Ihållande experiment vid Harvard visade så småningom att nitroseringsmetoden var framgångsrik ( N 2 O 4 , CCl 4 , NaOAc ) och att producera f-karboxylgruppen ännu mer effektivt. Det var också vid Harvard som villkoren för det sista steget undersöktes, omvandling av alla återstående estergrupper till primära amidgrupper genom ammonolys . Flytande ammoniak i etylenglykol , i närvaro av NH 4 Cl och frånvaro av syre, omvandlade f-karboxi-hexametylester E-43/HE-50 till f-karboxi-hexa-amid E-44/HE-51 (= kobyrsyra syra). Detta kristalliserades och visades både som a-cyano-p-aquo- och a-aquo-p-cyanoformen vara kromatografiskt och spektroskopiskt identisk med motsvarande former av naturlig kobyrinsyra. genomfördes så småningom transformationen E-43/HE-50 → E-44/HE-51 med början av f-amid som hade erhållits genom total syntes via A/B-metoden. ETH-gruppen nöjde sig med en motsvarande f-amid → kobyrinsyraomvandling och efterföljande kobyrinsyraidentifiering där det faktiska utgångsmaterialet f-amid härrörde från vitamin B 12 . |