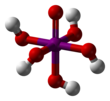
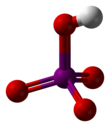
Perjodsyra
|
Ortoperiodic acid
|
|||
|
Metaperiodic acid
|
|||

HIO 4 ·2H 2 O
|
|||
| Namn | |||
|---|---|---|---|
Andra namn
|
|||
| Identifierare | |||
|
|||
|
3D-modell ( JSmol )
|
|
||
| ChemSpider | |||
| ECHA InfoCard | 100.030.839 | ||
| EG-nummer |
|
||
|
PubChem CID
|
|
||
| UNII |
|
||
| FN-nummer | UN3085 | ||
|
CompTox Dashboard ( EPA )
|
|||
|
|||
|
|||
| Egenskaper | |||
|
HIO 4 (metaperiodisk) H 5 IO 6 (ortoperiodisk) |
|||
| Molar massa |
190,91 g/mol ( HIO 4 ) 227,941 g/mol ( H 5 IO 6 ) |
||
| Utseende | Färglösa kristaller | ||
| Smältpunkt | 128,5 °C (263,3 °F; 401,6 K) | ||
| Löslighet | löslig i vatten, alkoholer | ||
| Konjugerad bas | Periodat | ||
| Faror | |||
| GHS- märkning : | |||
   
|
|||
| Fara | |||
| H271 , H314 , H372 , H400 | |||
| P210 , P260 , P273 , P303+P361+P353 , P305+P351+P338 | |||
| NFPA 704 (branddiamant) | |||
| Säkerhetsdatablad (SDS) | Externt MSDS | ||
| Besläktade föreningar | |||
|
Andra anjoner
|
|
||
|
Andra katjoner
|
|||
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|||
Perjodsyra ( / ˌ p ɜːr aɪ ˈ ɒ d ɪ k / per-eye- OD -ik ) är den högsta oxosyran av jod , där joden finns i oxidationstillstånd +7. Det kan finnas i två former: ortoperiodic syra, med den kemiska formeln H 5 IO 6 , och metaperiodic syra, som har formeln HIO 4 .
Periodic acid upptäcktes av Heinrich Gustav Magnus och CF Ammermüller 1833.
Syntes
Produktion i modern industriell skala involverar oxidation av en lösning av natriumjodat under alkaliska förhållanden, antingen elektrokemiskt på en PbO 2 -anod eller genom behandling med klor :
- IO − 3 + 6 HO − - 2 e − → IO 5− 6 + 3 H 2 O ( motjoner uteslutna för tydlighetens skull) E ° = -1,6 V
- IO − 3 + 6 HO − + Cl 2 → IO 5− 6 + 2 Cl - + 3 H2O
Ortoperjodsyra kan dehydratiseras för att ge metaperjodsyra genom upphettning till 100 °C under reducerat tryck.
- H 5 IO 6 ⇌ HIO 4 + 2 H 2 O
Ytterligare uppvärmning till cirka 150 °C ger jodpentoxid ( I 2 O 5 ) snarare än den förväntade anhydriden dijodheptoxid ( I 2 O 7 ). Metaperjodsyra kan också framställas av olika ortoperiodater genom behandling med utspädd salpetersyra .
Egenskaper
Ortoperiodic syra har ett antal syras dissociationskonstanter . P Ka för metaperjodsyra har inte bestämts.
- H 5 IO 6 ⇌ H 4 IO − 6 + H + , p Ka = 3,29
- H 4 IO − 6 ⇌ H 3 IO 2− 6 + H + , p Ka = 8,31
- H 3 IO 2− 6 ⇌ H 2 IO 3-6 _ + + H , pKa = 11,60
Det finns två former av perjodsyra, det följer att två typer av perjodatsalter bildas. Till exempel kan natriummetaperjodat , NaIO4 , syntetiseras från HIO4 medan natriumortoperiodat , Na5IO6 kan syntetiseras från H5IO6 .
Strukturera
Ortoperiodic syra bildar monoklina kristaller ( rymdgrupp P2 1 / n ) bestående av en lätt deformerad IO 6 oktaeder sammanlänkad via bryggande väten. Fem I–O-bindningsavstånd ligger i intervallet 1,87–1,91 Å och en I–O-bindning är 1,78 Å. Strukturen av metaperiodic syra inkluderar också IO 6 oktaedrar, men dessa är anslutna via cis -kantdelning med överbryggande syre för att bilda endimensionella oändliga kedjor.
Reaktioner
Liksom alla perjodater kan perjodsyra användas för att klyva olika 1,2-difunktionella föreningar. Framför allt kommer perjodsyra att klyva vicinala dioler till två aldehyd- eller ketonfragment ( Maprade-reaktion) .
Detta kan vara användbart för att bestämma strukturen av kolhydrater eftersom perjodsyra kan användas för att öppna sackaridringar. Denna process används ofta för att märka sackarider med fluorescerande molekyler eller andra taggar som biotin . Eftersom processen kräver vicinala dioler, används perjodatoxidation ofta för att selektivt märka 3′-ändarna av RNA ( ribos har vicinala dioler) istället för DNA eftersom deoxiribos inte har vicinala dioler.
Perjodsyra används också som ett oxidationsmedel med måttlig styrka, vilket exemplifieras i Babler-oxidationen av sekundära allylalkoholer som oxideras till enoner av stökiometriska mängder ortoperiodic syra med katalysator PCC .
Andra oxisyror
Perjodat är en del av en serie oxisyror där jod kan anta oxidationstillstånd på -1, +1, +3, +5 eller +7. Ett antal neutrala jodoxider är också kända.
| Jodoxidationstillstånd | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| namn | Vätejodid | Hypojodsyra | Jodsyra | Jodsyra | Perjodsyra |
| Formel | HEJ | HIO | HIO 2 | HIO 3 | HIO 4 eller H 5 IO 6 |
Se även
Föreningar med liknande struktur:
- Perklorsyra , perbromsyra , de relaterade perhalogensyrorna
- Tellursyra och perxensyra , de isoelektroniska oxosyrorna av tellur och xenon
Föreningar med liknande kemi: