Spinocerebellär ataxi typ 1
| Spinocerebellär ataxi typ 1 | |
|---|---|
| Andra namn | SCA1, Schuts sjukdom |
 | |
| AXH-domän av Ataxin 1 | |
| Specialitet | Neurologi |
| Symtom | Ataxi av gång och ställning, hypermetriska saccader , dysartri , dysfagi |
| Komplikationer | Lunginflammation , fysisk skada från fall |
| Vanligt debut | Mellan 3:e och 4:e decenniet |
| Varaktighet | Långsiktigt |
| Orsaker | Genetisk |
| Diagnostisk metod | Genetisk testning |
| Prognos | 10–30 år från början |
| Frekvens | 1–2 per 100 000 |
Spinocerebellär ataxi typ 1 (SCA1) är en sällsynt autosomal dominant störning, som, liksom andra spinocerebellära ataxier , kännetecknas av neurologiska symtom inklusive dysartri , hypermetriska saccader och ataxi i gång och ställning. Denna cerebellära dysfunktion är progressiv och permanent. Första debuten av symtom är normalt mellan 30 och 40 års ålder, även om juvenil debut kan förekomma. Döden inträffar vanligtvis inom 10 till 30 år från början.
SCA1 ärvs vanligtvis från föräldrarna i en autosomal dominant regim; barn till en person med sjukdomen har 50 % chans att ärva den själva och nya mutationer kan uppstå i vissa fall. Det orsakas av ett utökat antal trinukleotidupprepningar i polyglutaminkanalen i ATXN1 -genen, som kodar för ataxin 1-proteinet. Denna expansion resulterar i ett större än normalt antal upprepningar av nukleotidsekvensen cytosin , adenin , guanin eller CAG, i genen, vilket i sin tur resulterar i ett större än normalt antal på varandra följande glutaminaminosyrarester i proteinet. Detta mutantprotein orsakar nedbrytning i vissa typer av neuroner, som Purkinje-neuroner , som är vanliga i lillhjärnan , ryggmärgen och relaterade delar av hjärnan. Även om mekanismen inte är helt klarlagd, misstänks det att förändringar i interaktionerna mellan ataxin 1 och andra proteiner resulterar i en toxisk funktionsförstärkning.
Mutationen kan upptäckas före eller efter symtomdebut genom genetisk testning . För närvarande är inget botemedel mot SCA1 känt, så behandling av sjukdomen fokuserar främst på hantering av symtom för att upprätthålla livskvalitet, med fokus på sjukgymnastik för att träna om och ersätta förlorade funktioner. Forskning för att utveckla behandlingar pågår och utöver konventionell läkemedelsbehandling har SCA1 varit föremål för forskning kring mer avancerade behandlingsalternativ som genterapi och stamcellsterapi . I världen förväntas 1 till 2 personer av 100 000 ha spinocerebellär ataxi typ 1, men prevalensen varierar mellan populationer och är ofta kopplad till grundareffekten .
Ataxi som symptom har varit känt sedan mitten av 1800-talet och den heterogena grupp sjukdomar som nu kallas spinocerebellära ataxi var föremål för omfattande forskning under senare delen av det seklet. Framsteg inom molekylär genetik under 1900-talet gjorde det möjligt att identifiera distinkta orsaker till dessa sjukdomar. I början av 1990-talet var genen som orsakade SCA1 lokaliserad till det humana leukocytantigenkomplexet på kromosom 6 och 1993 identifierades ataxin 1 som den orsakande genen. Det var den första spinocerebellära ataxi-orsakande genen som lokaliserades och identifierades.
tecken och symtom
Ataxi hänvisar till brist på koordinerade muskelrörelser som inkluderar gångavvikelser och är det cerebellära tecknet som kännetecknar alla typer av spinocerebellär ataxi (SCA), även om individer med SCA1 också utvecklar pyramidala och bulbära tecken när sjukdomen fortskrider. Den genomsnittliga debutåldern är mellan 30 och 40 år, även om undantag finns. Från de första symtomen är varaktigheten vanligtvis mellan ett och tre decennier, där tidigare debut korrelerar med snabbare progression.
Spinocerebellär ataxi 1, liksom andra SCAs, orsakar ofta dysartri , en motorisk talstörning som ofta uppenbarar sig som sluddring av ord; patologisk nystagmus , en störning där ögonen driver ofrivilligt och påverkar synen; och gång- och balansproblem. SCA1 är också vanligt förekommande med dysfagi , en sväljstörning som kan orsaka kvävning när man äter och dricker; och hypermetriska saccader , där ögat tenderar att röra sig snabbare eller längre än vad det är tänkt när det spårar ett objekt eller flyttar från ett fokus till ett annat. När sjukdomen fortskrider kan allvarligare neurologiska symtom uppträda som dysmetri , där lemrörelser konsekvent överskrider den önskade positionen; dysdiadocokinesi , där upprepade kroppsrörelser blir okoordinerade; eller hypotoni , där muskelatrofi. Medan nya symtom uppträder när SCA1 fortskrider, kan nystagmus försvinna när ögonrörelser och saccader saktar ner. Dödsfall kan i slutändan orsakas av förlust av bulbarfunktioner, men komplikationer från symtom, såsom lunginflammation från sväljproblem eller trauma från fall, kan också vara dödliga. Svårighetsgraden och den exakta fenotypen av dessa symtom kan variera mellan olika typer av SCA. SCA 1-dysartri kan variera i svårighetsgrad beroende på uppgiften och är ofta förknippad med mer ansträngd, strypt eller hårt klingande vokalisering än andra störningar.
På grund av den betydande skillnaden mellan fall av SCA1 kan typiska tecken och symtom uppträda tillsammans med mer subtila eller sällsynta symtom. Makulopati har rapporterats i sällsynta fall och kan vara kopplade effekter från mutationen på ATXN1- lokuset på gener i angränsande loci. Uppgiftsspecifika dystonier har rapporterats i enskilda fall, ofta i form av författarkramper eller cervikal dystoni .
SCA kan också upptäckas före allvarlig atrofi med elektrofysiologiska tekniker, med hjälp av elektroder i hårbotten för att upptäcka förändringar i elektrisk potential i hjärnan som svar på förnimmelser eller rörelser. Individer med SCA1 uppvisar ofta onormal hörselframkallad potential i hjärnstammen , inklusive förlängd latens och frånvarande eller dåligt definierade vågformer, med en studie som rapporterade att 73,3 % av testpersonerna uppvisade abnormiteter. Samma studie fann också abnormiteter i visuell framkallad potential och median somatosensorisk framkallad potential hos vissa SCA1-personer. Dessa resultat liknade de som visades i andra SCAs och skillnaderna mellan SCAs var inte statistiskt signifikanta, så elektrofysiologiska tekniker kan inte ersätta genetiska tester för specifika diagnoser av SCAs.
Alla SCA orsakar atrofi i olika neurala vävnader som kan detekteras med hjälp av magnetisk resonanstomografi , datortomografi eller andra avbildningstekniker . I SCA1 kan en viss nedbrytning av den grå substansen i lillhjärnan och hjärnstammen ibland detekteras hos presymptomatiska individer med expansionen i ATXN1 . Vanligtvis kan förlust av grå substans observeras i cerebellar vermis i alla lobulus i lillhjärnan och i de paramediana delarna av båda hemisfärerna. Vitsubstansförlust kan också observeras i de mellersta cerebellära stjälkarna . Volymförlusten kan korreleras till svårighetsgrad och varaktighet.
Uppskattningsvis 77 % av fallen av progressiv cerebellär sjukdom rapporteras ha en eller flera psykiska störningar , och 19 % uppvisar kognitiva störningar . Dessa uppskattningar är genomgående högre än andelen med psykiska störningar i den allmänna befolkningen, men följer fortfarande andra allmänna mönster, som korrelationer mellan depressionsfrekvens och kön eller ålder. Det är oklart om depression kan kopplas kausalt till cerebellär degeneration; en studie rapporterar data som överensstämmer med att depression i första hand är ett svar på funktionsnedsättningen, inte ett symptom på det, medan en annan rapporterar bevis för att depression kan ha ett orsakssamband; Prevalensen av depression varierar olika mellan SCA-typer än graden av progression av funktionshinder.
Genetik
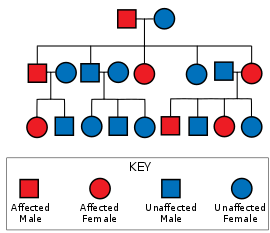
Spinocerebellär ataxi typ 1 orsakas av en mutation i ATXN1 -genen. Denna mutation överförs genom ett autosomalt dominant nedärvningsmönster, vilket innebär att sjukdomen inte hoppar över generationer, minst en förälder måste ha sjukdomen för att barnen ska ärva den, och att oddsen för att ett givet barn ärver SCA 1, oavsett kön eller andra fenotyper, är 50 % om den drabbade föräldern är heterozygot . ATXN1 - genen på kromosom 6 kodar för ataxin 1-proteinet, som används i signalvägar och genreglering , och som är kraftigt uttryckt i Purkinje-neuroner . Den kodande regionen för Ataxin 1 (6p22.3) innehåller en polyglutaminkanal av varierande längd. SCA1 finns hos individer där regionen på minst en kopia av kromosom 6 innehåller 39 eller fler kontinuerliga upprepningar av glutamin där fler upprepningar är korrelerade till tidigare debut och snabbare progression. Histidinavbrott i polygluataminkanalen kan mildra eller förhindra SCA1.
SCA1 är känt för att uppvisa genetisk förväntan , där en generation med sjukdomen kan uppvisa tidigare debut och snabbare progression än föregående generation. Detta orsakas vanligtvis av expansioner i polyglutaminkanalen mellan generationer och är vanligare i fall av patrilineär nedärvning. Detta icke-mendelska arv liknar det som observerats vid Huntingtons sjukdom och tros vara orsakat av skillnader i olika mekanismer i könscellers produktion mellan könen som resulterar i ökad mosaicism i den manliga könslinjen . DNA med CAG-upprepningar är benägna att bilda sekundära strukturer, inklusive hårnålsslingor och R-loopar , vilket kan resultera i mutationer och mosaicism om DNA-reparationsmekanismer misslyckas. Dessa sekundära strukturer orsakar somatisk mosaicism genom att eftersläpa DNA-polymeras i Okazaki-fragment och genom att störa DNA-felmatchningsreparation , basexcisionsreparation , nukleotidexcisionsreparation och dubbelsträngsbrottsreparationsmekanismer. Mekanismen för groddlinjeexpansion är inte väl förstått, men man tror att endast missmatchningsreparationsvägar påverkar groddlinjeinstabilitet och MSH2 -reparationsproteinet har kopplats till expansioner i manliga gameter i mössmodeller.
Patofysiologi
Normalt ataxin 1 är intimt involverat i ett antal signalvägar , i protein ubiquitination , RNA-metabolism, i transkriptionsreglering , proteintransformation och proteinstabilisering. Bland andra interaktioner bildar det ett transkriptionskomplex med Retinoid-relaterad Orphan nuclear-receptor transcription factor α (RORα) efter interaktioner med en aktivator, Histonacetyltransferas KAT5 , ibland kallad TIP60, och det är i signaleringen medierad av metabotrop glutamatreceptor 1 (mGluRl). Resonantigenkänningsmodellering av ataxin 1-proteinet har visat möjliga bindningsställen för tillväxtfaktoroberoende transkriptionsrepressor 1 (Gfi-1). Förutsägelserna av denna beräkningsmodell avslöjar en interaktion som kan spela en roll i SCA1-patologi, eftersom Gfi-1-proteinet är känt för att orsaka selektiv nedbrytning av Purkinje-celler. Det är den omfattande inblandningen av ataxin 1 i många olika funktioner som gör att förstå den biokemiska patofysiologin för dess mutanta form svårt att identifiera och förstå.
Mekanismen genom vilken expanderade CAG-repeterande regioner i ataxin 1 orsakar neuronal degeneration är oklar. Det antogs historiskt vara orsakat av aggregering och avsättning av det påverkade proteinet liknande andra polyglutaminexpansionssjukdomar, men gnagarmodellstudier har visat signifikant senare bildning av nukleära inneslutningar av mutanta proteiner i cerebellum och ryggmärgsneuroner än i kortikala och hippocampala neuroner, som vanligtvis endast visar mild degeneration hos SCA1-personer, vilket tyder på en mer komplicerad mekanism. Ataxin-null möss har visat sig uppvisa minskad motorisk och rumslig inlärning, vilket tyder på attaxin 1 spelar en roll i synaptisk plasticitet och interaktioner mellan motorneuronerna och hippocampus . Möss som saknar båda kopiorna av ataxin 1 utvecklar dock inte progressiva neurologiska symtom eller visar tecken på atrofi, vilket tyder på att toxicitet hos det muterade proteinet, inte förlust av funktion, är huvudmekanismen för SCA1-patologi. En jämförelse av mRNA mellan ataxin-nullmöss och möss med ataxin1 154Q/+ visar att det finns vanliga förändringar i genuttryck, inklusive uppreglering av gener som är kända för att undertryckas av ett ataxin 1/ CIC - komplex. Detta tyder på att, även om det inte är den primära mekanismen, en förlust av ataxin 1-funktion bidrar till patogenesen av SCA1. Medan ataxin 1/CIC-komplexet förlorar en del av sin regulatoriska funktion med expanderat ataxin 1, visar CIC knockout-möss inte degeneration, vilket tyder på att interaktioner mellan ataxin 1 och CIC förmedlar de flesta av de toxiska effekterna. Mutant ataxin-1 är också känt för att förändra de neurala kretsarna i den utvecklande lillhjärnan, vilket kan leda till senare sårbarhet hos Purkinje-celler och antyder förekomsten av icke-cellautonom toxicitet.
De olika interaktionerna av ataxin 1 leder till många möjliga faktorer som kan förvärra eller måttliga toxiciteten hos dess muterade form. Vildtypsataxin 1 bryts snabbt ned i cytoplasman, men kan stabiliseras genom fosforylering och 14-3-3-bindning efter behov av cellen. SCA1-positiva möss med haplodeficienta i 14-3-3ε +/- visades inte uppvisa cerebellär degeneration men uppvisade fortfarande dödlig bulbar degeneration, vilket tyder på att cerebellär atrofi kan vara relaterad till ökad stabilitet hos det expanderade ataxin 1-proteinet och att det kan finnas olika patogena mekanismer för olika delar av hjärnan. Fosforyleringsstället är serinet vid den 776:e resten i ataxin 1. I likhet med de som saknar 14-3-3-proteiner, uppvisar inte möss med denna rest ersatt med alanin cerebellärt syndrom. På liknande sätt förhindrar avlägsnande av AXH-domänen från ataxin 1 avvikande interaktioner med tillväxtfaktoroberoende transkriptionsrepressor 1 som leder till GFI1-nedbrytning i proteasomen . Den expanderade polyglutaminregionen resulterar i ökad affinitet hos ataxin 1 AXH-domänen för vissa transkriptionsfaktorer, och denna effekt tros spela en betydande roll i ataxin 1-toxicitet. Ett annat protein som har visat sig ha signifikanta interaktioner med ataxin 1 är det leucinrika sura kärnproteinet eller LANP. Dess funktion är okänd, men den uttrycks övervägande i samma neuroner som ataxin 1 och har visats lokaliseras i kärnorna i dessa neuroner vid samma understrukturer som ataxin 1. LANP interagerar endast med polyglutaminregionen i ataxin 1, och dess interaktioner är starkare när antalet glutaminrester ökar, så de två proteinerna är sannolikt viktiga för varandras funktioner i neuroner och LANP kan också underlätta patologin hos mutanta ataxin 1-proteiner. Ataxin 1 like , även kallad Brother of Ataxin 1 eller Boat, har betydande interaktioner med ataxin-1 och många associerade proteiner, som N-CoR . Ataxin 1-liknande har minskat uttryck i transgena mössmodeller och har visat sig måttliga cytotoxiciteten av ataxin-1.
Toxicitet från det muterade proteinet orsakar nedbrytning i neurala vävnader. Detta inkluderar förlust av dendritisk abort, eller förgrening, tidigt i sjukdomsprogression och eventuell atrofi av hjärnvävnad i senare stadier. SCA1 orsakar måttlig nedbrytning av en mängd olika vävnader , inklusive båda hjärnhalvorna i lillhjärnan, cerebellar vermis , pons och hjärnstammen . Det orsakar också mild atrofi i hjärnbarkvävnaden . En nyligen genomförd studie fann också signifikant atrofi av ryggmärgen och tillplattad bakre pelare och fann en korrelation mellan strängarea, CAG-repetitioner och SARA-poäng i SCA1. Vävnader i centrala nervsystemet, till skillnad från ben, muskler eller hud, saknar mekanismer för endogent generering och differentiering av nya celler och för att återställa långdistansmönster och förbindelser när de går förlorade, så när degenerationen fortskrider är förlusterna permanenta.
Diagnos och utvärdering
De flesta SCAs och andra ataxiska störningar är kliniskt heterogena, vilket innebär att kliniska tecken och symtom är lika mellan sjukdomar och att skilja mellan sjukdomar med enbart en neurologisk undersökning är svårt. Hos symtomatiska personer kräver diagnos av ataxirelaterade störningar ofta en neurologisk undersökning, utvärdering av neurologisk historia och familjehistoria och molekylärgenetiska tester . Avsaknad av en familjehistoria utesluter inte ärftliga orsaker som spinocerebellär ataxi typ 1 eftersom familjehistoria kanske inte har samlats in eller kan vara otillgänglig för vissa individer och nya fall kan härröra från förväntan i en allel med ett föränderligt antal upprepningar. För att fastställa en diagnos är molekylär genetisk testning för närvarande kommersiellt tillgänglig för 14 SCA-typer, inklusive SCA1. I fall där SCA inte förekommer i familjehistorien eller där familjehistoria inte är tillgänglig, kommer testning för de 4 vanligaste SCAs att ge positiva resultat för 50 % av misstänkta SCA-fall. Individer som löper risk att ärva SCA1 men som för närvarande är presymptomatiska kan också screenas med molekylär genetisk testning.
Genetisk testning
Genetisk testning är det enda definitiva sättet att skilja mellan typer av spinocerebellär ataxi på grund av likheten mellan kliniska egenskaper hos dessa sjukdomar och den stora variationen mellan fallen. Genetisk testning är tillgänglig för många SCA-typer, inklusive de relativt vanliga typerna SCA1, 2, 3 , 6 och 7; och de mindre vanliga SCA8, 10, 12, 14 och 17. Men genetisk testning är hög i kostnad och har en låg diagnostisk avkastning, med positiva diagnoser som endast hittas i 24 % av testerna som beställs av en subspecialist och 10 % totalt.
Genetisk testning kan administreras i olika stadier av sjukdomsprogression. När genetisk testning görs efter symptomdebut, sägs testet vara diagnostiskt; hos vuxna före symtomdebut är det presymptomatiskt, och testet kan utföras för prenatala eller preimplantationsdiagnoser. European Molecular Quality Genetics Network (EMQN) rekommenderar kriterier för varje typ, som måste uppfyllas innan testning kan påbörjas. EQMN rekommenderar att laboratorier får en skriftlig klinisk utvärdering av symtom av en neurolog och ett avslöjande av familjehistoria, eller brist på historia, innan diagnostisk genetisk testning påbörjas. Eftersom inga förebyggande eller botande behandlingar är kända för SCA, rekommenderas inte genetiska tester för individer i riskzonen för alla fall, och de utfärdas vanligtvis på individuell basis. Presymtomatiska, prenatala och preimplantationstestningar begärs vanligtvis genom en genetisk rådgivare och kräver befintlig familjehistoria och dokumentation om informerat samtycke från konsulten och konsulten. Spinocerebellär ataxi typ 1 var en av de första sent debuterande sjukdomarna för vilka presymptomatisk testning visades vara effektiv och prediktiv; före utvecklingen av testning för SCA1 var Huntingtons sjukdom den enda liknande sjukdom för vilken presymptomatisk testning fanns tillgänglig.
Molekylär genetisk testning av SCA måste kunna skilja prover med den patogena allelen från de utan och kunna noggrant mäta antalet upprepningar i upprepade expansionsstörningar. Kapillärelektrofores (CE) är en metod som har uppfyllt dessa kriterier och rekommenderas av EMQN. En annan metod som är vanlig är polyakrylamidgelelektrofores (PAGE). Båda metoderna kräver amplifiering av alla loci av intresse för ett givet test. Amplifiering görs med användning av polymeraskedjereaktioner eller PCR. Valet av primrar kan tillåta att antingen en enstaka gen amplifieras eller att många gener kan amplifieras för användning i en multiplexanalys, vilket kan spara tid i fall där en panel med många tester kan krävas. PAGE och CE använder båda tidsinställda cykler av elektricitet för att dra bitar av DNA genom en porös polymer och separera analyter genom en kombination av jonisk rörlighet, storlek och massa. CE är fördelaktigt framför PAGE genom att molekylviktsmätningar som masspektrometri kan användas med analyter, medan PAGE kräver användning av Southern blot för att möjliggöra jämförelse med en sekvenseringsstege . För upprepade längder inom intervallet där avbrott är relevanta kommer analyser som CE och PAGE inte att avgöra om stammen är patogen och ytterligare tester kommer att krävas.
Klinisk
Det finns inga formella diagnostiska kriterier för de flesta SCA, och genetisk testning är den enda säkra diagnostiska metoden, men klinisk undersökning av tecken och symtom kan vara avgörande för att skilja SCA från icke-genetiska ataxier och från andra typer av genetiska ataxier. Klinisk undersökning kan också hjälpa till att skilja mellan SCA-typer i viss mån, så genetiska tester för vissa typer kan prioriteras framför andra. Diagnos av SCA börjar ofta med upptäckten av symtom som tyder på en cerebellär störning, som progressiv ataxi eller dysartri, eller med erkännande av liknande symtom som ett fall som identifierats i individens familjehistoria, särskilt i första eller andra gradens släktingar. Många laboratoriestudier kan användas för att ytterligare begränsa den potentiella orsaken till ataxi; avbildning av hjärna och ryggmärg och olika elektrofysiologiska undersökningar kan vara användbara för att identifiera sjukdomsfenotyper och blod- och urinstudier kan utesluta förvärvade orsaker.
När man utvärderar ataxiska störningar och deras behandlingar finns det många tester som en neurolog kan utföra . Tester kan utvärderas individuellt eller följa en skala för att utvärdera ataxi. En cerebellär undersökning kan innefatta att säga fraser med många konsonanter för att upptäcka skanningstal , detektera horisontell blicknystagmus genom att följa ett finger med ögonen, utföra snabba alternerande rörelser som att rotera en hand från handflatan till rygg upprepade gånger, testa Holmes rebound-fenomenet och testa patella . reflex för hypotoni eller hypertoni. Vanliga skalor inkluderar International Cooperative Ataxia Rating Scale (ICARS) och Scale for the Assessment and Rating of Ataxic Disorders (SARA) för att utvärdera svårighetsgraden av ataxi som ett symptom. ICARS mäter på en 100-skala, där 0 är normal funktion och 100 är högsta möjliga funktionsnedsättning, vilket ger olika poängvärden för olika tester. Testerna är indelade i kategorier som utvärderar hållning och gång, kinetiska funktioner, tal och oculomotoriska funktioner. Även om dessa kategorier skapar användbar kategorisering för att bedöma vilka områden som behöver fokuseras på i terapier, resulterar denna redundans i en längre testtid, vilket kan förvränga resultaten av tester som utförs i slutet av en session; och kan resultera i motsägelsefulla poäng. SARA är en kortare tentamen, utvärderad på en skala från 0 till 40, där noll återigen är normal funktion och 40 är högsta möjliga funktionsnedsättning. Den består av åtta tester: gång, ställning, fingerjakt, finger-till-näsa-test , snabba alternerande handrörelser, häl-bensglidning och tre kinektiska funktionstester för extremiteterna.
Differentialdiagnos
Differentialdiagnostik av SCA med kliniska metoder är svårt eftersom dessa sjukdomar är kliniskt heterogena och det finns betydande skillnader mellan uttrycket av enskilda fall. Att använda klinisk information för differentialdiagnos används för att prioritera genetisk testning inte som en fristående diagnos. Många potentiella differentierande symtom har hittats och metoder för att bedöma många symtom och deras utveckling för att vägleda genetiska tester har utvecklats. Även om en specifik typ av spinocerebellär ataxi inte omedelbart kan fastställas klinisk historia , kan familjehistoria, klinisk undersökning hjälpa till att skilja mellan andra ataxi och kan hjälpa till att minska antalet genetiska tester som behövs för att identifiera en typ av SCA. Undersökning av släktingar till individer som tros ha sporadisk ataxi kan ofta avslöja tillräckligt med familjehistoria för att identifiera ett smittsätt.
Det finns några vanliga trender som kan vara användbara för att diskriminera SCAs. SCA1 tenderar att utvecklas snabbare än SCA2, 3 och 6, med större årlig förändring i SARA-poäng och tidigare förlust av funktioner efter debut. Vid diagnostik av klinisk ataxi kan bildbehandling inte vara användbar för att skilja SCA1 från andra SCA eftersom det finns betydande variation mellan enskilda fall och betydande överlappning mellan sjukdomar. Vestibulo-okulär reflex kan testas med ett videoinspelat huvudimpulstest eller vHIT. I detta test har SCA1 normalt normal reflexlatens och visar inte konsekvent ett underskott i VOR-funktion, vilket skiljer den från SCA3 och Friedreichs ataxi. Vissa mönster i okulära motoriska störningar, detekterbara med video-okulografi , tycks känneteckna vissa SCA-typer. Även om SCA1 inte var signifikant korrelerad med ett unikt mönster, kan andra möjliga SCA länkas och frånvaron av en vertikal nystagmus efter horisontell huvudskakning minskar sannolikheten för en SCA6-diagnos, medan frånvaron av ett fyrkantsvågmönster under fixering minskar sannolikheten för SCA3 .
Ett möjligt system för differentialdiagnos av SCA-typer är att registrera utvecklingen av symtom och använda Bayesiansk sannolikhet för att bygga en prediktiv modell, eller en Bayesiansk klassificerare, som jämför de observerade data med trender som de som beskrivs ovan för att hitta sannolikheten för varje diagnos att vara korrekt. En sådan Bayesiansk klassificerare visade sig exakt förutsäga 78 % av SCA-fallen ur en kohort med kända typer av SCA. Känsligheten och specificiteten för SCA1 inom denna modell var 76,9 % respektive 98,2 %. Regional variation i prevalens, symtom och klinisk bedömning kan fortfarande begränsa användningen av detta system i stor skala, även om systemet kan implementeras av enskilda kliniker som använder sina egna regionala data.
Förvaltning
Det finns för närvarande inget botemedel mot spinocerebellär ataxi typ 1. Vissa av dess symtom kan dock hanteras med fysiska , yrkes- eller talterapier , livsstils- och kostförändringar eller med mediciner. Att hantera symtom kommer inte att hindra sjukdomen från att fortskrida men kan vara viktigt för att upprätthålla livskvaliteten . Det är dock viktigt att notera att många störningar som orsakar ataxi och relaterade symtom finns, och att behandlingsstrategier som fungerar för vissa, såsom vitamin E- tillskott för vissa förvärvade ataxier, inte kommer att fungera för ärftliga ataxier som SCA1 och kan vara farliga till en persons hälsa.
Små kohortstudier har visat att individer med cerebellära störningar återhämtar sig koordination och har lägre SARA-poäng oavsett stadium eller svårighetsgrad av sin ataxi innan terapin när de regelbundet deltar i sjukgymnastik eller tränar på individer som inte gör det. Dessa studier tyder på att multidomänsjukgymnastik, mer fokuserad koordinativ träning och träningsrutiner alla gav förbättringar i SARA-poäng motsvarande minst ett års normal progression, 2,2 poäng eller mer i genomsnitt, under loppet av flera veckor. Även om dessa resultat är lovande, kan större studier behövas för att validera dessa resultat. Sammantaget har sjukgymnastik för individer med ataxi blygsamma bevis som stöder dess effektivitet, men nuvarande praxis använder anpassade behandlingar utan ett standardförfarande för beslutsfattande mellan kliniker, vilket begränsar möjligheten att reproducerbart bedöma kvaliteten på rutiner i litteraturen. Bland de tidigast utvecklade neurorehabiliteringsmetoderna är Frenkel-övningar , som utvecklades av Heinrich Frenkel i mitten av artonhundratalet; dessa övningar hämtades från samtida fysikalisk medicin och rehabiliteringstekniker , kallade medicinsk gymnastik, och från vardagliga aktiviteter, som att resa sig upp från en stol, för att hitta övningar som är nära besläktade med ataxis patologi och förlitar sig på långsam träning och på individens uthållighet att lära om viktiga motoriska färdigheter, ersätta förlorad proprioception med visuell feedback. Det finns övningar för nedre extremiteter, som att sträcka ut benen, och övre extremiteter, som att placera pinnar i brädor, och beroende på svårighetsgraden av ataxi kan utföras liggande, sittande eller stående. Alla övningar börjar ofta med enkla rörelser och blir allt svårare att efterlikna verkliga rörelser som påverkas av störningen.
Vanliga rekommendationer för personer med dysfagi, eller sväljproblem, inkluderar att puréa mat, ersätta svårätbar mat i kosten eller att ändra hållning under maten. När sväljproblem blir tillräckligt allvarliga för att aspirationslunginflammationer är frekventa eller kostförändringar inte lyckas förhindra viktminskning, kan en sond övervägas. Vanligtvis är dessa perkutan endoskopisk gastrostomi jejunalrör (PEG-Js), men dessa leder inte nödvändigtvis till en minskad förekomst av aspiration, eftersom tilltäppningar kan resultera i gastroesfagal reflux som kan aspireras. Direkta PEG-Js verkar orsaka mindre frekventa reflux och har lägre incidens av aspirationspneumoni jämfört med standard PEG-J-proceduren. Många strategier för behandling av dysfagi har undersökts, inklusive fysiska övningar som modifierade Valsalva-manövrar , farmaceutiska behandlingar inriktade på att behandla spasticitet och kompenserande metoder inklusive justering av hållning och längre tuggning. Dessa strategier, liksom behandlingen av många symtom ärftliga ataxier, har småskaliga bevis för deras användbarhet men är ännu inte fastställda av stora studier.
Som med alla ärftliga sjukdomar är oron för påverkan på familjemedlemmar, särskilt barn, ofta mycket viktiga. Individer som diagnostiserats med SCA 1 kan söka genetisk rådgivning för att hjälpa till med familjeplanering , utveckla coping-förmåga och planering för framtiden. Personer med SCA 1 kan överväga provrörsbefruktning med preimplantationstestning för att förhindra att sjukdomen överförs till sina barn.
Prognos
Penetrans för SCA1 är 100 % för de flesta alleler, så nästan alla individer som har minst en kopia av den muterade genen kommer så småningom att utveckla symtom. Minst ett fall har rapporterats där penetrans kan ha varit ofullständig hos en kvinna med 44 glutaminrepetitioner med histidinavbrott vars pappa hade uppvisat symtom, men själv inte visat symtom vid 66 års ålder. Individer med lågt antal repetitioner, ca. 39 till 55, lever vanligtvis över reproduktiv ålder och kan överföra sjukdomen till sina barn, medan höga upprepningar kan uttrycka ungdomsdebut och dödsfall.
Epidemiologi
National Institute of Health rapporterar att SCA1 har en prevalens på cirka 1 eller 2 per 100 000, men en litteraturgenomgång har visat att dessa uppskattningar varierar avsevärt från studie till studie och kan vara mindre än 1 per 100 000 eller så hög som 6 per 100 000. Bland alla typer av SCA är SCA1 bland de vanligaste och andelen som SCA1 står för varierar mellan geografiska regioner, med så höga procentandelar som 40 % av alla SCA-diagnoser i populationer i Ryssland och Sydafrika som SCA1. I USA står SCA1 för 6 % av SCA-diagnoserna. Totalt sett står SCA1 för 6-27% av alla fall av dominerande ataxi. På grund av dess sena debut, som ofta uppträder efter reproduktiv ålder, utövar SCA1 låg selektionsintensitet, rankad omkring 0,19 på Crow's index, men intensiteten kan variera med tiden inom en population eller familj, eftersom förväntan ökar antalet CAG-repetitioner. En implikation av detta är att SCA1 sannolikt inte kommer att försvinna från en population enbart genom naturligt urval.
Prevalensen av varje typ av SCA varierar med geografisk region och etnicitet, möjligen på grund av grundareffekter och historiska migrationsmönster. Högprevalensregioner inkluderar centrala Polen , där 68 % av autosomalt dominanta cerebellära störningar är SCA1; samhällen i Tamil Nadu , där upp till 7,2 % av befolkningen har SCA1 i vissa små byar; Tohoku -regionen på den norra delen av Honshu Island , med 24,8 % av fallen SCA1; och bland Yakut -befolkningar i östra Sibirien , med en prevalens på 46 per 100 000 på landsbygden.
Historia
Ataxi som symtom beskrevs först av den franske neurologen Duchenne de Boulogne i en patient med tabes dorsalis . I slutet av 1800-talet och början av 1900-talet pågick omfattande forskning om karaktärisering, orsak och diagnostik av ärftliga cerebellära ataxier med arbete av flera framstående neurologer, inklusive Jean-Martin Charcot , Pierre Marie , Nikolaus Friedreich , Adolph Strümpell och andra . Marie beskrev ett antal fall av ärftlig, vuxensjukdom som han trodde var kliniskt skild från Friedreichs ataxi , spastisk paraplegi och andra kända typer av ataxi, och kallade syndromet ärftlig cerebellär ataxi, även om det blev känt för Maries ataxi.
Även om de ärftliga mönstren var tydligt distinkta, pågick en debatt långt in på 1940-talet om huruvida Maries ataxi verkligen var skild från Freidreichs ataxi och Strümpells paraplegi och om dessa kategorier i sig representerade en enskild sjukdom eller många. Detta berodde på den heterogena karaktären hos ärftliga ataxier, likheten mellan symtom och bristen på förstådda biokemiska mekanismer. Ytterligare frustration över tvetydigheten i termer som introducerades av Marie och Friedreich resulterade i skapandet av andra system för att klassificera ataxi. Gordon Morgan Holmes och Godwin Greenfield utvecklade båda system för att kategorisera ataxi, vilket gav upphov till kategorier som kallas olivopontocerebellär atrofi och spinocerebellär nedbrytning, även om lite konsensus uppnåddes mellan systemen, och många termer används omväxlande.
Under depressionstiden i USA var familjen Schut i Minnesota en familj som var känd för att bära på en ärftlig ataxi. Flera familjemedlemmar deltog aktivt i forskning och familjen samtyckte till obduktionsundersökningar av hjärnan hos flera avlidna släktingar. Sjukdomen i familjen Schut visade sig ha ett autosomalt dominant arvsmönster och drabbade spinocerebellarkanalen. År 1945 fick John Schut gratis medicinsk skolutbildning för sin tjänst i USA:s armé under andra världskriget och började sina egna ansträngningar för att forska i ärftlig ataxi. Schut utvecklade ataxi som många av hans släktingar. 1957, när Schuts ataxi utvecklades till en punkt där han inte kunde fortsätta arbeta i vanlig medicinsk praktik, grundade han National Ataxia Foundation med labbutrymme donerat av Glenwood Hills Hospital i Minneapolis.
John Schuts brorson, Lawerence Schut, blev också ataxiforskare och bidrog till att lokalisera en spinocerebellär ataxigen till det humana leukocytantigenkomplexet i kromosom 6. Framgången med att koppla en av dessa klasser av sjukdomar till ett lokus visade att klassificeringssystemen som används kunde inte skilja på sjukdomar med många olika orsaker. Många ataxiska störningar som historiskt identifierades som Maries ataxi, olivopontocerebellär atrofi eller andra namn omklassificerades nu till typer av spinocerebellär ataxi, varje typ numrerad i ordning som ett nytt lokus hittades. 1993 identifierades genen och en mutation som orsakade spinocerebellär ataxi typ 1. Det var den första genetiska defekten som upptäcktes orsaka en ataxisk störning.
Forskningsanvisningar
Behandling och lindring av neurodegenerativa störningar är av särskilt intresse för forskare, och flera potentiella alternativ för SCA1 är under utredning. Eftersom patologin för SCA1 är komplex finns det flera möjliga tillvägagångssätt för behandling, som inkluderar eliminering av expanderade ataxin 1-proteiner, minskning av toxiciteten hos expanderade ataxin 1-proteiner, undertryckande av produktion av ataxin 1, flera genterapier och ersättning av förlorade hjärnceller. Eftersom många SCA, inklusive SCA1, är polyglutaminsjukdomar och fungerar med liknande mekanismer som Huntingtons sjukdom, undersöks många lovande behandlingar för Huntingtons sjukdom också för SCA.
Nedreglering och tystnad av gener
Eftersom spinocerebellära ataxi ofta är kopplade till en mutation på en enda gen, kan en modifiering av hur genen uttrycks modifiera fenotypen . Det finns flera tillvägagångssätt för att modifiera uttrycket av mutanta proteiner, inklusive tekniker som helt stoppar uttrycket, känd som gentystnad . I SCA1 kräver patogenes konstant uttryck av den muterade ATXN1- genen, och tystnad har visat sig stoppa ytterligare progression av sjukdomen, rensa kärninneslutningar och aggregat och leda till partiell återhämtning av motoriska funktioner i gnagarmodeller med villkorat uttryck av genen. Det villkorade uttrycket av ATXN1 i mössmodeller skiljer sig från hur genen skulle tystas terapeutiskt men resultaten indikerar att terapeutiska metoder för gentystnad kan vara genomförbara för behandling och hantering av SCA1. Processen som omvandlar kodad information i DNA till proteiner kräver två steg: transkription, där DNA används för att generera en komplementär RNA-sträng av RNA-polymeras, och translation, där RNA används för att producera ett protein av ribosomer. Att störa båda stegen kan bromsa eller förhindra uttrycket av en mutant gen.
Ataxin 1 är involverat i ett antal signalvägar och dess uttryck styrs av signalvägar. MAPK /ERK -vägen har visats aktivera ataxin 1-uttryck, och MSK1 fosforylerar också ataxin 1, vilket kontrollerar dess lokalisering och nedbrytning. Inhibitorer av nyckelproteiner i denna väg kan användas i kombinationsterapi för att potentiellt minska uttrycket och sänka steady state-koncentrationer av ataxin 1.
En teknik för att störa translation, antisens-oligonukleotidterapi , som använder enkla RNA-strängar som är komplementära till målet för att förhindra att målet binder till en ribosom och utlöser nedbrytningen av målet, har redan påbörjat kliniska prövningar i andra neurodegenerativa sjukdomar med många olika leveranser. mekanismer. En liknande teknik är RNA-interferens eller RNAi. Istället för komplementära "antisense"-strängar av RNA, använder RNAi mycket små dubbelsträngade segment av RNA som kallas små störande RNA som utlöser nedbrytning av målet innan det kan översättas. Studier med RNAi-medel levererade av adenoassocierade virus (AAV) har visat sig stoppa utvecklingen av sjukdomen och leda till viss återhämtning av funktionen med behandling som endast tillämpas på de djupa cerebellära kärnorna hos möss och rhesusmakaker . Båda dessa tekniker är svåra att tillämpa på polyglutaminsjukdomar eftersom inriktning på polyglutaminkanalen kan orsaka att även normala gener nedregleras. SCA1 har också visat sig vara svårt att målinrikta på ett tillförlitligt sätt med singelnukleotidpolymorfismer, vilket begränsar antalet sätt RNAi och antisense-terapitekniker kan utformas för att behandla SCA1.
Minska toxicitet och öka cellöverlevnad
På grund av de många interaktioner som ataxin-1 har med andra proteiner, ändrar tekniker för att minska toxiciteten hos mutant ataxin-1-proteinet ofta uttrycket av besläktade proteiner. Till exempel har ataxin-1-liknande många gemensamma domäner med ataxin-1 och överuttryck av ataxin-1-liknande konkurrerar med ataxin-1 och förhindrar dess integration i andra komplex, vilket minskar toxiciteten. Denna effekt replikerades i mössmodeller med användning av AAV och visade sig vara ungefär lika effektiv som RNAi-tekniker för att bromsa symtomförloppet. På liknande sätt fungerar läkemedlet baklofen , som används för att minska spasticitet hos personer med multipel skleros och relaterade sjukdomar, som en agonist av γ-aminosmörsyra typ B-receptorer ( GABA BR ). Denna väg korshör med mGluR1-vägen, som interagerar med ataxin 1-proteinet och proteiner som ansvarar för lokalisering och nedbrytning av ataxin 1, vilket tyder på att baklofen kan vara en livskraftig behandling för SCA 1-behandling.
Molekylära chaperoner är introducerade proteiner som kan ha interaktioner med mutantproteinet som minskar toxiciteten genom olika mekanismer. Studier i både mössmodeller och Drosophila -modeller har visat att värmechockproteinerna 40 och 70 kan minska toxiciteten hos expanderade ataxin 1-proteiner och långsam progression av SCA1.
Även om det för närvarande inte finns någon känd metod för att uteslutande främja polyglutaminsammandragningar in vivo, har tekniker som använder programmerbara nukleaser visat något lovande när det gäller att orsaka dessa förändringar in vitro. Programmerbara nukleaser är proteiner som kan bryta DNA-strängar nära sekvenser som kan specificeras av forskare före användning. Detta inkluderar CRISPR/Cas9 , som använder ett protein som finns i bakterier och ledsträng av RNA, och zinkfingernukleaser , som använder konstruerade proteiner med speciella återkommande DNA-bindande domäner för att styra ett fäst nukleas. En studie rapporterar att både CRISPR och zinkfingrar nukleaser som är beroende av dubbelsträngsbrott utlöser sammandragningar och expansioner med nästan lika frekvens, medan CRISPR använder en mutant variant av Cas9, Cas9 D10A eller Cas9 nickase, som endast orsakar enkelsträngsbrott, huvudsakligen producerade sammandragningar .
Hos möss bidrar mitokondriella försämringar till SCA1-progression. Framträdande förändringar i Purkinje-cells mitokondriella proteiner sammanfaller med sjukdomens symtomatiska fas. Purkinje-celler i SCA1-möss genomgår också åldersberoende förändringar i mitokondriell morfologi. Dessutom har Purkinje-celler från SCA1-möss försämrade elektrontransportkomplex och minskad ATPas- aktivitet. SCA1-mössen upplever ökad oxidativ stress och ökad oxidativ DNA-skada . Den mitokondriella riktade antioxidanten MitoQ visade sig bromsa uppkomsten av SCA1-kopplade neuropatologier såsom bristande motorisk koordination . MitoQ förhindrade också oxidativ stress inducerad DNA-skada och Purkinje-cellförlust.
Cellersättningsterapier
Ett behandlingsalternativ som undersöks är stamcellsterapi , som försöker ersätta död vävnad genom att transplantera stamceller till det drabbade området och antingen stimulera dem att differentiera till önskade celltyper eller låta dem stimulera endogena regenerativa mekanismer. Dessa tekniker är av intresse för forskare som en möjlig behandling av neurodegenerativa sjukdomar, men är för närvarande av begränsad framgång i djurmodeller och i cellodlingsstudier in vitro. Förmågan för transplanterade celler att integreras i den önskade vävnaden och anpassa sig för de unika patologierna för olika neurodegenerativa sjukdomar kan vara en allvarlig begränsning för utvecklingen av stamcellsbaserade behandlingar. Vidare är vävnaderna i hjärnan ofta beroende av invecklade och komplicerade arrangemang av neuroner; regioner i hjärnan som inte kräver precision i dessa mönster för att fungera, som striatum som påverkas av Parkinsons sjukdom som använder parakrin signalering , tenderar att ha bättre resultat i stamcellsterapier än system som kräver precision, som lillhjärnan och pons. Stamcellsterapier kan vara särskilt svåra för att ersätta Purkinje-neuronförlust eftersom opåverkade granulceller kan förhindra att axoner når de djupa cerebellära kärnorna som Purkinje-cellerna samverkar med. Trots dessa svårigheter har ympade neurala prekursorceller visat sig vara livskraftiga och framgångsrikt migrera till önskad plats i SCA1 transgena mössmodeller och mesenkymala stamceller har visat sig mildra förlusten av dendritisk arborisation SCA1 möss. Positiva resultat har hittats i mössmodeller som använder både stamceller från fetala neuroektoderm och vuxna stamceller från laterala ventriklarna och dentate gyrus . Användning av skördade stamceller i stamcellsterapier kräver immunsuppression för att förhindra värden från att avvisa transplantaten; att skapa inducerade pluripotenta stamceller från värdens egna celler skulle minska denna risk och har testats med andra neurodegenerativa sjukdomar.