Stamcell
| Stamcell | |
|---|---|

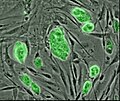
Transmissionselektronmikrofotografi av en mesenkymal stamcell som visar typiska ultrastrukturella egenskaper
| |
| Detaljer | |
| Identifierare | |
| latin | Cellula praecursoria |
| Maska | D013234 |
| TH | H1.00.01.0.00028, H2.00.01.0.00001 |
| FMA | 63368 |
| Anatomisk terminologi | |
I flercelliga organismer är stamceller odifferentierade eller delvis differentierade celler som kan differentiera till olika typer av celler och föröka sig på obestämd tid för att producera mer av samma stamcell. De är den tidigaste typen av celler i en celllinje . De finns i både embryonala och vuxna organismer, men de har lite olika egenskaper i var och en. De särskiljs vanligtvis från stamceller , som inte kan dela sig på obestämd tid, och prekursor- eller blastceller, som vanligtvis är engagerade i att differentiera till en celltyp.
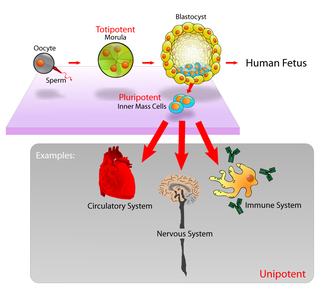
Hos däggdjur utgör ungefär 50–150 celler den inre cellmassan under blastocyststadiet av embryonal utveckling , runt dag 5–14. Dessa har stamcellskapacitet. In vivo differentierar de så småningom till alla kroppens celltyper (gör dem pluripotenta ). Denna process börjar med differentieringen i de tre groddskikten - ektodermen , mesodermen och endodermen - i gastrulationsstadiet . Men när de isoleras och odlas in vitro kan de hållas i stamcellsstadiet och kallas embryonala stamceller (ESC).
Vuxna stamceller finns på ett fåtal utvalda platser i kroppen, kända som nischer , till exempel de i benmärgen eller könskörtlarna . De existerar för att fylla på snabbt förlorade celltyper och är multipotenta eller unipotenta, vilket innebär att de bara differentierar till ett fåtal celltyper eller en typ av cell. Hos däggdjur inkluderar de bland annat hematopoetiska stamceller , som fyller på blod- och immunceller, basalceller , som upprätthåller hudepitelet, och mesenkymala stamceller , som upprätthåller ben-, brosk- , muskel- och fettceller. Vuxna stamceller är en liten minoritet av celler; de är avsevärt mindre än stamfadercellerna och terminalt differentierade celler som de differentierar till.
Forskning om stamceller växte fram ur fynden av de kanadensiska biologerna Ernest McCulloch , James Till och Andrew J. Becker vid University of Toronto och Ontario Cancer Institute på 1960-talet. Från och med 2016 är den enda etablerade medicinska behandlingen med stamceller hematopoetisk stamcellstransplantation, som först utfördes 1958 av den franske onkologen Georges Mathé . Sedan 1998 har det dock varit möjligt att odla och differentiera mänskliga embryonala stamceller (i stamcellslinjer) . Processen att isolera dessa celler har varit kontroversiell , eftersom den vanligtvis resulterar i att embryot förstörs. Källor för att isolera ESC har begränsats i vissa europeiska länder och Kanada, men andra som Storbritannien och Kina har främjat forskningen. Somatisk cellkärnöverföring är en kloningsmetod som kan användas för att skapa ett klonat embryo för användning av dess embryonala stamceller i stamcellsterapi. År 2006 upptäckte ett japanskt team under ledning av Shinya Yamanaka en metod för att omvandla mogna kroppsceller tillbaka till stamceller. Dessa kallades inducerade pluripotenta stamceller (iPSCs).
Historia
Termen stamcell myntades av Theodor Boveri och Valentin Haecker i slutet av 1800-talet. Banbrytande arbeten inom teorin om blodstamceller utfördes i början av 1900-talet av Artur Pappenheim , Alexander Maximow , Franz Ernst Christian Neumann .
En stamcells nyckelegenskaper definierades först av Ernest McCulloch och James Till vid University of Toronto och Ontario Cancer Institute i början av 1960-talet. De upptäckte den blodbildande stamcellen, den hematopoetiska stamcellen (HSC), genom sitt banbrytande arbete på möss. McCulloch och Till började en serie experiment där benmärgsceller injicerades i bestrålade möss. De observerade klumpar i mjälten på mössen som var linjärt proportionella mot antalet injicerade benmärgsceller. De antog att varje klump (koloni) var en klon som härrörde från en enda märgcell (stamcell). I efterföljande arbete bekräftade McCulloch och Till, tillsammans med doktoranden Andrew John Becker och seniorforskaren Louis Siminovitch , att varje klump faktiskt uppstod från en enda cell. Deras resultat publicerades i Nature 1963. Samma år var Siminovitch en ledande utredare för studier som fann att kolonibildande celler var kapabla till självförnyelse, vilket är en nyckeldefinierande egenskap hos stamceller som Till och McCulloch hade teoretiserat.
Den första behandlingen med stamceller var en benmärgstransplantation utförd av den franske onkologen Georges Mathé 1958 på fem arbetare vid Vinča Nuclear Institute i Jugoslavien som hade drabbats av en kritisk olycka . Arbetarna överlevde alla.
1981 isolerades embryonala stamceller (ES) först och odlades framgångsrikt med hjälp av musblastocyster av de brittiska biologerna Martin Evans och Matthew Kaufman . Detta möjliggjorde bildandet av murina genetiska modeller, ett system där generna från möss raderas eller ändras för att studera deras funktion inom patologi. År 1998 isolerades embryonala stamceller först av den amerikanske biologen James Thomson , vilket gjorde det möjligt att ha nya transplantationsmetoder eller olika celltyper för att testa nya behandlingar. 2006 Shinya Yamanakas team i Kyoto, Japan fibroblaster till pluripotenta stamceller genom att modifiera uttrycket av endast fyra gener. Bragden representerar ursprunget till inducerade pluripotenta stamceller, kända som iPS-celler.
År 2011 genomgick en manad varghona , överkörd av en lastbil, stamcellsbehandling på Zoo Brasília, vilket är det första registrerade fallet av användning av stamceller för att läka skador hos ett vilt djur.
Egenskaper
Den klassiska definitionen av en stamcell kräver att den har två egenskaper:
- Självförnyelse: förmågan att gå igenom många cykler av celltillväxt och celldelning , känd som cellproliferation , samtidigt som det odifferentierade tillståndet bibehålls.
- Potens : förmågan att differentiera till specialiserade celltyper. I strikta mening kräver detta att stamceller är antingen totipotenta eller pluripotenta — för att kunna ge upphov till vilken mogen celltyp som helst, även om multipotenta eller unipotenta progenitorceller ibland kallas stamceller. Bortsett från detta sägs det att stamcellsfunktionen regleras i en återkopplingsmekanism.
Självförnyelse
Två mekanismer säkerställer att en stamcellspopulation upprätthålls (krymper inte i storlek):
1. Asymmetrisk celldelning : en stamcell delar sig i en modercell, som är identisk med den ursprungliga stamcellen, och en annan dottercell, som är differentierad.
När en stamcell förnyar sig själv delar den sig och stör inte det odifferentierade tillståndet. Denna självförnyelse kräver kontroll av cellcykeln samt underhåll av multipotens eller pluripotens, som allt beror på stamcellen.
2. Stokastisk differentiering: när en stamcell växer och delar sig i två differentierade dotterceller, genomgår en annan stamcell mitos och producerar två stamceller identiska med originalet.
Stamceller använder telomeras , ett protein som återställer telomerer , för att skydda sitt DNA och förlänga sin celldelningsgräns ( Hayflick-gränsen) .
Potens betydelse

Mänskliga embryonala stamceller A: Stamcellskolonier som ännu inte är differentierade. B: Nervceller , ett exempel på en celltyp efter differentiering.
Potens specificerar differentieringspotentialen (potentialen att differentiera till olika celltyper) hos stamcellen.
- Totipotenta (även kända som omnipotenta) stamceller kan differentiera till embryonala och extraembryonala celltyper. Sådana celler kan konstruera en komplett, livsduglig organism. Dessa celler produceras från fusionen av ett ägg och en spermiecell. Celler som produceras av de första delningarna av det befruktade ägget är också totipotenta.
- Pluripotenta stamceller är ättlingar till totipotenta celler och kan differentiera till nästan alla celler, dvs celler som härrör från vilket som helst av de tre könsskikten .
- Multipotenta stamceller kan differentiera till ett antal celltyper, men bara de från en närbesläktad familj av celler.
- Oligopotenta stamceller kan differentiera till endast ett fåtal celltyper, såsom lymfoida eller myeloida stamceller.
- Unipotenta celler kan endast producera en celltyp, sin egen, men har egenskapen att förnya sig, vilket skiljer dem från icke-stamceller
Identifiering
I praktiken identifieras stamceller av om de kan regenerera vävnad. Till exempel är det avgörande testet för benmärg eller hematopoetiska stamceller ( HSC) förmågan att transplantera cellerna och rädda en individ utan HSC. Detta visar att cellerna kan producera nya blodkroppar på lång sikt. Det bör också vara möjligt att isolera stamceller från den transplanterade individen, som själva kan transplanteras till en annan individ utan HSC, vilket visar att stamcellen kunde förnya sig själv.
Egenskaper hos stamceller kan illustreras in vitro , med hjälp av metoder såsom klonogena analyser , där enstaka celler bedöms för deras förmåga att differentiera och självförnya. Stamceller kan också isoleras genom att de har en distinkt uppsättning cellytmarkörer. In vitro- odlingsförhållanden kan dock ändra beteendet hos celler, vilket gör det oklart om cellerna ska bete sig på liknande sätt in vivo . Det finns en betydande debatt om huruvida vissa föreslagna vuxna cellpopulationer verkligen är stamceller.
Embryonal
Embryonala stamceller (ESC) är cellerna i den inre cellmassan av en blastocyst , som bildas före implantation i livmodern. I mänsklig embryonal utveckling uppnås blastocyststadiet 4–5 dagar efter befruktning , då det består av 50–150 celler. ESC är pluripotenta och ger upphov under utvecklingen till alla derivat av de tre bakterielagren : ektoderm , endoderm och mesoderm . Med andra ord kan de utvecklas till var och en av de mer än 200 celltyperna i den vuxna kroppen när de ges tillräcklig och nödvändig stimulans för en specifik celltyp. De bidrar inte till de extraembryonala membranen eller till moderkakan .
Under embryonal utveckling delar sig cellerna i den inre cellmassan kontinuerligt och blir mer specialiserade. Till exempel specialiserar sig en del av ektodermen i den dorsala delen av embryot som " neurectoderm ", som kommer att bli det framtida centrala nervsystemet . Senare i utvecklingen neurulation neurectoderm att bilda neuralröret . I neuralrörsstadiet genomgår den främre delen encefalisering för att generera eller "mönstra" hjärnans grundläggande form. Vid detta utvecklingsstadium anses den huvudsakliga celltypen i CNS vara en neural stamcell .
De neurala stamcellerna förnyar sig själv och övergår vid något tillfälle till radiella glia progenitorceller ( RGP). Tidiga formade RGP:er förnyas själv genom symmetrisk delning för att bilda en reservoargrupp av progenitorceller . Dessa celler övergår till ett neurogent tillstånd och börjar dela sig asymmetriskt för att producera en stor mångfald av många olika neurontyper, var och en med unikt genuttryck, morfologiska och funktionella egenskaper. Processen att generera neuroner från radiella gliaceller kallas neurogenes . Den radiella gliacellen har en distinkt bipolär morfologi med mycket långsträckta processer som spänner över tjockleken på neuralrörsväggen. Det delar vissa gliaegenskaper , framför allt uttrycket av glialfibrillärt surt protein (GFAP). Den radiella gliacellen är den primära neurala stamcellen i det utvecklande ryggradsdjurets CNS, och dess cellkropp finns i ventrikulärzonen, intill det utvecklande ventrikulära systemet . Neurala stamceller är engagerade i de neuronala linjerna ( neuroner , astrocyter och oligodendrocyter ), och därför är deras styrka begränsad.
Nästan all forskning hittills har använt sig av embryonala musstamceller (mES) eller mänskliga embryonala stamceller (hES) som härrör från den tidiga inre cellmassan. Båda har de väsentliga stamcellsegenskaperna, men de kräver väldigt olika miljöer för att upprätthålla ett odifferentierat tillstånd. Mus-ES-celler odlas på ett lager av gelatin som en extracellulär matris (för stöd) och kräver närvaro av leukemihämmande faktor (LIF) i serummedia. En drogcocktail som innehåller hämmare av GSK3B och MAPK/ERK-vägen , kallad 2i, har också visat sig bibehålla pluripotens i stamcellskultur. Humana ESCs odlas på ett matarlager av musembryonala fibroblaster och kräver närvaron av grundläggande fibroblasttillväxtfaktor (bFGF eller FGF-2). Utan optimala odlingsförhållanden eller genetisk manipulation kommer embryonala stamceller att snabbt differentiera sig.
En mänsklig embryonal stamcell definieras också av uttrycket av flera transkriptionsfaktorer och cellytproteiner. Transkriptionsfaktorerna Oct-4 , Nanog och Sox2 bildar det centrala regulatoriska nätverket som säkerställer undertryckandet av gener som leder till differentiering och upprätthållande av pluripotens. De cellyteantigener som oftast används för att identifiera hES-celler är de glykolipidstadiespecifika embryonala antigenerna 3 och 4 och keratansulfatantigenerna Tra-1-60 och Tra-1-81. Den molekylära definitionen av en stamcell innehåller många fler proteiner och fortsätter att vara ett ämne för forskning.
Genom att använda mänskliga embryonala stamceller för att producera specialiserade celler som nervceller eller hjärtceller i labbet, kan forskare få tillgång till vuxna mänskliga celler utan att ta vävnad från patienter. De kan sedan studera dessa specialiserade vuxna celler i detalj för att försöka urskilja komplikationer av sjukdomar, eller för att studera cellreaktioner på föreslagna nya läkemedel.
På grund av deras kombinerade förmåga av obegränsad expansion och pluripotens, förblir embryonala stamceller en teoretiskt potentiell källa för regenerativ medicin och vävnadsersättning efter skada eller sjukdom. Men det finns för närvarande inga godkända behandlingar som använder ES-celler. Den första studien på människor godkändes av US Food and Drug Administration i januari 2009. Den mänskliga studien inleddes dock inte förrän den 13 oktober 2010 i Atlanta för forskning om ryggmärgsskada . Den 14 november 2011 meddelade företaget som genomför studien ( Geron Corporation ) att de kommer att avbryta vidareutvecklingen av sina stamcellsprogram. Att differentiera ES-celler till användbara celler samtidigt som man undviker transplantatavstötning är bara några av de hinder som embryonala stamcellsforskare fortfarande står inför. Embryonala stamceller, eftersom de är pluripotenta, kräver specifika signaler för korrekt differentiering - om de injiceras direkt i en annan kropp, kommer ES-celler att differentiera till många olika typer av celler, vilket orsakar ett teratom . Etiska överväganden kring användningen av ofödd mänsklig vävnad är en annan orsak till bristen på godkända behandlingar med embryonala stamceller. Många nationer har för närvarande moratorier eller begränsningar för antingen forskning på mänskliga ES-celler eller produktion av nya mänskliga ES-cellinjer.
Embryonala stamceller från mus med fluorescerande markör
Mesenkymala stamceller
Mesenkymala stamceller (MSC) eller mesenkymala stromaceller, även kända som medicinska signalceller, är kända för att vara multipotenta, som kan hittas i vuxna vävnader, till exempel i muskel, lever, benmärg och fettvävnad. Mesenkymala stamceller fungerar vanligtvis som strukturellt stöd i olika organ som nämnts ovan, och kontrollerar rörelser av ämnen. MSC kan differentiera i flera cellkategorier som en illustration av adipocyter, osteocyter och kondrocyter, härledda av det mesodermala lagret. Där mesodermlagret ger en ökning av kroppens skelettelement, såsom relaterat till brosket eller benet. Termen "meso" betyder mitten, infusion härstammar från grekiskan, vilket betyder att mesenkymala celler kan sträcka sig och resa i tidig embryonal tillväxt mellan de ektodermala och endodermala skikten. Denna mekanism hjälper till att fylla ut utrymmet, vilket är nyckeln till att reparera sår hos vuxna organismer som har att göra med mesenkymala celler i dermis (hud), ben eller muskler.
Mesenkymala stamceller är kända för att vara nödvändiga för regenerativ medicin. De studeras brett i kliniska prövningar . Eftersom de är lätta att isolera och erhåller högt utbyte, hög plasticitet, vilket gör det möjligt att underlätta inflammation och uppmuntra celltillväxt, celldifferentiering och återställa vävnad som härrör från immunmodulering och immunsuppression. MSC kommer från benmärgen, som kräver en aggressiv procedur när det gäller att isolera kvantiteten och kvaliteten på den isolerade cellen, och det varierar med hur gammal donatorn. När man jämför frekvensen av MSC i benmärgsaspirat och benmärgsstroma, tenderar aspiraten att ha lägre frekvenser av MSC än stroma. MSC är kända för att vara heterogena och de uttrycker en hög nivå av pluripotenta markörer jämfört med andra typer av stamceller, såsom embryonala stamceller. MSCs injektion leder till sårläkning främst genom stimulering av angiogenes.
Cellcykelkontroll
Embryonala stamceller (ESC) har förmågan att dela sig på obestämd tid samtidigt som de behåller sin pluripotens , vilket är möjligt genom specialiserade mekanismer för cellcykelkontroll . Jämfört med prolifererande somatiska celler har ESC unika cellcykelegenskaper - såsom snabb celldelning orsakad av förkortad G1-fas , frånvarande G0-fas och modifieringar i cellcykelkontrollpunkter - vilket lämnar cellerna mestadels i S-fas vid varje given tidpunkt. ESCs snabba delning visas av deras korta fördubblingstid, som sträcker sig från 8 till 10 timmar, medan somatiska celler har en fördubblingstid på cirka 20 timmar eller längre. När cellerna differentierar sig förändras dessa egenskaper: G1- och G2-faserna förlängs, vilket leder till längre celldelningscykler. Detta tyder på att en specifik cellcykelstruktur kan bidra till etableringen av pluripotens.
Särskilt eftersom G1-fasen är den fas i vilken celler har ökad känslighet för differentiering, är förkortad G1 en av nyckelegenskaperna hos ESC och spelar en viktig roll för att upprätthålla odifferentierad fenotyp . Även om den exakta molekylära mekanismen förblir endast delvis förstådd, har flera studier visat insikt om hur ESC:er går igenom G1 - och potentiellt andra faser - så snabbt.
Cellcykeln regleras av ett komplext nätverk av cykliner , cyklinberoende kinaser (Cdk), cyklinberoende kinashämmare (Cdkn), fickproteiner från retinoblastomfamiljen (Rb) och andra accessoriska faktorer. Grundläggande insikt i den distinkta regleringen av ESC-cellcykeln erhölls genom studier på mus-ESCs (mESCs). mESCs visade en cellcykel med mycket förkortad G1-fas, vilket gjorde det möjligt för celler att snabbt växla mellan M-fas och S-fas. I en somatisk cellcykel observeras oscillerande aktivitet av Cyclin-Cdk-komplex i sekventiell verkan, som styr avgörande regulatorer av cellcykeln för att inducera enkelriktade övergångar mellan faser: Cyclin D och Cdk4/6 är aktiva i G1-fasen, medan Cyclin E och Cdk2 är aktiva under den sena Gl-fasen och S-fasen; och Cyclin A och Cdk2 är aktiva i S-fasen och G2, medan Cyclin B och Cdk1 är aktiva i G2- och M-fasen. Men i mESCs är denna typiskt ordnade och oscillerande aktivitet av Cyclin-Cdk-komplex frånvarande. Snarare är Cyclin E/Cdk2-komplexet konstitutivt aktivt under hela cykeln, vilket håller retinoblastomprotein (pRb) hyperfosforylerat och därmed inaktivt. Detta möjliggör direkt övergång från M-fasen till den sena G1-fasen, vilket leder till frånvaro av cykliner av D-typ och därför en förkortad G1-fas. Cdk2-aktivitet är avgörande för både cellcykelreglering och cellödebeslut i mESCs; nedreglering av Cdk2-aktivitet förlänger G1-fasprogression, etablerar en somatisk cellliknande cellcykel och inducerar uttryck av differentieringsmarkörer.
I mänskliga ESCs (hESCs) är varaktigheten av G1 dramatiskt förkortad. Detta har tillskrivits höga mRNA-nivåer av G1-relaterade Cyclin D2- och Cdk4-gener och låga nivåer av cellcykelreglerande proteiner som hämmar cellcykelprogression vid G1, såsom p21 CipP1 , p27 Kip1 och p57 Kip2 . Dessutom uttrycks regulatorer av Cdk4- och Cdk6-aktivitet, såsom medlemmar av Ink-familjen av inhibitorer (p15, p16, p18 och p19), vid låga nivåer eller inte alls. Således, i likhet med mESCs, visar hESCs hög Cdk-aktivitet, med Cdk2 som uppvisar den högsta kinasaktiviteten. Liknande mESC:er, visar hESC:er vikten av Cdk2 i G1-fasreglering genom att visa att G1 till S-övergången försenas när Cdk2-aktiviteten hämmas och G1 stoppas när Cdk2 slås ner. Men till skillnad från mESCs har hESCs en funktionell G1-fas. hESC visar att aktiviteterna för Cyclin E/Cdk2- och Cyclin A/Cdk2-komplex är cellcykelberoende och Rb-kontrollpunkten i G1 är funktionell.
ESC: er kännetecknas också av G1-kontrollpunkt icke-funktionalitet, även om G1-kontrollpunkten är avgörande för att upprätthålla genomisk stabilitet. Som svar på DNA-skador stannar inte ESC i G1 för att reparera DNA-skador utan beror istället på S- och G2/M-kontrollpunkter eller genomgår apoptos. Frånvaron av G1-kontrollpunkt i ESC:er gör det möjligt att ta bort celler med skadat DNA, och därmed undvika potentiella mutationer från felaktig DNA-reparation. I enlighet med denna idé är ESC:er överkänsliga mot DNA-skador för att minimera mutationer som överförs till nästa generation.
Foster
De primitiva stamcellerna som finns i fostrets organ kallas fosterstamceller.
Det finns två typer av fosterstamceller:
- Fosterstamceller kommer från själva fostrets vävnad och erhålls vanligtvis efter en abort . Dessa stamceller är inte odödliga men har en hög grad av delning och är multipotenta.
- Extraembryonala fetala stamceller kommer från extraembryonala membran och särskiljs i allmänhet inte från vuxna stamceller. Dessa stamceller förvärvas efter födseln, de är inte odödliga men har en hög nivå av celldelning och är pluripotenta.
Vuxen
Vuxna stamceller, även kallade somatiska (från grekiska σωματικóς, "av kroppen") stamceller, är stamceller som underhåller och reparerar vävnaden där de finns. De kan hittas hos barn, såväl som hos vuxna.
Det finns tre kända tillgängliga källor till autologa vuxna stamceller hos människor:
- Benmärg , som kräver extraktion genom skörd , vanligtvis från bäckenben via kirurgi.
- Fettvävnad (fettceller), som kräver extraktion genom fettsugning.
- Blod, som kräver extraktion genom aferes , där blod tas från givaren (liknande en bloddonation) och passerar genom en maskin som extraherar stamcellerna och återför andra delar av blodet till givaren.
Stamceller kan också tas från navelsträngsblod strax efter födseln. Av alla stamcellstyper innebär autolog skörd minst risk. Per definition erhålls autologa celler från ens egen kropp, precis som man kan ta sitt eget blod för elektiva kirurgiska ingrepp. [ citat behövs ]
Pluripotenta vuxna stamceller är sällsynta och i allmänhet små till antalet, men de kan hittas i navelsträngsblod och andra vävnader. Benmärg är en rik källa till vuxna stamceller, som har använts vid behandling av flera tillstånd, inklusive levercirros, kronisk extremitetsischemi och hjärtsvikt i slutstadiet. Mängden benmärgsstamceller minskar med åldern och är större hos män än hos kvinnor under reproduktiva år. Mycket vuxen stamcellsforskning hittills har syftat till att karakterisera deras styrka och självförnyelseförmåga. DNA-skador ackumuleras med åldern i både stamceller och de celler som utgör stamcellsmiljön. Denna ackumulering anses vara ansvarig, åtminstone delvis, för att öka stamcellsdysfunktion med åldrande (se DNA-skadeteori om åldrande) .
De flesta vuxna stamceller är härstamningsbegränsade ( multipotenta ) och hänvisas i allmänhet till deras vävnadsursprung ( mesenkymal stamcell , fetthärledd stamcell, endotelstamcell , tandmassastamcell , etc.). Muse-celler (multi-lineage differentierande stressbeständiga celler) är en nyligen upptäckt pluripotent stamcellstyp som finns i flera vuxna vävnader, inklusive fett, dermala fibroblaster och benmärg. Även om de är sällsynta kan museceller identifieras genom deras uttryck av SSEA-3 , en markör för odifferentierade stamceller, och allmänna mesenkymala stamcellsmarkörer såsom CD90, CD105 . När de utsätts för en cellsuspensionskultur kommer cellerna att generera kluster som liknar embryoidkroppar i morfologi såväl som genuttryck, inklusive kanoniska pluripotensmarkörer Oct4 , Sox2 och Nanog .
Vuxna stamcellsbehandlingar har framgångsrikt använts i många år för att behandla leukemi och relaterad ben-/blodcancer genom benmärgstransplantationer. Vuxna stamceller används också inom veterinärmedicin för att behandla senor och ligamentskador hos hästar.
Användningen av vuxna stamceller i forskning och terapi är inte lika kontroversiell som användningen av embryonala stamceller , eftersom produktionen av vuxna stamceller inte kräver att ett embryo förstörs . Dessutom, i fall där vuxna stamceller erhålls från den avsedda mottagaren (ett autograft ), är risken för avstötning i princip obefintlig. Följaktligen ges mer amerikansk statlig finansiering till vuxen stamcellsforskning.
Med den ökande efterfrågan på mänskliga vuxna stamceller för både forsknings- och kliniska ändamål (normalt krävs 1–5 miljoner celler per kg kroppsvikt per behandling) blir det av yttersta vikt att överbrygga klyftan mellan behovet av att expandera cellerna in vitro och förmågan att utnyttja de faktorer som ligger bakom replikativ åldrande. Vuxna stamceller är kända för att ha en begränsad livslängd in vitro och att gå in i replikativ åldrande nästan oupptäckt vid start in vitro-odling.
Fostervatten
Även kallade perinatala stamceller, dessa multipotenta stamceller finns i fostervatten och navelsträngsblod. Dessa stamceller är mycket aktiva, expanderar kraftigt utan matare och är inte tumörframkallande. Amniotiska stamceller är multipotenta och kan differentiera i celler av adipogena, osteogena, myogena, endoteliala, hepatiska och även neuronala linjer. Amnionstamceller är ett ämne för aktiv forskning.
Användning av stamceller från fostervatten övervinner de etiska invändningarna mot att använda mänskliga embryon som en källa till celler. Romersk-katolsk undervisning förbjuder användningen av embryonala stamceller i experiment; följaktligen Vatikanens tidning " Osservatore Romano " fostervattenstamceller för "medicinens framtid".
Det är möjligt att samla in fostervattenstamceller för donatorer eller för autolog användning: den första amerikanska fostervattenstamcellsbanken öppnades 2009 i Medford, MA, av Biocell Center Corporation och samarbetar med olika sjukhus och universitet över hela världen.
Inducerad pluripotent
Vuxna stamceller har begränsningar med sin styrka; till skillnad från embryonala stamceller (ESC) kan de inte differentiera sig till celler från alla tre könslagren . Som sådana anses de multipotenta .
Men omprogrammering möjliggör skapandet av pluripotenta celler, inducerade pluripotenta stamceller (iPSCs), från vuxna celler. Dessa är inte vuxna stamceller, utan somatiska celler (t.ex. epitelceller) omprogrammerade för att ge upphov till celler med pluripotent förmåga. Genom att använda genetisk omprogrammering med proteintranskriptionsfaktorer har pluripotenta stamceller med ESC-liknande förmåga härletts. Den första demonstrationen av inducerade pluripotenta stamceller genomfördes av Shinya Yamanaka och hans kollegor vid Kyoto University . De använde transkriptionsfaktorerna Oct3/4 , Sox2 , c-Myc och Klf4 för att omprogrammera musfibroblastceller till pluripotenta celler. Efterföljande arbete använde dessa faktorer för att inducera pluripotens i humana fibroblastceller. Junying Yu , James Thomson och deras kollegor vid University of Wisconsin–Madison använde en annan uppsättning faktorer, Oct4, Sox2, Nanog och Lin28, och utförde sina experiment med celler från mänsklig förhud . Men de kunde replikera Yamanakas upptäckt att inducering av pluripotens i mänskliga celler var möjligt.
Inducerade pluripotenta stamceller skiljer sig från embryonala stamceller. De delar många liknande egenskaper, såsom pluripotens och differentieringspotential, uttrycket av pluripotensgener , epigenetiska mönster, embryoidkropp och teratombildning och livsduglig chimärbildning , men det finns många skillnader inom dessa egenskaper. Kromatinet hos iPSC:er verkar vara mer "stängt" eller metylerat än det för ESC:er. På liknande sätt är genuttrycksmönstret mellan ESC:er och iPSC:er, eller till och med iPSC:er som kommer från olika ursprung. Det finns alltså frågor om "fullständigheten" av omprogrammering och det somatiska minnet av inducerade pluripotenta stamceller. Trots detta verkar inducering av somatiska celler att vara pluripotenta vara livsdugligt.
Som ett resultat av framgången med dessa experiment har Ian Wilmut , som hjälpte till att skapa det första klonade djuret Dolly the Sheep , meddelat att han kommer att överge somatisk cellkärnöverföring som en forskningsväg.
IPSCs har hjälpt medicinområdet avsevärt genom att hitta många sätt att bota sjukdomar. Sedan mänskliga IPSCc har gett fördelen att göra in vitro -modeller för att studera toxiner och patogenes.
Dessutom ger inducerade pluripotenta stamceller flera terapeutiska fördelar. Liksom ESC:er är de pluripotenta . De har alltså stor differentieringspotential; teoretiskt sett kunde de producera vilken cell som helst i människokroppen (om omprogrammering till pluripotens var "fullständig"). Dessutom, till skillnad från ESC, kan de potentiellt tillåta läkare att skapa en pluripotent stamcellslinje för varje enskild patient. Frysta blodprover kan användas som en värdefull källa för inducerade pluripotenta stamceller. Patientspecifika stamceller möjliggör screening för biverkningar före läkemedelsbehandling, samt minskad risk för transplantationsavstötning. Trots deras nuvarande begränsade användning terapeutiskt, har iPSCs stor potential för framtida användning inom medicinsk behandling och forskning.
Cellcykelkontroll
De nyckelfaktorer som styr cellcykeln reglerar också pluripotens . Således kan manipulation av relevanta gener upprätthålla pluripotens och omprogrammera somatiska celler till ett inducerat pluripotent tillstånd. Men omprogrammering av somatiska celler är ofta låg i effektivitet och anses vara stokastisk .
Med tanken att en snabbare cellcykel är en nyckelkomponent i pluripotens, kan omprogrammeringseffektiviteten förbättras. Metoder för att förbättra pluripotens genom manipulation av cellcykelregulatorer inkluderar: överuttryck av Cyclin D/Cdk4, fosforylering av Sox2 vid S39 och S253, överuttryck av Cyclin A och Cyclin E, nedbrytning av Rb och nedbrytning av medlemmar av Cip/Kip- familjen eller familjen Ink. Dessutom är omprogrammeringseffektiviteten korrelerad med antalet celldelningar som inträffade under den stokastiska fasen, vilket antyds av den växande ineffektiviteten av omprogrammering av äldre eller långsamma dykceller.
Härstamning
Härstamning är en viktig procedur för att analysera embryon under utveckling. Eftersom celllinjer visar förhållandet mellan celler vid varje delning. Detta hjälper till att analysera stamcellslinjer längs vägen vilket hjälper till att känna igen stamcellseffektivitet, livslängd och andra faktorer. Med tekniken för cellinje kan muterade gener analyseras i stamcellskloner som kan hjälpa till i genetiska vägar. Dessa vägar kan reglera hur stamcellen presterar.
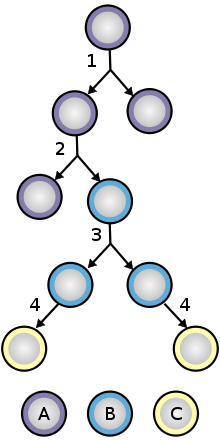
För att säkerställa självförnyelse genomgår stamceller två typer av celldelning (se Stamcellsdelning och differentieringsdiagram) . Symmetrisk delning ger upphov till två identiska dotterceller som båda är utrustade med stamcellsegenskaper. Asymmetrisk delning å andra sidan producerar endast en stamcell och en progenitorcell med begränsad självförnyelsepotential. Förfäder kan gå igenom flera omgångar av celldelning innan de differentieras terminalt till en mogen cell. Det är möjligt att den molekylära skillnaden mellan symmetriska och asymmetriska divisioner ligger i differentiell segregation av cellmembranproteiner (såsom receptorer ) mellan dottercellerna.
En alternativ teori är att stamceller förblir odifferentierade på grund av miljösignaler i deras specifika nisch . Stamceller differentierar sig när de lämnar den nischen eller inte längre tar emot dessa signaler. Studier i Drosophila germarium har identifierat signalerna decapentaplegi och adherens korsningar som förhindrar germarium stamceller från att differentiera.
Terapier
Stamcellsterapi är användningen av stamceller för att behandla eller förebygga en sjukdom eller ett tillstånd. Benmärgstransplantation är en form av stamcellsterapi som har använts i många år eftersom den har visat sig vara effektiv i kliniska prövningar.
Stamcellsimplantation kan hjälpa till att stärka hjärtats vänstra ventrikel, samt att behålla hjärtvävnaden till patienter som har drabbats av hjärtinfarkt tidigare.
Fördelar
Stamcellsbehandlingar kan sänka symtomen på sjukdomen eller tillståndet som behandlas. Minskning av symtomen kan göra det möjligt för patienter att minska läkemedelsintaget av sjukdomen eller tillståndet. Stamcellsbehandling kan också ge kunskap för samhället för att främja stamcellsförståelse och framtida behandlingar. Läkarnas tro skulle vara att inte göra någon skada, och stamceller gör det enklare än någonsin tidigare. Kirurgiska processer genom sin karaktär är skadliga. Vävnad måste släppas för att nå ett framgångsrikt resultat. Man kan förebygga farorna med kirurgiska ingrepp med stamceller. Dessutom finns det en risk för sjukdom, och om proceduren misslyckas kan ytterligare operation krävas. Risker förknippade med anestesi kan också elimineras med stamceller. Utöver det har stamceller skördats från patientens kropp och omplacerats där de eftersöks. Eftersom de kommer från patientens egen kropp kallas detta för en autolog behandling. Autologa medel anses vara de säkraste eftersom sannolikheten för avstötning av donatorsubstans sannolikt är noll.
Nackdelar
Stamcellsbehandlingar kan kräva immunsuppression på grund av ett krav på strålning före transplantationen för att ta bort personens tidigare celler, eller på grund av att patientens immunsystem kan rikta in sig på stamcellerna. Ett sätt att undvika den andra möjligheten är att använda stamceller från samma patient som behandlas.
Pluripotens i vissa stamceller kan också göra det svårt att få fram en specifik celltyp. Det är också svårt att få exakt den celltyp som behövs, eftersom inte alla celler i en population differentierar sig enhetligt. Odifferentierade celler kan skapa andra vävnader än önskade typer.
Vissa stamceller bildar tumörer efter transplantation; pluripotens är kopplad till tumörbildning, särskilt i embryonala stamceller, fetala stamceller, inducerade pluripotenta stamceller. Fosterstamceller bildar tumörer trots multipotens.
Etiska farhågor tas också upp när det gäller praxis att använda eller forska i embryonala stamceller. Att skörda celler från blastocysten resulterar i att blastocysten dör. Oron är om blastocysten ska betraktas som ett människoliv eller inte. Debatten i denna fråga är huvudsakligen en filosofisk, inte en vetenskaplig.
Stamcellsturism
Stamcellsturism är den del av den medicinska turistnäringen där patienter reser för att få stamcellsprocedurer.
USA har haft en explosion av "stamcellskliniker". Stamcellsprocedurer är mycket lönsamma för kliniker. Reklamen låter auktoritativ men effektiviteten och säkerheten av procedurerna är obevisad. Patienter upplever ibland komplikationer, såsom spinaltumörer och dödsfall. Den höga kostnaden kan också leda till ekonomiska problem. Enligt forskare finns det ett behov av att utbilda allmänheten, patienter och läkare om denna fråga.
Enligt International Society for Stem Cell Research , den största akademiska organisationen som förespråkar stamcellsforskning, är stamcellsterapier under utveckling och kan ännu inte sägas vara bevisade. Läkare bör informera patienter om att kliniska prövningar fortsätter att undersöka om dessa behandlingar är säkra och effektiva men att oetiska kliniker visar att de är bevisade.
Forskning
Några av de grundläggande patenten som täcker mänskliga embryonala stamceller ägs av Wisconsin Alumni Research Foundation (WARF) – de är patenten 5 843 780, 6 200 806 och 7 029 913 uppfunna av James A. Thomson . WARF upprätthåller inte dessa patent mot akademiska forskare, men upprätthåller dem mot företag.
2006 lämnades en begäran till US Patent and Trademark Office (USPTO) om att ompröva de tre patenten av Public Patent Foundation på uppdrag av dess klient, den ideella patent-watchdog-gruppen Consumer Watchdog (tidigare Foundation for Skattebetalare och konsumenträttigheter). I omprövningsprocessen, som involverar flera diskussionsrundor mellan USPTO och parterna, kom USPTO initialt överens med Consumer Watchdog och avvisade alla krav i alla tre patenten, men som svar ändrade WARF kraven för alla tre patenten till att göra dem mer snävare, och 2008 fann USPTO att de ändrade kraven i alla tre patenten var patenterbara. Beslutet om ett av patenten (7 029 913) var överklagbart, medan besluten om de två andra inte var det. Consumer Watchdog överklagade beviljandet av '913-patentet till USPTO:s Board of Patent Appeals and Interferences (BPAI) som beviljade överklagandet, och 2010 beslutade BPAI att de ändrade anspråken i '913-patentet inte var patenterbara. WARF kunde dock återuppta åtalet i ärendet och gjorde det, och ändrade kraven i patentet '913 igen för att göra dem mer snävare, och i januari 2013 tillåts de ändrade anspråken.
I juli 2013 meddelade Consumer Watchdog att de skulle överklaga beslutet att godkänna patentkraven '913 till US Court of Appeals for the Federal Circuit (CAFC), den federala appellationsdomstolen som prövar patentärenden. Vid en utfrågning i december 2013 tog CAFC upp frågan om Consumer Watchdog hade rättslig ställning att överklaga; ärendet kunde inte fortsätta förrän problemet var löst.
Utredningar
Sjukdomar och tillstånd där stamcellsbehandling undersöks inkluderar:
- Diabetes
- Androgen alopeci och håravfall
- Reumatism
- Parkinsons sjukdom
- Alzheimers sjukdom
- Artros
- Stroke och traumatisk hjärnskada reparation
- Inlärningssvårigheter på grund av medfödd störning
- Reparation av ryggmärgsskada
- Hjärtinfarkt
- Anticancerbehandlingar _ _
- Skallighet vändning
- Ersätt saknade tänder
- Reparera hörseln
- Återställ synen och reparera skador på hornhinnan
- Amyotrofisk lateral skleros
- Crohns sjukdom
- Sårläkning
- Manlig infertilitet på grund av frånvaro av spermatogonial stamceller. I nyare studier har forskare hittat ett sätt att lösa detta problem genom att omprogrammera en cell och förvandla den till en sperma. Andra studier har bevisat återställandet av spermatogenes genom att introducera mänskliga iPSC-celler i möss testiklar. Detta kan innebära slutet på azoospermi .
- Kvinnlig infertilitet : oocyter gjorda av embryonala stamceller. Forskare har hittat äggstocksstamcellerna, en sällsynt typ av celler (0,014%) som finns i äggstocken. De kan användas som behandling inte bara för infertilitet, utan också för för tidig ovarieinsufficiens.
- Kritisk extremitetsischemi
Forskning pågår för att utveckla olika källor för stamceller och för att tillämpa stamcellsbehandlingar för neurodegenerativa sjukdomar och tillstånd, diabetes , hjärtsjukdomar och andra tillstånd. Forskning pågår också för att generera organoider med stamceller, vilket skulle möjliggöra ytterligare förståelse av mänsklig utveckling, organogenes och modellering av mänskliga sjukdomar.
Under senare år, med forskarnas förmåga att isolera och odla embryonala stamceller , och med forskarnas växande förmåga att skapa stamceller med hjälp av somatisk cellkärnöverföring och tekniker för att skapa inducerade pluripotenta stamceller , har kontroverser smugit sig in, både relaterade till abortpolitik och mänsklig kloning . [ citat behövs ]
Levertoxicitet och läkemedelsinducerad leverskada står för ett stort antal misslyckanden för nya läkemedel under utveckling och tillbakadragande från marknaden, vilket understryker behovet av screeninganalyser såsom stamcellshärledda hepatocytliknande celler, som kan upptäcka toxicitet tidigt i läkemedlet . utvecklingsprocessen .
Anmärkningsvärda studier
I augusti 2021 publicerade forskare vid Princess Margaret Cancer Center vid University Health Network sin upptäckt av en vilomekanism i nyckelstamceller som kan hjälpa till att utveckla cancerbehandlingar i framtiden.
Se även
Vidare läsning
- Manzo, Carlo; Torreno-Pina, Juan A.; Massignan, Pietro; Lapeyre, Gerald J.; Lewenstein, Maciej; Garcia Parajo, Maria F. (25 februari 2015). "Svag ergodicitetsbrott av receptorrörelse i levande celler som härrör från slumpmässig diffusivitet". Fysisk granskning X . 5 (1): 011021. arXiv : 1407.2552 . Bibcode : 2015PhRvX...5a1021M . doi : 10.1103/PhysRevX.5.011021 . S2CID 73582473 .
externa länkar
|
Biblioteksresurser om stamceller |