Klavulansyra
 | |
 | |
| Kliniska data | |
|---|---|
| Uttal | / ˌ k l æ v j ʊ ˈ l æ n ɪ k / |
| AHFS / Drugs.com | Internationella läkemedelsnamn |
Graviditetskategori _ |
|
Administreringsvägar _ |
Oral, IV |
| ATC-kod |
|
| Rättslig status | |
| Rättslig status |
|
| Farmakokinetiska data | |
| Biotillgänglighet | "Väl absorberad" |
| Ämnesomsättning | Lever (omfattande) |
| Eliminationshalveringstid _ | 1 timme |
| Exkretion | Renal (30–40 %) |
| Identifierare | |
| |
| CAS-nummer | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| CompTox Dashboard ( EPA ) | |
| ECHA InfoCard | 100.055.500 |
| Kemiska och fysikaliska data | |
| Formel | C 8 H 9 N O 5 |
| Molar massa | 199,162 g·mol -1 |
| 3D-modell ( JSmol ) | |
| |
| |
Klavulansyra är ett β-laktamläkemedel som fungerar som en mekanismbaserad β-laktamasinhibitor . Även om det inte är effektivt som ett antibiotikum , i kombination med penicillin -gruppantibiotika, kan det övervinna antibiotikaresistens hos bakterier som utsöndrar β-laktamas , som annars inaktiverar de flesta penicilliner.
I de vanligaste preparaten kombineras kaliumklavulanat (klavulansyra som ett salt av kalium) med:
- amoxicillin ( co-amoxiclav , handelsnamn Augmentin, Tyclav, Clavamox ( veterinär ), Synulox ( veterinär ) och andra)
- ticarcillin ( co-ticarclav , handelsnamn Timentin)
Klavulansyra patenterades 1974.
Medicinsk användning
Amoxicillin-klavulansyra är en förstahandsbehandling för många typer av infektioner, inklusive sinusinfektioner och urinvägsinfektioner, inklusive pyelonefrit . Detta beror delvis på dess effektivitet mot gramnegativa bakterier som tenderar att vara svårare att kontrollera än grampositiva bakterier med kemoterapeutiska antibiotika.
Skadliga effekter
Användning av klavulansyra med penicilliner har associerats med en ökad förekomst av kolestatisk gulsot och akut hepatit under behandlingen eller kort efter. Den associerade gulsot är vanligtvis självbegränsande och mycket sällan dödlig.
UK Committee on Safety of Medicine (CSM) rekommenderar att behandlingar som amoxicillin/klavulansyra-preparat reserveras för bakterieinfektioner som sannolikt orsakas av amoxicillinresistenta β-laktamasproducerande stammar, och att behandlingen normalt inte bör överstiga 14 dagar .
Allergiska reaktioner har rapporterats.
Källor
Namnet kommer från stammar av Streptomyces clavuligerus , som producerar klavulansyra.
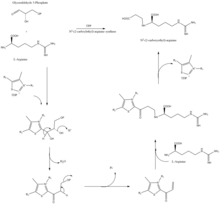
Biosyntes
Den β-laktamliknande strukturen hos klavulansyra ser strukturellt ut som penicillin , men biosyntesen av denna molekyl involverar en annan biokemisk väg. Klavulansyra produceras av bakterien Streptomyces clavuligerus med glyceraldehyd-3-fosfat och L -arginin som utgångsmaterial. Även om var och en av intermediärerna i vägen är kända, är den exakta mekanismen för alla enzymatiska reaktioner inte helt klarlagda. Processen involverar huvudsakligen 3 enzymer: klavaminatsyntas N2- (2-karboxietyl)-L-arginin , β-laktamsyntetas och (CEA) syntas . Klavaminatsyntas är ett icke-hemoxygenas som är beroende av järn och α-ketoglutarat och kodas av orf5 i klavulansyragenklustret . Den specifika mekanismen för hur detta enzym fungerar är inte helt klarlagd, men detta enzym reglerar 3 steg i den övergripande syntesen av klavulansyra. Alla tre stegen inträffar i samma region av det katalytiska, järnhaltiga reaktionscentret, men sker inte i sekvens och påverkar olika områden av klavulansyrastrukturen.
β-laktamsyntetas är ett 54,5 kDa protein som kodas av orf3 i klavulansyragenklustret och visar likhet med asparaginsyntas – klass B-enzymer. Den exakta mekanismen för hur detta enzym fungerar för att syntetisera β-laktamen är inte bevisad, men tros ske i samordning med ett CEA-syntas och ATP .
CEA-syntas är ett 60,9 kDA-protein och är den första genen som finns i klavulansyrabiosyntesgenklustret, kodat av orf2 i klavulansyragenklustret. Den specifika mekanismen för hur detta enzym fungerar är fortfarande under utredning; det är dock känt att detta enzym har förmågan att koppla ihop glyceraldehyd-3-fosfat med L-arginin i närvaro av tiamindifosfat (TDP eller tiaminpyrofosfat ), vilket är det första steget i klavulansyrabiosyntesen.
Historia
Klavulansyra upptäcktes runt 1974-75 av brittiska forskare som arbetade på läkemedelsföretaget Beecham från bakterien Streptomyces clavuligerus . Efter flera försök ansökte Beecham slutligen om amerikanskt patentskydd för läkemedlet 1981, och de amerikanska patenten 4 525 352, 4 529 720 och 4 560 552 beviljades 1985.
Klavulansyra har försumbar inneboende antimikrobiell aktivitet, trots att den delar β-laktamringen som är karakteristisk för β-laktamantibiotika . Likheten i kemisk struktur tillåter dock att molekylen interagerar med enzymet β-laktamas som utsöndras av vissa bakterier för att ge resistens mot β-laktamantibiotika.
Klavulansyra är en självmordshämmare som binder kovalent till en serinrest på det aktiva stället för β-laktamas. Detta omstrukturerar klavulansyramolekylen, vilket skapar en mycket mer reaktiv art som attackerar en annan aminosyra på det aktiva stället, permanent inaktiverar den och därmed inaktiverar enzymet.
Denna hämning återställer den antimikrobiella aktiviteten hos β-laktamantibiotika mot laktamasutsöndrande resistenta bakterier. Trots detta har det uppstått några bakteriestammar som är resistenta även mot sådana kombinationer.