Pleckstrin homologidomän
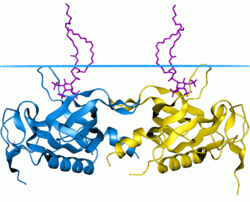 PH-domän för tyrosin-proteinkinas BTK-
| |||||||||
| identifierare | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Symbol | PH | ||||||||
| Pfam | PF00169 | ||||||||
| Pfam klan | CL0266 | ||||||||
| InterPro | IPR001849 | ||||||||
| SMART | PH | ||||||||
| PROSITE | PDOC50003 | ||||||||
| SCOP2 | 1dyn / SCOPe / SUPFAM | ||||||||
| OPM superfamilj | 49 | ||||||||
| OPM-protein | 1 pls | ||||||||
| CDD | cd00821 | ||||||||
| |||||||||
Pleckstrin homologidomän ( PH-domän ) eller ( PHIP ) är en proteindomän med cirka 120 aminosyror som förekommer i ett brett spektrum av proteiner involverade i intracellulär signalering eller som beståndsdelar i cytoskelettet .
Denna domän kan binda fosfatidylinositollipider i biologiska membran (såsom fosfatidylinositol (3,4,5)-trisfosfat och fosfatidylinositol (4,5)-bisfosfat ), och proteiner såsom βγ-subenheterna av heterotrimera proteiner, proteinkinaser C och protein G. . Genom dessa interaktioner spelar PH-domäner en roll för att rekrytera proteiner till olika membran , och riktar dem på så sätt till lämpliga cellulära fack eller gör det möjligt för dem att interagera med andra komponenter i signaltransduktionsvägarna .
Lipidbindningsspecificitet
Individuella PH-domäner har specificiteter för fosfoinositider som är fosforylerade vid olika ställen inom inositolringen , t.ex. binder vissa fosfatidylinositol (4,5)-bisfosfat men inte fosfatidylinositol (3,4,5)-trisfosfat eller fosfatidylinositol (3,4,5)-fosfatidylinositol (3,4,5 ) medan andra kan ha den erforderliga affiniteten. Detta är viktigt eftersom det gör rekryteringen av proteiner som innehåller olika PH-domäner känsliga för aktiviteten hos enzymer som antingen fosforylerar eller defosforylerar dessa ställen på inositolringen, såsom fosfoinositid 3- kinas respektive PTEN . Således utövar sådana enzymer en del av sin effekt på cellfunktionen genom att modulera lokaliseringen av nedströms signalproteiner som har PH-domäner som kan binda deras fosfolipidprodukter.
Strukturera
3D-strukturen för flera PH-domäner har bestämts. Alla kända fall har en gemensam struktur som består av två vinkelräta antiparallella beta-ark, följt av en C-terminal amfipatisk helix. Slingorna som förbinder beta-strängarna skiljer sig mycket i längd, vilket gör PH-domänen relativt svår att upptäcka samtidigt som den tillhandahåller källan till domänens specificitet. Den enda konserverade resten bland PH-domäner är en enda tryptofan belägen inom alfahelixen som tjänar till att kärna kärnan i domänen.
Proteiner som innehåller PH-domän
PH-domäner kan hittas i många olika proteiner, såsom OSBP eller ARF . Rekryteringen till Golgi-apparaten är i detta fall beroende av både PtdIns och ARF. Ett stort antal PH-domäner har dålig affinitet för fosfoinositider och antas fungera som proteinbindande domäner. En genomomfattande titt i Saccharomyces cerevisiae visade att de flesta av de 33 jäst-PH-domänerna verkligen är promiskuösa när det gäller att binda till fosfoinositider, medan endast en (Num1-PH) uppträdde mycket specifikt. Proteiner som rapporterats innehålla PH-domäner tillhör följande familjer:
- Pleckstrin , proteinet där denna domän först upptäcktes, är huvudsubstratet för proteinkinas C i blodplättar. Pleckstrin innehåller två PH-domäner. ARAP-proteiner innehåller fem PH-domäner.
- Serin/treonin-specifika proteinkinaser såsom Akt/Rac-familjen, proteinkinas D1 och den trypanosomala NrkA-familjen.
- Icke-receptortyrosinkinaser som tillhör underfamiljen Btk/Itk/Tec.
- Insulinreceptorsubstrat 1 ( IRS-1 ).
- Regulatorer av små G-proteiner : 64 RhoGEFs av den Dbl-liknande familjen., och flera GTPas-aktiverande proteiner som ABR-, BCR- eller ARAP-proteiner.
- Cytoskelettproteiner såsom dynamin (se InterPro : IPR001401 ), Caenorhabditis elegans kinesinliknande protein unc-104 (se InterPro : IPR001752 ), spektrin beta-kedja, syntropin (2 PH-domäner) och S. cerevisiae nukleärt migrationsprotein NUM.
- Oxysterolbindande proteiner OSBP, S. cerevisiae OSH1 och YHR073w.
- Ceramidkinas , ett lipidkinas som fosforylerar ceramider till ceramid-1-fosfat.
- G-proteinreceptorkinaser (GRK) från GRK2-underfamiljen (beta-adrenerga receptorkinaser): GRK2 och GRK3 .
Underfamiljer
Exempel
Humana gener som kodar för proteiner som innehåller denna domän inkluderar:
- ABR, ADRBK1 , ADRBK2 , AFAP, AFAP1 , AFAP1L1, AFAP1L2, AKAP13 , AKT1 , AKT2 , AKT3 , ANLN , APBB1IP , APPL1 , APPL2 , ARHGAP10 , ARHGAPHAPHAP12 , ARHGAPHAPGAR12 , ARHGAP23, ARHGAP24, ARHGAP25 , ARHGAP26 , ARHGAP27 , ARHGAP9 , ARHGEF16, ARHGEF18, ARHGEF19, ARHGEF2 , ARHGEF3 , ARHGEF4 , ARHGEF5 , ARHGEF6 , ARHGEF7 , ARHGEF9 , ASEF2,
- BMX , BTK ,
- C20orf42 , C9orf100, CADPS , CADPS2 , CDC42BPA , CDC42BPB, CDC42BPG, CENTA1 , CENTA2 , CENTB1 , CENTB2 , CENTB5, CENTD1 , CENTD2 , CENTD3 , CENTG 3 , CENTG 3 , , CNKSR1 , CNKSR2 , COL4A3BP , CTGLF1 , CTGLF2, CTGLF3, * CTGLF4, CTGLF5, CTGLF6,
- DAB2IP , DAPP1 , DDEF1 , DDEF2 , DDEFL1, DEF6 , DEPDC2, DGKD , DGKH, DGKK, DNM1 , DNM2 , DNM3 , DOCK10 , DOCK11, DOCK9 , DOK1 DCU, DOK, DCU, DOK, DCU , DOK , DCU , DOK , DCU , DOK, DCU, D 2,
- EXOC8 ,
- FAM109A, FAM109B, FARP1 , FARP2 , FGD1 , FGD2 , FGD3 , FGD4 , FGD5, FGD6,
- GAB1 , GAB2 , GAB3 , GAB4, GRB10 , GRB14 , GRB7 ,
- IRS1 , IRS2 , IRS4 , ITK , ITSN1 , ITSN2 ,
- KALRN , KIF1A , KIF1B , KIF1Bbeta,
- MCF2 , MCF2L , MCF2L2, MRIP , MYO10 ,
- NET1 , NGEF ,
- OBPH1, OBSCN , OPHN1 , OSBP , OSBP2 , OSBPL10, OSBPL11 , OSBPL3 , OSBPL5 , OSBPL6, OSBPL7, OSBPL8 , OSBPL9 ,
- PHLDA2 , PHLDA3, PHLDB1 , PHLDB2 , PHLPP , PIP3-E, PLCD1 , PLCD4 , PLCG1 , PLCG2 , PLCH1 , PLCH2, PLCL1, PLCL2, PLD1, PLD2, PLEK , PLEKHA2 , PLEKHA2 , PLEKHA2, PLEKHA 4 , PLEKHA5 , PLEKHA6 , PLEKHA7 , PLEKHA8 , PLEKHB1, PLEKHB2 , PLEKHC1 , PLEKHF1, PLEKHF2 , PLEKHG1, PLEKHG2 , PLEKHG3 , PLEKHG4 , PLEKHG5 , PLEKHHG6 , PLEKHHG1, PLEKHHG1, PLEKHH PLEKHK1, PLEKHM1 , PLEKHM2 , PLEKHO1 , PLEKHQ1 , PREX1 , PRKCN , PRKD1 , PRKD2 , PRKD3 , PSCD1 , PSCD2 , PSCD3 , PSCD4 , PSD, PSD2 , PSD3 , PSD4, RALGPS1 , RALGPS2, RAPH1 ,
- RASA1 , RASA2, RASA3 , RASA4 , RASAL1, RASGRF1 , RGNEF, ROCK1 , ROCK2 , RTKN ,
- SBF1 , SBF2 , SCAP2, SGEF , SH2B , SH2B1 , SH2B2 , SH2B3 , SH3BP2 , SKAP1 , SKAP2 , SNTA1 , SNTB1 , SNTB2 , SOS1 , SOS2 , SPATA43 , SPATA1 , SPTBN , SPATA1 , SPTBN , SPTBN , SP TBN5 , STAP1 , SWAP70 , SYNGAP1 ,
- TBC1D2, TEC , TIAM1 , TRIO , TRIOBP , TYL,
- URP1, URP2,
- VAV1 , VAV2 , VAV3 , VEPH1
Se även
- Pleckstrin
- Den icke-relaterade FYVE-domänen binder fosfatidylinositol 3-fosfat och har hittats i över 60 proteiner.
- GRAM -domänen är en strukturellt relaterad proteindomän.
externa länkar
- Nash Lab Protein Interaction Domains - PH-domänbeskrivning [ permanent död länk ]
- UMich Orientering av proteiner i membranfamiljer /superfamilj-51 - Beräknade orienteringar av PH-domäner i membran