PLCG1
| PLCG1 | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identifierare | |||||||||||||||||||||||||||||||||||||||||||||||
| , NCKAP3, PLC-II, PLC1, PLC148, PLCgamma1, fosfolipas C gamma 1 | |||||||||||||||||||||||||||||||||||||||||||||||
| Externa ID :n | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Fosfolipas C, gamma 1, även känt som PLCG1 och PLCgamma1 , är ett protein som hos människor är involverat i celltillväxt , migration , apoptos och proliferation . Den kodas av PLCG1 -genen och är en del av PLC- superfamiljen.
Fungera
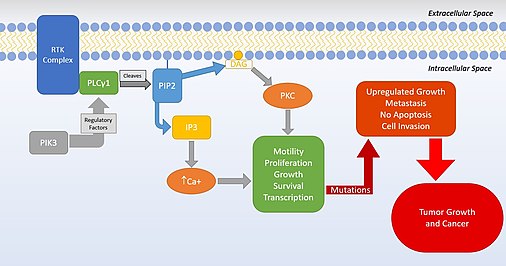
PLCγ1 är en celltillväxtfaktor från PLC- superfamiljen. PLCγ1 används under celltillväxten och i en cellmigration och apoptos, som alla är vitala cellprocesser som, om de störs av mutationer, kan orsaka cancerceller att bildas i kroppen. Mutationer i detta protein visar en ökning av problem i celler angående reglering av proliferation och deras cellsignalering. PLCγ1-roller är också involverade i neuronal aktintillväxt, kalciumsignalering och hjärnans utveckling. Det är starkt reglerat av flera faktorer, såsom PIK3 , AMPK och FAK . Det är en del av PIP3- vägen och leder till och ökning av kalcium i cellerna. I neuronala celler är PLCγ1 starkt involverad i aktincytoskelettorganisation och synaptisk plasticitet . Den grundläggande PLCγ1-vägen, som forskarna för närvarande förstår den, ses nedan.
Proteinet som kodas av denna gen katalyserar bildningen av inositol 1,4,5-trisfosfat (IP3) och diacylglycerol (DAG) från fosfatidylinositol 4,5-bisfosfat . Denna reaktion använder kalcium som en kofaktor och spelar en viktig roll i den intracellulära transduktionen av receptormedierade tyrosinkinasaktivatorer . Till exempel, när det aktiveras av SRC , orsakar det kodade proteinet Ras- guanin-nukleotidutbytesfaktorn RASGRP1 att translokera till Golgi-apparaten , där den aktiverar Ras. Detta protein har också visat sig vara ett huvudsubstrat för heparinbindande tillväxtfaktor 1 (sur fibroblasttillväxtfaktor)-aktiverat tyrosinkinas. Receptorproteinet tyrosinfosfatas PTPmu ( PTPRM ) kan defosforylera PLCG1. Två transkriptvarianter som kodar för olika isoformer har hittats för denna gen.
Gemensamt för alla PLC-isozymer består PLCG1 av en N-terminal PH-domän, som translokerar PLC till plasmamembranet och binder PIP3; fyra EF-händer; en X- och Y-katalytisk region innefattande TIM-cylindern; och en C-terminal C2-domän. Specifik för PLCG-isozymer är en stor separation mellan X- och Y-domänerna som består av en delad PH-domän, tandem SH2-domäner och en SH3-domän. SH2-domänerna binder fosforylerade tyrosinrester på målproteiner via deras FLVR-sekvensmotiv, vilket aktiverar den katalytiska funktionen hos PLCg; och SH3-domänen binder till prolinrika sekvenser på målproteinet.
PLCG1 kan aktiveras av receptortyrosinkinaser (RTK) och icke-receptortyrosinkinaser . Till exempel, när de aktiveras, är fibroblasttillväxtfaktorreceptor 1 och epidermal tillväxtfaktorreceptor RTK som har fosforylerade tyrosiner, som tillhandahåller dockningsställen för PLCG1 SH2-domäner . De aktiverade RTK:erna fosfoylerar PLCG1 vid tyrosiner belägna i position 472, 771, 775, 783 och 1254. Icke-receptortyrosinkinaser interagerar med PLCG1 i stora komplex vid plasmamembranet. Till exempel, i T-celler, fosforylerar Lck och Fyn ( Src-familjen kinaser ) immunoreceptortyrosinbaserade aktiveringsmotiv (ITAM) på T-cellsantigenreceptorn (TCR). De fosforylerade ITAMs rekryterar ZAP-70, som fosforylerar tyrosiner i LAT och SLP-76. PLCg1 binder till LAT genom sin n-terminala SH2-domän och till SLP-76 via sin SH3-domän .
Har visat sig interagera med CISH vilket negativt reglerar det genom att rikta det mot nedbrytning. Borttagningen av Cish i effektor-T-celler har visat sig förstärka TCR-signalering och efterföljande effektorcytokinfrisättning, proliferation och överlevnad. Den adoptiva överföringen av tumörspecifika effektor-T-celler som slogs ut eller slogs ner för CISH resulterade i en signifikant ökning av funktionell aviditet och långvarig tumörimmunitet. Det finns inga förändringar i aktivitet eller fosforylering av Cishs påstådda mål, STAT5 , vare sig i närvaro eller frånvaro av Cish.
In vitro- studier har visat tecken på att PLCγ1 har många cellmotilitetsfunktioner, men in vivo har inte kunnat visa en fysiologisk roll för PLCγ1. Medan PLCγ1 är väldokumenterat och lätt att hitta i kroppen, har tydliga samband och roller för PLCγ1 varit svåra att hitta i in vivo- studier. Trots detta finns det fortfarande möjlighet att hitta kopplingar mellan nivåer av PLCγ1 och cancerpatienters överlevnadsförmåga.
Cancer
Även om det finns ett starkt samband mellan PLCγ1 och tumörtillväxt/cancerprogression, är den mesta forskningen i tidiga skeden. Cancer är också en mycket unik sjukdom eftersom varje patient har olika behov. Informationen här ska inte användas som behandling utan istället som ett sätt att bättre förstå cancerutvecklingen.
Mutationer i PLCγ1 kan leda till cancercellsproliferation och hämning kan leda till tumörtillväxt. PLCγ1 är involverat i cellproliferation, och mutationer gör att det överuttrycks och hjälper tumörcellers progression. Denna aspekt av PLCγ1 hjälper också cancermigrering och metastasering bort från de ursprungliga tumörcellerna. Det finns också en koppling mellan PLCγ1 och PDK , PDK-PLCγ1-vägen, som är en viktig del av cancercellsinvasion .
Hämningen av PLCγ1 är kopplad till en minskning av tumörtillväxt och metastaser. PLCγ1 fungerar som en viktig del för att stoppa apoptos i celler, och genom att hämma PLCγ1 tillåter kroppen bättre programmerad celldöd och undvikande av tumörer. Den huvudsakliga rollen som hittas för PLCγ1 är celltillväxt, och denna roll i specifik är anledningen till att det blir allt vanligare att studera för läkemedel mot cancer. Vävnadsprover från cancerpatienter PLCγ1-nivåerna är inte förhöjda, men regulatoriska faktorer för dessa proteiner sänks och att amplifiering av PLCγ1 är extremt hög. De regulatoriska proteinerna som stoppar PLCγ1 har stängts av av cellen, vilket innebär att även om det inte finns någon ökning av det fysiska proteinet PLCγ1 finns det en ökning av hur mycket arbete den gör - ingenting hindrar den från att överarbeta sig själv. Studier visade också att tillsats av nya reglerande till celler in vitro hjälpte till att minska tidigare amplifierad PLCγ1. Denna information har uppmuntrat PLCγ1 att bli ett mål mot cancerläkemedel trots de problem som kommer med inriktning på intermembranproteiner.
Interaktioner
PLCG1 har visat sig interagera med:
- BAG3 ,
- CD117 ,
- CD31 ,
- Cbl-genen
- CISH
- Epidermal tillväxtfaktorreceptor ,
- Eukaryotisk translationsförlängningsfaktor 1 alfa 1 ,
- FLT1 ,
- GAB1 ,
- GIT1 ,
- Grb2 ,
- HER2/neu ,
- IRS2 ,
- ITK ,
- KHDRBS1 ,
- Länkare av aktiverade T-celler ,
- Lymfocyt cytosoliskt protein 2 ,
- PDGFRA ,
- PLD2 ,
- RHOA ,
- SOS1 ,
- TUB ,
- TrkA ,
- TrkB ,
- VAV1 och
- Wiskott-Aldrichs syndrom protein .