Lenacapavir
 | |
| Kliniska data | |
|---|---|
| Handelsnamn | Sunlenca |
| Andra namn | GS-CA1, GS-6207 |
| Licensdata |
|
Administreringsvägar _ |
Genom munnen , subkutant |
| Läkemedelsklass | Kapsidhämmare |
| ATC-kod | |
| Rättslig status | |
| Rättslig status | |
| Identifierare | |
| |
| CAS-nummer | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| PDB-ligand | |
| Kemiska och fysikaliska data | |
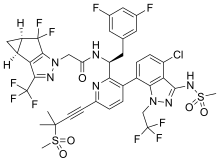
| Formel | C 39 H 32 Cl F 10 N 7 O 5 S 2 |
| Molar massa | 968,28 g-mol -1 |
| 3D-modell ( JSmol ) | |
| |
| |
Lenacapavir , som säljs under varumärket Sunlenca , är ett antiretroviralt läkemedel som används för att behandla HIV/AIDS . Det tas genom munnen eller genom subkutan injektion .
De vanligaste biverkningarna inkluderar reaktioner på injektionsstället och illamående.
Lenacapavir godkändes för medicinsk användning i EU i augusti 2022, i Kanada i november 2022 och i USA i december 2022.
Lenacapavir är det första i en ny klass av läkemedel som kallas kapsidhämmare som är FDA-godkända för behandling av HIV/AIDS. Lenacapavir verkar genom att blockera HIV-1-virusets proteinskal (kapsiden) och stör därigenom flera viktiga steg i den virala livscykeln. US Food and Drug Administration (FDA) anser att det är en förstklassig medicin.
Medicinsk användning
Lenacapavir, i kombination med andra antiretrovirala medel, är indicerat för behandling av HIV/AIDS.
Historia
Lenacapavir utvecklas av Gilead Sciences .
Från och med 2021 är den i fas II/III kliniska prövningar. Det undersöks som en behandling för HIV-patienter infekterade med multiresistent virus och som en två gånger årligen injicerbar för pre-exponeringsprofylax (PrEP).
Säkerheten och effekten av lenacapavir fastställdes genom en klinisk multicenterstudie med 72 deltagare vars HIV-infektioner var resistenta mot flera klasser av HIV-läkemedel. Dessa deltagare var tvungna att ha höga nivåer av virus i blodet trots att de fick antiretrovirala läkemedel. Deltagarna skrevs in i en av två studiegrupper. En grupp randomiserades till att få antingen lenacapavir eller placebo på ett dubbelblindt sätt, och den andra gruppen fick öppet lenacapavir. Det primära måttet på effekt var andelen deltagare i den randomiserade studiegruppen som uppnådde en viss nivå av minskning av virus under de första 14 dagarna jämfört med baslinjen.
US Food and Drug Administration (FDA) beviljade ansökan om lenacapavir prioriterad granskning , snabbspår och beteckningar för banbrytande terapi . FDA beviljade godkännandet av Sunlenca till Gilead Sciences.
Samhälle och kultur
Rättslig status
Den 23 juni 2022 antog kommittén för humanläkemedel (CHMP) vid Europeiska läkemedelsmyndigheten (EMA) ett positivt yttrande, som rekommenderade beviljande av ett godkännande för försäljning av läkemedlet Sunlenca, avsett för behandling av vuxna med multidrug - resistent humant immunbristvirus typ 1 (HIV-1) infektion. Sökanden till detta läkemedel är Gilead Sciences Ireland UC.
Lenacapavir godkändes för medicinsk användning i EU i augusti 2022, i Kanada i november 2022 och i USA i december 2022.
externa länkar
- "Lenacapavir" . Läkemedelsinformationsportal . US National Library of Medicine.
- "Lenacapavirnatrium" . Läkemedelsinformationsportal . US National Library of Medicine.
- "Lenacapavir" . Klinisk info . National Institutes of Health.