Strychnin total syntes
Strychnin total syntes i kemi beskriver den totala syntesen av den komplexa biomolekylen stryknin . Den första rapporterade metoden av gruppen Robert Burns Woodward 1954 anses vara en klassiker inom detta forskningsfält.
På den tiden utgjorde det den naturliga slutsatsen till en utarbetad process av molekylär strukturförklaring som började med isoleringen av stryknin från bönorna från Strychnos ignatii av Pierre Joseph Pelletier och Joseph Bienaimé Caventou 1818. Större bidragsgivare till hela ansträngningen var Sir Robert Robinson med över 250 publikationer och Hermann Leuchs med ytterligare 125 artiklar under en tidsperiod på 40 år. Robinson tilldelades Nobelpriset i kemi 1947 för sitt arbete med alkaloider, inklusive stryknin.
Processen för kemisk identifiering avslutades med publikationer 1946 av Robinson och senare bekräftades av Woodward 1947. Röntgenstrukturer som etablerade den absoluta konfigurationen blev tillgängliga mellan 1947 och 1951 med publikationer från Johannes Martin Bijvoet och JH Robertson.
Woodward publicerade en mycket kort redogörelse om strykninsyntesen 1954 (bara 3 sidor) och en lång (42 sidor) 1963.
Många fler metoder finns och rapporterats av forskargrupperna Magnus, Overman, Kuehne, Rawal, Bosch, Vollhardt, Mori, Shibasaki, Li, Fukuyama Vanderwal och MacMillan. Syntetiskt (+)-strychnin är också känt. Racemiska synteser publicerades av Padwa 2007 och 2010 av Andrade och Reissig. I sin publikation 1963 citerade Woodward Sir Robert Robinson som sa att det för sin molekylstorlek är det mest komplexa ämne som är känt .
Molekylen
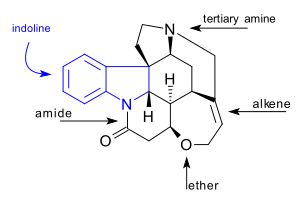
C 21 H 22 N 2 O 2 strykninmolekylen innehåller 7 ringar inklusive ett indolinsystem . Den har en tertiär amingrupp , en amid- , en alken- och en etergrupp . Den naturligt förekommande föreningen är också kiral med 6 asymmetriska kolatomer inklusive en kvartär.
Woodward syntes
Ring II, V syntes
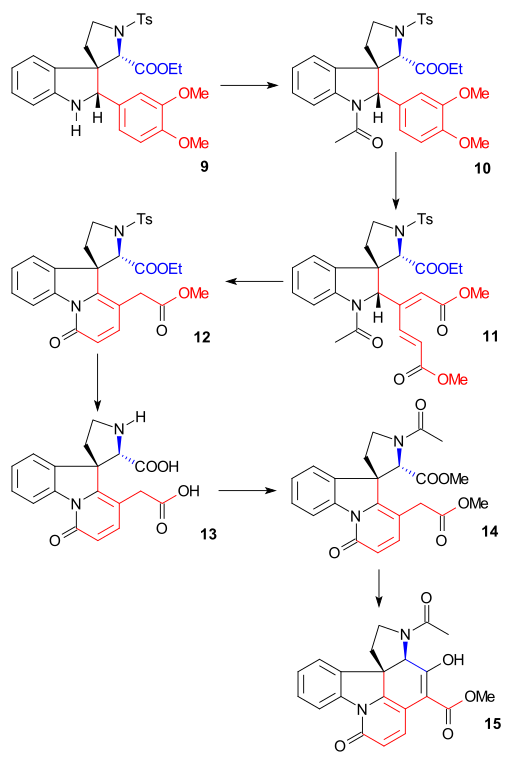
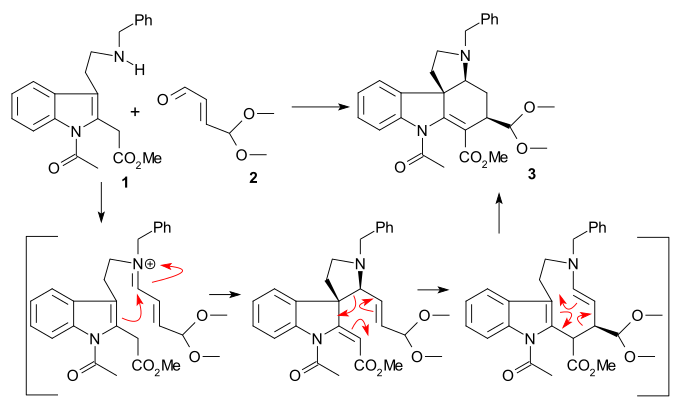
Syntesen av ring II genomfördes med en Fischer - indolsyntes med användning av fenylhydrazin 1 och acetofenonderivat acetoveratron 2 (katalysatorpolyfosforsyra ) för att ge 2-veratrylindolen 3 . Veratrylgruppen blockerar inte bara 2-positionen för ytterligare elektrofil substitution utan kommer också att bli en del av strykninskelettet. En Mannich-reaktion med formaldehyd och dimetylamin ) gav gramin 4 . Alkylering med jodmetan gav ett mellanliggande kvaternärt ammoniumsalt som reagerade med natriumcyanid i en nukleofil substitution till nitril 5 och sedan i en reduktion med litiumaluminiumhydrid till tryptamin 6 . Amin-karbonylkondensation med etylglyoxylat ger iminen 7 . Reaktionen av denna imin med TsCl i pyridin till den ringslutna N-tosylföreningen 8 beskrevs av Woodward som en samlad nukleofil enaminattack och formellt en Pictet-Spengler-reaktion . Denna förening bör bildas som ett diastereomert par men endast en förening hittades även om vilken inte undersöktes. Slutligen reducerades den nybildade dubbelbindningen med natriumborhydrid till indolin 9 med C8-väteatomen närmande från den minst hindrade sidan (denna proton tas bort senare i sekvensen och är utan betydelse).
Ring III, IV syntes
Indolin 9 acetylerades till N-acetylförening 10 ( ättiksyraanhydrid , pyridin ) och sedan ringöppnades veratrylgruppen med ozon i vattenhaltig ättiksyra till mukonsyraester 11 (möjliggjort av de två elektrondonerande metoxidgrupperna). Detta är ett exempel på bioinspirerad syntes som redan föreslagits av Woodward 1948. Klyvning av acetylgruppen och esterhydrolys med HCl i metanol resulterade i bildning av pyridonester 12 med ytterligare isomerisering av den exocykliska dubbelbindningen till en endocyklisk dubbelbindning (förstör en asymmetrisk bindning). Centrum). Efterföljande behandling med vätejodid och röd fosfor avlägsnade tosylgruppen och hydrolyserade båda återstående estergrupperna för att bilda disyra 13 . Acetylering och förestring ( diazometan ) gav acetyldiester 14 som sedan utsattes för en Dieckman-kondensation med natriummetoxid i metanol till enol 15 .
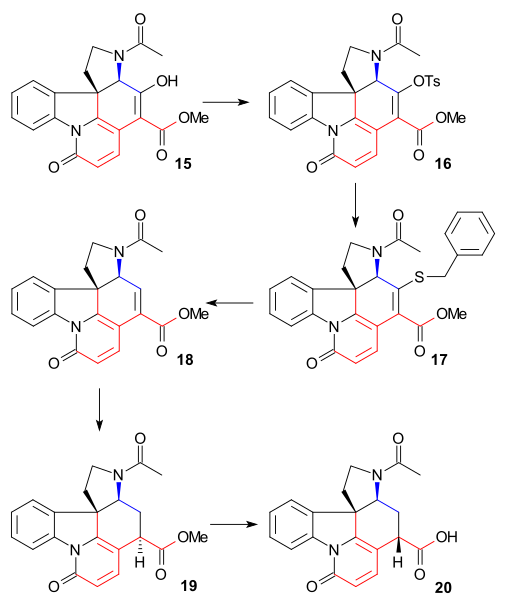
Ring VII syntes
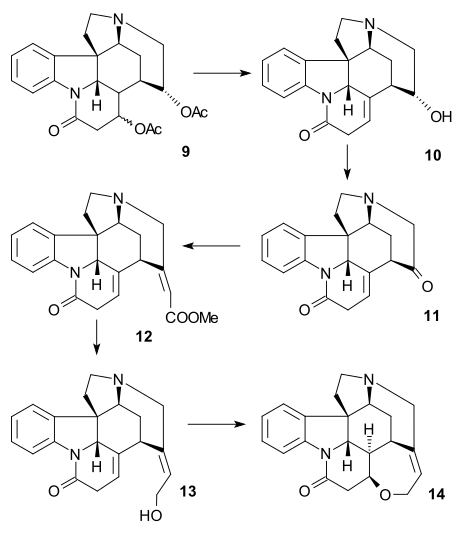
För att avlägsna C15- alkoholgruppen omvandlades Enol 15 till tosylat 16 ( TsCl , pyridin ) och sedan till merkaptoester 17 (natriumbensylmerkaptid) som sedan reducerades till omättad ester 18 av Raney -nickel och väte . Ytterligare reduktion med väte/ palladium på kol gav den mättade estern 19 . Alkalisk esterhydrolys till karboxylsyra 20 åtföljdes av epimerisering vid C14.
Denna speciella förening var redan känd från strykninnedbrytningsstudier. Hittills var alla intermediärer racemiska men kiralitet infördes i detta speciella skede via kiral upplösning med hjälp av kinidin .
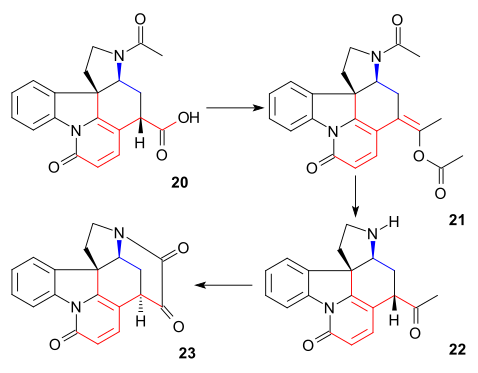
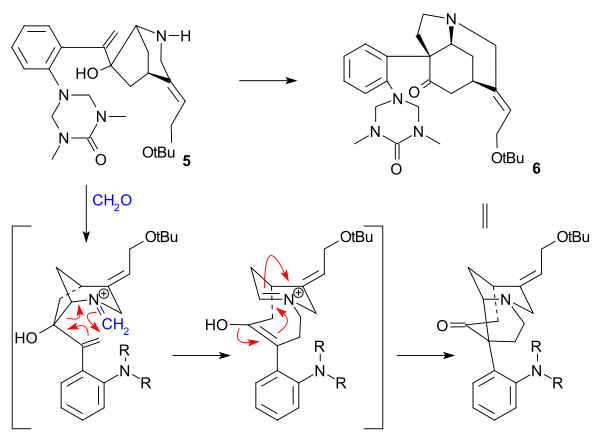
C20-kolatomen infördes sedan med ättiksyraanhydrid för att bilda enolacetat 21 och den fria aminoketonen 22 erhölls genom hydrolys med saltsyra . Ring VII i intermediär 23 stängdes genom selendioxidoxidation , en process som åtföljdes av epimerisering igen vid C14.
Bildandet av 21 kan föreställas som en sekvens av acylering, deprotonering, omarrangemang med förlust av koldioxid och återigen acylering:
Ring VI-syntes
Till diketon 23 sattes natriumacetylid ( alkynylering ) (som förde in kolatomerna 22 och 23) för att ge alkyn 24 . Denna förening reducerades till allylalkoholen 25 med användning av Lindlar-katalysatorn och litiumaluminiumhydrid avlägsnade den återstående amidgruppen i 26 . En allylisk omlagring till alkohol 27 (isostrychnin) åstadkoms av vätebromid i ättiksyra följt av hydrolys med svavelsyra . I det sista steget till (-)-strychnine 28 orsakade behandling av 27 med etanolisk kaliumhydroxid omarrangemang av C12-13-dubbelbindningen och ringslutning i en konjugattillsats av hydroxylanjonen.
Magnus syntes
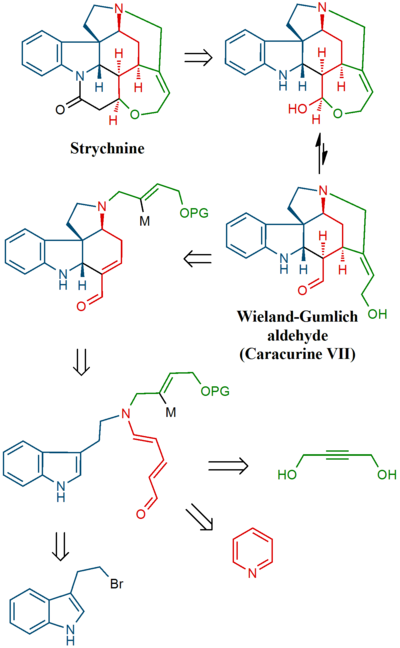
I detta försök syntetiserades först en av stryknins många nedbrytningsprodukter (reläföreningen), en förening som också finns tillgänglig i flera steg från en annan nedbrytningsprodukt som kallas Wieland- Gumlich-aldehyden . I den sista etappen syntetiserades själva stryknin från reläföreningen.
Overman syntes
Overman - syntesen (1993) tog en kiral cyklopentenförening som utgångsmaterial erhållet genom enzymatisk hydrolys av cis -1,4-diacetoxicyklopent-2-en. Detta utgångsmaterial omvandlades i flera steg till trialkylstannan 2 som sedan kopplades med en aryliodid 1 i en Stille-reaktion i närvaro av kolmonoxid ( tris(dibensylidenaceton)dipalladium(0), trifenylarsin ) . Den interna dubbeln i 3 omvandlades till en epoxid med tert-butylhydroperoxid , karbonylgruppen omvandlades sedan till en alken i en Wittig-reaktion med användning av Ph 3 P=CH 2 och TIPS -gruppen hydrolyserades ( TBAF ) och ersattes av en trifluoracetamid grupp ( NH2COCF3 , NaH ) i 4 . Cyklisering (NaH) ägde därefter rum, öppnande av epoxidringen och trifluoracetylgruppen avlägsnades med användning av KOH vilket gav azabicyklooktan 5 .
Nyckelsteget var en aza- Cope - Mannich-reaktion initierad av en amin-karbonylkondensation med användning av formaldehyd och bildade 6 i ett kvantitativt utbyte:
I den slutliga sekvensen erhölls stryknin genom Wieland-Gumlich-aldehyden ( 10 ):
Intermediär 6 acylerades med användning av metylcyanoformiat och två skyddsgrupper ( tert-butyl och ) avlägsnades med användning av HCl / MeOH i 7 . C8C13-dubbelbindningen reducerades med zink (MeOH/H + ) till mättad ester 8 (blandning). Epimerisering vid C13 med natriummetoxid i MeOH gav beta-ester 9 som reducerades med diisobutylaluminiumhydrid till Wieland-Gumlich aldehyd 10 . Omvandling av denna förening med malonsyra till (−)-strychnine 11 var redan känd som en procedur.
Kuehne syntes
Keuhne-syntesen från 1993 avser racemiskt stryknin. Utgångsföreningar tryptamin 1 och 4,4-dimetoxiakrolein 2 reagerade tillsammans med bortrifluorid till acetal 3 som en enda diastereomer i en amin-karbonylkondensations / sigmatropisk omlagringssekvens .
Hydrolys med perklorsyra gav aldehyd 4 . En Johnson-Corey-Chaykovsky-reaktion ( trimetylsulfoniumjodid / n-butyllitium ) omvandlade aldehyden till en epoxid som reagerade in situ med den tertiära aminen till ammoniumsalt 5 (förorenat med andra cykliseringsprodukter). Reduktion ( palladium på kol / väte ) tog bort bensylgruppen till alkohol 6 , mer reduktion ( natriumcyanoborhydrid ) och acylering ( ättiksyraanhydrid / pyridin ) gav 7 som en blandning av epimerer (vid C17). Ringslutning av ring III till 8 åstadkoms sedan med en aldolreaktion med användning av litiumbis(trimetylsilyl)amid (med användning av endast epimeren med korrekt konfiguration). Ännu mer reduktion ( natriumborhydrid ) och acylering resulterade i epimert diacetat 9 .
En DBU- medierad elimineringsreaktion bildade olefinisk alkohol 10 och efterföljande Swern-oxidation har en instabil aminoketon 11 . I de sista stegen ger en Horner-Wadsworth-Emmons-reaktion ( metyl-2-(dietylfosfono)acetat ) akrylatester 12 som en blandning av cis- och transisomerer som kan föras in i rätt (trans) riktning genom applicering av ljus i en fotokemisk omlagring reducerades estergruppen ( DIBAL / bortrifluorid ) till isostrychnin 13 och racemisk stryknin 14 bildades genom baskatalyserad ringslutning som i Woodward-syntesen.
I Keuhne-syntesen 1998 av kiralt (-)-strychnin härleddes utgångsmaterialet från kiralt tryptofan .
Rawal syntes
I Rawal-syntesen (1994, racemisk) kombinerades amin 1 och enon 2 i en amin-karbonylkondensation följt av metylklorformiatsläckning till trien 3 som sedan reagerades i en Diels-Alder-reaktion (bensen 185 °C) till hexen 4 . De tre estergrupperna hydrolyserades med användning av jodtrimetylsilan och bildade pentacyklisk laktam 5 efter en metanolsläckning i en kombination av 7 reaktionssteg (ett av dem en Dieckmann-kondensation ). C4- segmentet 6 tillsattes i en aminalkylering och Heck-reaktion av 7 bildade isostrychnine 8 efter TBS-avskyddning.
Den totala avkastningen (10 %) är hittills den största av någon av de publicerade metoderna
Bosch syntes
omvandlades olefingruppen i dion 1 till en aldehyd genom ozonolys och kiral amin 2 bildades i en dubbelreduktiv aminering med ( S )-1- fenetylamin . Fenyletylsubstituenten avlägsnades med användning av ClCO2CHClCH3 och enongruppen infördes i en Grieco -eliminering med användning av TMSI , HMDS , sedan PhSeCl, sedan ozon och sedan diisopropylaminbildande karbamat 3 . Aminogruppen avskyddades genom återloppskokning i metanol och alkylerades sedan med användning av ( Z ) -BrCH2CICH =CH2OTBDMS till tertiär amin4 . En reduktiv Heck-reaktion ägde därefter rum följt av metoxikarbonylering (LiHMDS, NCCO2Me) till trecykel 5 . Reaktion med zinkdamm i 10 % svavelsyra avlägsnade TBDMS- skyddsgruppen , reducerade nitrogruppen och åstadkom en reduktiv aminokarbonylcyklisering i ett enda steg till tetracyklisk 6 (epimerisk blandning). I det sista steget till Wieland-Gumlich-aldehyd 7 -reaktionen med NaH i MeOH som gav den korrekta epimeren följdes av DIBAH -reduktion av metylestern.
Vollhardt syntes
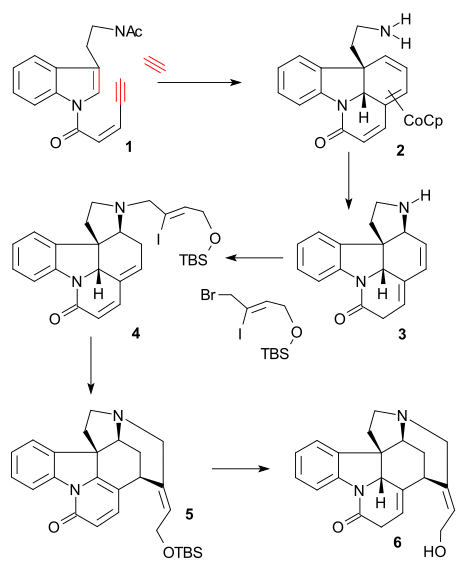
Nyckelreaktionen i Vollhardt-syntesen (2000, racemisk) var en alkyntrimerisering av tryptaminderivat 1 med acetylen och organokoboltföreningen CpCo (C 2 H 4 ) 2 (THF, 0 °C) till tricykel 2 efter avskyddande av amingruppen ( KOH, MeOH/H2O återflöde ). Efterföljande reaktion med järnnitrat åstadkom en [1,8] -konjugataddition till tetracykel 3 , aminalkylering med ( Z )-1-brom-4-[(tert-butyldimetylsilyl)oxi]-2-jodbut-2-en ( se Rawal-syntes) och litiumkarbonat , och isomerisering av diensystemet (NaOiPr, iPrOH) bildade enon 4 . En Heck-reaktion som i Rawal-syntesen ( palladiumacetat / trifenylfosfin ), åtföljd av aromatisering bildade pyridon 5 och litiumaluminiumhydridreduktion och TBS-gruppavskyddning bildade isostrychnine 6 .
Mori syntes
Mori-syntesen ((-) chiral, 2003) var den första som innehöll ett asymmetriskt reaktionssteg . Den har också ett stort antal Pd-katalyserade reaktioner. I den reagerade N-tosylamin 1 med allylkarbonat 2 i en allylisk asymmetrisk substitution med användning av Pd 2 (dba) 3 och asymmetrisk ligand (S-BINAPO) till kiral sekundär amin 3 . Desilylering av TBDMS PBr3 - gruppen skedde därefter med HCl till hydroxiden och sedan till nitrilen 4 ( NaCN ) genom bromiden ( ). Heck -reaktion ( Pd(OAc) / ) gav 2 Me2PPh och debromering ( Ag2CO3 ) . trecykel 5 LiALH 4 Nitrilreduktion till aminen och dess till Boc2O - skydd till bocamin 6 följdes sedan av en andra allyloxidation ( Pd(OAc) / 2 AcOH / bensokinon / MnO2 ) . tetracykel 7 Hydroboration-oxidation ( 9-BBN / H2O2 efterföljande . alkohol ) gav 8 och Swern - oxidationsketon 9 Reaktion med LDA /PhNTf2 gav enoltriflat 10 och triflatgruppen avlägsnades i PPh3 alken 11 genom reaktion med Pd(OAc) 2 och .
Detosylering av 11 ( natriumnaftalenid ) och amidering med syraklorid 3-bromoakryloylklorid gav amid 12 och en annan Heck-reaktion gav pentacykel 13 . dubbelbindningsisomerisering ( natrium / iPrOH ), avlägsnande av Boc-grupp ( triflinsyra ) och aminalkylering med (Z)-BrCH2CICH = CH2OTBDMS ( 14 se Rawal) gav förening ( identisk med en av Vollhardt-mellanprodukterna). En sista heck-reaktion ( 15 ) och TBDMS-avskyddning bildade (-)-isostrychnine 16 .
Shibasaki syntes
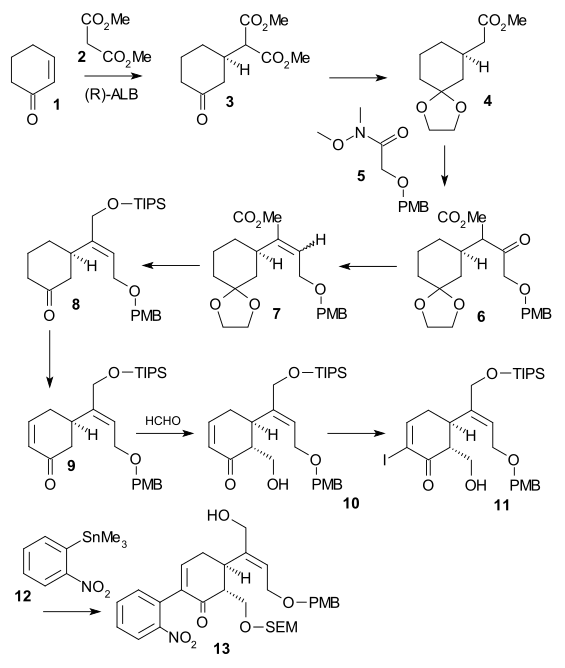
Shibasaki-syntesen ((-) chiral, 2002) var en andra publicerad metod i stryknin-totalsyntes med användning av ett asymmetriskt reaktionssteg . Cyklohexenon 1 reagerades med dimetylmalonat 2 i en asymmetrisk Michael-reaktion med användning av AlLibis (binaftoxid) för att bilda kiral diester 3 . Dess ketongrupp skyddades som en acetal (2-etyl-2-metyl-1,3-dioxolan, TsOH ) och en karboxylgrupp avlägsnades ( LiCl , DMSO 140 °C) i monoester 4 . Ett C2-fragment tillsattes som Weinreb-amid 5 för att bilda PMB-eter 6 med användning av LDA . Ketonen reducerades sedan till alkoholen ( NaBH 3 CN , TiCl 4 ) och sedan eliminerades vatten ( DCC , CuCl ) för att bilda alken 7 . Efter esterreduktion ( DIBAL ) till alkoholen och dess TIPS- skydd (TIPSOTf, trietylamin ) avlägsnades acetalgruppen (katalytisk CSA ) i keton 8 . Enone 9 bildades sedan genom Saegusa-oxidation . Omvandlingen till alkohol 10 åstadkoms via en Mukaiyama aldol-tillsats med användning av formaldehyd , jodonation till 11 ( jod , DMAP ) följdes av en Stille-koppling ( Pd 2 dba 3 , Ph 3 As , CuI ) innefattande nitrobensenenhet 12 . Alkohol 13 bildades efter SEM- skydd (SEMCl,i-Pr2NEt) och TIPS-borttagning ( HF ).
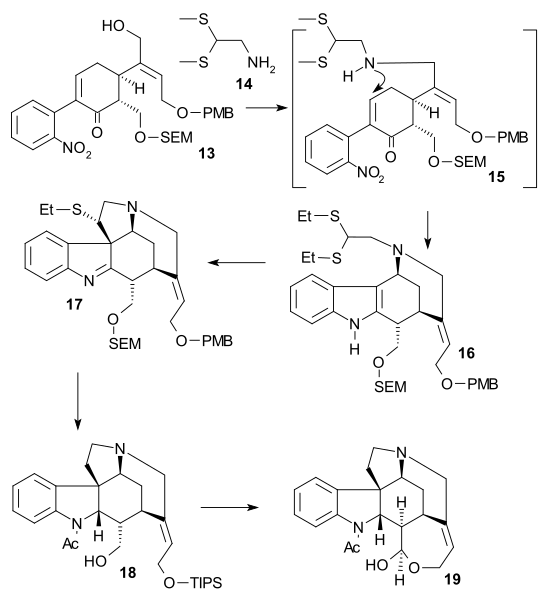
I den andra delen av sekvensen omvandlades alkohol 13 till en triflat ( triflinsyraanhydrid , N , N -diisopropyletylamin ), sedan tillsattes 2,2-bis(etyltio)etylamin 14 omedelbart följt av zinkpulver , sättning av en tandemreaktion med nitrogruppsreduktion till aminen, 1,4-addition av tioamingruppen och amin-ketokondensation till indol 16 . Reaktion med DMTSF gav tioniumangrepp vid C7 och bildade 17 , imingruppen reducerades sedan ( NaBH3CN NaOMe / , TiCl4 pyridin ), den nya aminogruppen acylerades ( ättiksyraanhydrid , ), båda alkoholskyddsgrupperna avlägsnades ( meOH ) och allylalkoholgrupp skyddad igen (TIPS). NaBH4 Detta möjliggjorde avlägsnande av etyltiogruppen ( NiCl2 . , , EtOH/MeOH) till 18 um Alkoholen oxiderades till aldehyden med en Parikh-Doering-oxidation och TIPS-gruppborttagning gav hemiacetal 19 kallad (+)-diabolin som är acylerad Wieland-Gumlich aldehyd .
Li syntes
Syntesen som rapporterades av Bodwell/Li (racemic, 2002) var en formell syntes eftersom den producerade en förening som redan framställts av Rawal (nr 5 i Rawal-syntesen). Nyckelsteget var en omvänd elektronefterfrågan Diels–Alder-reaktion av cyklofan 1 genom upphettning i N , N -dietylanilin (kväve drivs ut) följt av reduktion av dubbelbindning i 2 till 3 med natriumborhydrid / triflinsyra och avlägsnande av karbamatskyddet grupp ( PDC / celite ) till 4 .
Metoden ifrågasätts av Reissig (se Reissig-syntes).
Fukuyama syntes
Fukuyama-syntesen (kiral (-), 2004) startade från cyklisk amin 1 . Kiralitet infördes vid något tillfälle i detta utgångsmaterial genom enzymatisk upplösning av en av prekursorerna. Acyloin 2 bildades genom Rubottom-oxidation och hydrolys. Oxidativ klyvning av blyacetat bildad aldehyd 3 , avlägsnande av nosylgruppen ( tiofenol / cesiumkarbonat ) utlöste en amin-karbonylkondensation med iminiumjon 4 som fortsatte att reagera i en transannulär cyklisering till diester 5 som kunde omvandlas till Wieland-Gumlich al Wieland-Gumlich al. genom känd kemi.
Reissig syntes
Metoden som rapporterats av Beemelmanns & Reissig (racemic, 2010) är en annan formell syntes som leder till Rawal-pentacykeln (se amin 5 i Rawal-metoden). I denna metod omvandlades indol 1 till tetracykel 2 (tillsammans med biprodukt) i en enda kaskadreaktion med användning av samariumdijodid och HMPA . Raney-nickel /H2 - reduktion gav amin 3 och en enkärlsreaktion med användning av metylklorformiat , DMAP och TEA , sedan MsCl , DMAP och TEA och sedan gav DBU Rawal-prekursor 4 med nyckelväteatomer i den önskade antikonfigurationen.
På en avbruten väg reducerades först mellanprodukt 2 till imin 5 och omvandlades sedan till karbamat 6 , dehydrerades sedan till dien 7 ( Burgess-reagens ) och reducerades slutligen till 8 ( natriumcyanoborhydrid ). Väteatomerna i 8 är i ett oönskat cis-förhållande som motsäger resultaten som erhölls 2002 av Bodwell/Li för samma reaktion.
Vanderwal syntes
2011 rapporterade Vanderwal-gruppen en kortfattad, längsta linjär sekvens med 6 steg, total syntes av stryknin. Den innehöll en Zincke-reaktion följt av en anjonisk bicykliseringsreaktion och en tandem Brook-omlagring / konjugattillsats .