Kondensin
Kondensiner är stora proteinkomplex som spelar en central roll i kromosomsammansättning och segregation under mitos och meios (Figur 1). Deras underenheter identifierades ursprungligen som huvudkomponenter i mitotiska kromosomer sammansatta i Xenopus äggextrakt .
Subenhetssammansättning
Eukaryota typer
Många eukaryota celler har två olika typer av kondensinkomplex, kända som kondensin I och kondensin II , som var och en består av fem subenheter (Figur 2). Kondensiner I och II delar samma par av kärnsubenheter, SMC2 och SMC4, båda tillhörande en stor familj av kromosomala ATPaser , kända som SMC-proteiner (SMC står för Structural Maintenance of Chromosomes). Vart och ett av komplexen innehåller en distinkt uppsättning icke-SMC-regulatoriska subenheter (en kleisin -subenhet och ett par HEAT-repeterande subenheter). Båda komplexen är stora och har en total molekylvikt på 650-700 kDa.
| Komplex | Underenhet | Klassificering | Ryggradsdjur | D. melanogaster | C. elegans | S. cerevisiae | S. pombe | A. thaliana | C. merolae | T. thermophila |
|---|---|---|---|---|---|---|---|---|---|---|
| kondensin I & II | SMC2 | ATPas | CAP-E/SMC2 | SMC2 | MIX-1 | Smc2 | Klipp14 | CAP-E1&-E2 | SMC2 | Scm2 |
| kondensin I & II | SMC4 | ATPas | CAP-C/SMC4 | SMC4/Gluon | SMC-4 | Smc4 | Klipp 3 | CAP-C | SMC4 | Smc4 |
| kondensin I | CAP-D2 | HEAT upprepa | CAP-D2 | CAP-D2 | DPY-28 | Ycs4 | Cnd1 | CAB72176 | CAP-D2 | Cpd1&2 |
| kondensin I | CAP-G | HEAT upprepa | CAP-G | CAP-G | CAP-G1 | Ycg1 | Cnd3 | BAB08309 | CAP-G | Cpg1 |
| kondensin I | CAP-H | kleisin | CAP-H | CAP-H/Barren | DPY-26 | Brn1 | Cnd2 | AAC25941 | CAP-H | Cph1,2,3,4&5 |
| kondensin II | CAP-D3 | HEAT upprepa | CAP-D3 | CAP-D3 | HCP-6 | - | - | Vid 4g15890.1 | CAP-D3 | - |
| kondensin II | CAP-G2 | HEAT upprepa | CAP-G2 | - | CAP-G2 | - | - | CAP-G2/HEB1 | CAP-G2 | - |
| kondensin II | CAP-H2 | kleisin | CAP-H2 | CAP-H2 | KLE-2 | - | - | CAP-H2/HEB2 | CAP-H2 | - |
| kondensin I DC | SMC4 variant | ATPas | - | - | DPY-27 | - | - | - | - | - |
Kärnsubenheterna kondensiner (SMC2 och SMC4) är bevarade bland alla eukaryota arter som har studerats hittills. De icke-SMC-subenheter som är unika för kondensin I är också bevarade bland eukaryoter, men förekomsten av icke-SMC-subenheter som är unika för kondensin II varierar mycket mellan arter.
- Till exempel har fruktflugan Drosophila melanogaster inte genen för CAP-G2-subenheten av kondensin II. Andra insektsarter saknar ofta generna för CAP-D3- och/eller CAP-H-subenheterna också, vilket indikerar att de icke-SMC-subenheter som är unika för kondensin II har varit under högt selektionstryck under insektsutveckling.
- Nematoden Caenorhabditis elegans har både kondensiner I och II . Denna art är dock unik i den meningen att den har ett tredje komplex (nära besläktat med kondensin I) som deltar i kromosomomfattande genreglering , dvs doskompensation . I detta komplex, känt som kondensin IDC , ersätts den autentiska SMC4-subenheten med dess variant, DPY-27 (Figur 2).
- Vissa arter, som svampar (t.ex. den spirande jästen Saccharomyces cerevisiae och fissionsjästen Schizosaccharomyces pombe ), saknar alla regulatoriska subenheter som är unika för kondensin II. Å andra sidan har den encelliga, primitiva rödalgen Cyanidioschyzon merolae , vars genomstorlek är jämförbar med jästens, både kondensiner I och II. Således finns det inget uppenbart samband mellan förekomsten av kondensin II och storleken på eukaryota genom.
- Ciliatet Tetrahymena thermophila har endast kondensin I. Ändå finns det flera paraloger för två av dess regulatoriska subenheter (CAP-D2 och CAP-H), och några av dem lokaliseras specifikt till antingen makronukleus ( ansvarig för genuttryck) eller mikrokärnan (ansvarig för reproduktion). Således har denna art flera kondensin I-komplex som har olika regulatoriska subenheter och uppvisar distinkt nukleär lokalisering. Detta är en mycket unik egenskap som inte finns hos andra arter.
Prokaryota typer
Prokaryota arter har också kondensinliknande komplex som spelar en viktig roll i kromosom ( nukleoid ) organisation och segregation. De prokaryota kondensinerna kan klassificeras i två typer: SMC-ScpAB och MukBEF . Många eubakteriella och arkeala arter har SMC-ScpAB, medan en undergrupp av eubakterier (känd som Gammaproteobacteria ) inklusive Escherichia coli har MukBEF. ScpA och MukF tillhör en familj av proteiner som kallas "kleisins", medan ScpB och MukF nyligen har klassificerats i en ny familj av proteiner som heter "kite".
| Komplex | Underenhet | Klassificering | B. subtilis | Caulobacter | E coli |
|---|---|---|---|---|---|
| SMC-ScpAB | SMC | ATPas | SMC/BsSMC | SMC | - |
| SMC-ScpAB | ScpA | kleisin | ScpA | ScpA | - |
| SMC-ScpAB | ScpB | drake | ScpB | ScpB | - |
| MukBEF | MukB | ATPas | - | - | MukB |
| MukBEF | MukE | drake | - | - | MukE |
| MukBEF | MukF | kleisin | - | - | MukF |
Trots mycket divergerande primära strukturer för deras motsvarande subenheter mellan SMC-ScpAB och MukBEF, är det rimligt att överväga att de två komplexen spelar liknande om inte identiska funktioner i prokaryotisk kromosomorganisation och dynamik, baserat på deras molekylära arkitektur och deras defekta cellulära fenotyper. Båda komplexen kallas därför ofta prokaryota (eller bakteriella) kondensiner. Nyligen genomförda studier rapporterar förekomsten av ett tredje komplex relaterat till MukBEF (benämnt MksBEF) hos vissa bakteriearter.
Molekylära mekanismer
Molekylära strukturer
SMC-dimerer som fungerar som kärnsubenheter av kondensiner visar en mycket karakteristisk V-form, vars varje arm är sammansatt av antiparallella lindade spolar (Figur 3; se SMC-proteiner för detaljer). Längden på varje spiralformad arm når ~50 nm, vilket motsvarar längden på ~150 bp dubbelsträngat DNA (dsDNA). I eukaryota kondensin I- och II-komplex överbryggar en kleisin-subenhet de två huvuddomänerna i en SMC-dimer och binder till två HEAT-repeterande subenheter (Figur 1).
Tidiga studier klargjorde strukturen av delar av bakteriella kondensiner, såsom MukBEF och SMC-ScpA. I eukaryota komplex har flera strukturer av subkomplex och subdomäner rapporterats, inklusive gångjärns- och armdomänerna av en SMC2-SMC4 dimer, ett CAP-G(ycg1)/CAP-H(brn1) subkomplex och ett CAP-D2(ycs4) )/CAP-H(brnl) subkomplex. En färsk cryo-EM-studie har visat att kondensin genomgår stora konformationsförändringar som är kopplade till ATP-bindning och hydrolys av dess SMC-subenheter. Å andra sidan har snabb atomkraftsmikroskopi visat att armarna på en SMC-dimer är mycket mer flexibla än förväntat.
Molekylära aktiviteter
Kondensin I renat från Xenopus -äggextrakt är ett DNA -stimulerat ATPas och uppvisar förmågan att introducera positiv superhelical spänning i dsDNA på ett ATP -hydrolysberoende sätt (positiv supercoiling -aktivitet). Liknande aktiviteter har upptäckts i kondensiner från andra organismer. Den positiva supercoiling-aktiviteten aktiveras in vitro av Cdk1 - fosforylering , vilket antyder att det sannolikt är en av de fysiologiska aktiviteterna som är direkt involverade i mitotisk kromosommontering. Det antas att denna aktivitet av kondensin I hjälper till att vika DNA och främjar topoisomeras II -medierad upplösning av systerkromatider. Tidiga enkel-DNA-molekylexperiment visade också i realtid att kondensin I kan komprimera DNA på ett ATP-hydrolysberoende sätt.
Senast har experiment med en enda molekyl visat att spirande jästkondensin I kan translokera längs dsDNA ( motorisk aktivitet) och att "extrudera" DNA-slingor ( loopextruderingsaktivitet ) på ett ATP-hydrolysberoende sätt. I de senare experimenten visualiserades aktiviteten av individuella kondensinkomplex på DNA genom fluorescensavbildning i realtid, vilket avslöjade att kondensin I verkligen är en snabb loop-extruderande motor och att ett enda kondensin I-komplex kan extrudera 1 500 bp DNA per sekund i ett strikt ATP-beroende sätt. Det har föreslagits att kondensin I förankrar DNA mellan Ycg1-Brn1-subenheter och drar DNA asymmetriskt för att bilda stora slingor. Dessutom har det visat sig att kondensinkomplex kan korsa varandra, bilda dynamiska slingstrukturer och ändra deras storlekar.
Det är okänt hur kondensiner kan verka på nukleosomalt DNA . Den senaste utvecklingen av ett rekonstitutionssystem har identifierat histonchaperone FACT som en viktig komponent i kondensin I-medierad kromosomsamling in vitro , vilket ger en viktig ledtråd till detta problem. Det har också visat sig att kondensiner kan sätta ihop kromosomliknande strukturer i cellfria extrakt även under det tillstånd där nukleosomsammansättningen till stor del undertrycks. Denna observation indikerar att kondensiner kan fungera åtminstone delvis på icke-nukleosomalt DNA i en fysiologisk miljö.
Endast begränsad information är för närvarande tillgänglig om det funktionella bidraget från individuella subenheter av kondensiner till deras aktiviteter. En SMC2-SMC4-dimer har en förmåga att återannealera komplementärt enkelsträngat DNA . Denna aktivitet kräver inte ATP . För eukaryota komplex har det rapporterats att HEAT-repeterande subenheter bidrar till en del av DNA-bindningen och till sammansättningen av kromosomaxlar. Flexibla och utdragbara egenskaper hos HEAT-repetitioner kan ligga till grund för den dynamiska verkan av kondensiner och arkitekturen hos mitotiska kromosomer.
Matematisk modellering
Flera försök med matematisk modellering och datorsimulering av mitotisk kromosomsammansättning, baserat på molekylära aktiviteter hos kondensiner, har rapporterats. Representativa sådana inkluderar modellering baserad på loop-extrudering, stokastiska parvisa kontakter och en kombination av looping och inter-kondensin-attraktioner.
Funktioner i kromosomsammansättning och segregation
Mitos
I humana vävnadsodlingsceller regleras de två kondensinkomplexen olika under den mitotiska cellcykeln (Figur 4). Kondensin II finns i cellkärnan under interfas och deltar i ett tidigt stadium av kromosomkondensation i profaskärnan . Å andra sidan finns kondensin I i cytoplasman under interfas och får tillgång till kromosomer först efter att kärnhöljet bryts ner (NEBD) i slutet av profasen. Under prometafas och metafas samverkar kondensin I och kondensin II för att sätta ihop stavformade kromosomer, i vilka två systerkromatider är helt upplösta. Sådan differentiell dynamik hos de två komplexen observeras i Xenopus - äggextrakt , musoocyter och neurala stamceller, vilket indikerar att det är en del av en grundläggande regleringsmekanism som bevaras bland olika organismer och celltyper. Det är mest troligt att denna mekanism säkerställer den ordnade verkan av de två komplexen, nämligen kondensin II först och kondensin I senare.
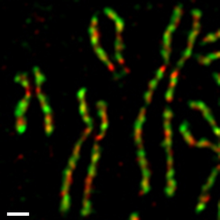
På metafaskromosomer anrikas båda kondensinerna I och II i den centrala axeln på ett icke-överlappande sätt (Figur 5). Utarmningsexperiment in vivo och immunutarmningsexperiment i Xenopus -äggextrakt visar att de två komplexen har distinkta funktioner vid sammansättning av metafaskromosomer. Celler som saknar kondensinfunktioner stoppas inte i ett specifikt skede av cellcykeln, uppvisar kromosomsegregationsdefekter (dvs anafasbryggor) och fortskrider genom onormal cytokines.
Det relativa bidraget av kondensiner I och II till mitos varierar mellan olika eukaryota arter. Till exempel spelar var och en av kondensinerna I och II en väsentlig roll i embryonal utveckling hos möss. De har både överlappande och icke-överlappande funktioner under den mitotiska cellcykeln. Å andra sidan är kondensin II icke-nödvändigt för mitos i den primitiva algen C. merolae och landväxten A. thaliana . Märkligt nog spelar kondensin II en dominerande roll framför kondensin I i C. elegans tidiga embryon. Denna egenhet kan bero på det faktum att C. elegans har en specialiserad kromosomstruktur som kallas holocentriska kromosomer . Svampar, såsom S. cerevisiae och S. pombe, har inget kondensin II från den första. Dessa skillnader mellan eukaryota arter ger viktiga implikationer i utvecklingen av kromosomarkitekturen (se avsnittet "Evolutionära implikationer" nedan).
| arter | M. musculus | D. melanogaster | C. elegans | S. cerevisiae | S. pombe | A. thaliana | C. merolae |
|---|---|---|---|---|---|---|---|
| genomstorlek | ~2 500 Mb | 140 Mb | 100 Mb | 12 Mb | 14 Mb | 125 Mb | 16 Mb |
| kondensin I | grundläggande | grundläggande | mindre | grundläggande | grundläggande | grundläggande | grundläggande |
| kondensin II | grundläggande | mindre viktiga | grundläggande | - | - | mindre viktiga | mindre viktiga |
Det har nyligen blivit möjligt att cellcykelberoende strukturella förändringar av kromosomer övervakas med en genomikbaserad metod känd som Hi-C (High-throughput chromosome conformation capture ). Kondensinbrists inverkan på kromosomkonformation har behandlats i spirande jäst, fissionsjäst och kyckling DT40-celler. Resultatet av dessa studier stöder starkt uppfattningen att kondensiner spelar avgörande roller i mitotisk kromosomsamling och att kondensin I och II har distinkta funktioner i denna process. Dessutom tillåter kvantitativa bildanalyser forskare att räkna antalet kondensinkomplex som finns på mänskliga metafaskromosomer.
Meios
Kondensiner spelar också viktiga roller i kromosomsammansättning och segregation i meios . Genetiska studier har rapporterats i S. cerevisiae D. , melanogaster . och C. elegans Hos möss har krav på kondensinsubenheter i meios åtgärdats genom antikroppsmedierade blockeringsexperiment och villkorade genknockoutanalyser . I däggdjurs meios I verkar det funktionella bidraget från kondensin II större än det för kondensin I. Som har visats i mitos har emellertid de två kondensinkomplexen både överlappande och icke-överlappande funktioner, även i meios. Till skillnad från cohesin har inga meiosspecifika subenheter av kondensiner identifierats hittills.
Kromosomala funktioner utanför mitos eller meios
Nyligen genomförda studier har visat att kondensiner deltar i en mängd olika kromosomfunktioner utanför mitos eller meios .
- I spirande jäst är kondensin I (det enda kondensinet i denna organism) involverat i kopietalsreglering av rDNA- upprepningen såväl som i klustring av tRNA -generna.
- I fissionsjäst är kondensin I involverat i regleringen av replikativ kontrollpunkt och klustring av gener som transkriberas av RNA-polymeras III.
- I C. elegans reglerar ett tredje kondensinkomplex (kondensin IDC ) relaterat till kondensin I högre ordningens struktur av X-kromosomer som en viktig regulator av doskompensation .
- I D. melanogaster bidrar kondensin II-subenheter till upplösningen av polytenkromosomer och bildandet av kromosomterritorier i äggstockssköterskeceller . Det finns bevis för att de negativt reglerar transvektion i diploida celler. Det har också rapporterats att kondensin I-komponenter krävs för att säkerställa korrekt genuttryck i neuroner efter cellcykelutträde.
- Hos A. thaliana är kondensin II väsentligt för tolerans av överskott av borstress, möjligen genom att lindra DNA-skada.
- I däggdjursceller är det troligt att kondensin II är involverat i regleringen av interfas kromosomarkitektur och funktion. Till exempel, i mänskliga celler deltar kondensin II i initieringen av systerkromatidupplösning under S-fasen, lång tid före mitotisk profas när systerkromatider blir cytologiskt synliga.
- I mus- interfaskärnor associerar pericentromeriskt heterokromatin på olika kromosomer med varandra och bildar en stor struktur som kallas kromocentra. Celler som saknar kondensin II, men inte i kondensin I, uppvisar hyperkluster av kromocentra, vilket indikerar att kondensin II har en specifik roll i att undertrycka kromocenterkluster.
- Medan tidiga studier antydde möjligheten att kondensiner direkt kan delta i reglering av genuttryck , argumenterar vissa nya studier mot denna hypotes.
- Mutanter av fissionsjästen Schizosaccharomyces pombe erhölls som hade en temperaturkänslig och/eller DNA-skada- känslig fenotyp. Några av dessa mutanter var defekta i HEAT-subenheterna av kondensin, vilket tyder på att HEAT-subenheterna krävs för DNA-reparation .
Posttranslationella modifieringar
Kondensinsubenheter utsätts för olika posttranslationella modifieringar på ett cellcykelberoende sätt. Bland dem är det bäst studerade exemplet fosforylering . Till exempel Cdk1 (cyklinberoende kinas 1) kondensin I, medan CK2 (kaseinkinas 2) negativt reglerar dess aktivitet.
| komplex | underenhet | arter | fosforyleringsställe | kinas | referens |
|---|---|---|---|---|---|
| kondensin I & II | SMC4 | S. pombe | T19 | Cdk1 | |
| S. cerevisiae | många | Cdk1 | |||
| kondensin I | CAP-D2 | X. laevis | T1314, T1348, T1353 | Cdk1 | |
| CAP-H | H. sapiens | S570 | CK2 | ||
| H. sapiens | S70 | norrsken B | |||
| S. pombe | S5, S41, S52 | norrsken B | |||
| CAP-D2, -G, -H | H. sapiens | - | norrsken B | ||
| S. cerevisiae | många | polo/Cdc5 | |||
| kondensin II | CAP-D3 | H. sapiens | T1415 | Cdk1 | |
| H. sapiens | S1419 | Plk1 | |||
| CAP-G2 | H. sapiens | T1010 (PBD-bindning) | ? | ||
| CAP-H2 | H. sapiens | S492 | Mps1 | ||
| D. melanogaster | - | CK1a |
Det har rapporterats att, i D. melanogaster , bryts CAP-H2-subenheten av kondensin II ned genom verkan av SCF Slimb ubiquitinligase .
Relevans för sjukdomar
Det visades att MCPH1, ett av proteinerna som ansvarar för primär mikrocefali hos människa , har förmågan att negativt reglera kondensin II. I mcph1- patientceller hyperaktiveras kondensin II (men inte kondensin I), vilket leder till för tidig kromosomkondensation i G2-fas (dvs innan den går in i mitos). Det finns dock inga bevis för att felreglering av kondensin II är direkt relaterad till etiologin för mcph1 mikrocefali. På senare tid har det rapporterats att hypomorfa mutationer i kondensin I eller II subenheter orsakar mikrocefali hos människor. Hos möss orsakar hypomorfa mutationer i kondensin II-subenheter specifika defekter i T-cellsutveckling , vilket leder till T-cellslymfom . Det är intressant att notera att celltyper med specialiserade celldelningssätt, såsom neurala stamceller och T-celler , är särskilt mottagliga för mutationer i kondensinsubenheter.
Evolutionära implikationer
Prokaryoter har primitiva typer av kondensiner, vilket indikerar att det evolutionära ursprunget för kondensiner föregår det för histoner. Det faktum att kondensinerna I och II är vitt bevarade bland befintliga eukaryota arter implicerar starkt att den sista eukaryota gemensamma förfadern ( LECA ) hade båda komplexen. Det är därför rimligt att spekulera i att vissa arter som svampar har tappat kondensin II under evolutionen .
Varför har då många eukaryoter två olika kondensinkomplex? Som diskuterats ovan varierar det relativa bidraget av kondensiner I och II till mitos mellan olika organismer. De spelar lika viktiga roller i däggdjursmitos, medan kondensin I har en dominerande roll framför kondensin II i många andra arter. Hos dessa arter kan kondensin II ha anpassats för olika icke-essentiella funktioner förutom mitos . Även om det inte finns något uppenbart samband mellan förekomsten av kondensin II och storleken på genomen, verkar det som om det funktionella bidraget från kondensin II blir stort när genomstorleken ökar. En nyligen genomförd, omfattande Hi-C-studie hävdar ur en evolutionär synvinkel att kondensin II fungerar som en determinant som omvandlar postmitotiska Rabl-konfigurationer till interfaskromosomterritorier. Det relativa bidraget från de två kondensinkomplexen till mitotisk kromosomarkitektur förändras också under utvecklingen, vilket påverkar morfologin hos mitotiska kromosomer. Sålunda är balansgången av kondensinerna I och II tydligen finjusterade i både evolution och utveckling.
Släktingar
Eukaryota celler har ytterligare två klasser av SMC-proteinkomplex . Cohesin innehåller SMC1 och SMC3 och är involverat i systerkromatidkohesion. SMC5/6-komplexet innehåller SMC5 och SMC6 och är inblandat i rekombinationell reparation.
Se även
- kromosom
- nukleoid
- mitos
- meios
- cellcykel
- kohesin
- SMC-protein
- ATPas
- HEAT upprepa
- Topoisomeras II
- DNA-superspiral
externa länkar
- kondensin vid US National Library of Medicine Medical Subject Headings (MeSH)