SCF-komplex
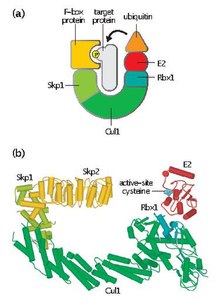
Skp, Cullin, F-box-innehållande komplex (eller SCF-komplex ) är ett multiprotein E3 ubiquitinligaskomplex som katalyserar ubiquitinering av proteiner avsedda för 26S proteasomal nedbrytning. Tillsammans med det anafasfrämjande komplexet har SCF viktiga roller i ubiquitinering av proteiner involverade i cellcykeln. SCF-komplexet markerar också olika andra cellulära proteiner för destruktion.
Kärnkomponenter
SCF innehåller ett variabelt F-box-protein och tre kärnsubenheter:
- F-boxprotein (FBP) – FBP bidrar till SCF-komplexets substratspecificitet genom att först aggregeras till målproteiner oberoende av komplexet. Varje FBP (t.ex. Skp2) kan känna igen flera olika substrat på ett sätt som är beroende av posttranslationella modifieringar såsom fosforylering eller glykosylering. FBP binder sedan till Skp1 i SCF-komplexet med hjälp av ett F-box-motiv, vilket bringar målproteinet i närheten av det funktionella E2 ubiquitin-konjugerande enzymet. FBP är också väsentligt för att reglera SCF-aktivitet under loppet av cellcykeln. SCF-nivåer tros förbli konstanta under hela cellcykeln. Istället regleras FBP-affinitet för proteinsubstrat genom cyklin-CDK-medierad fosforylering av målproteiner.
- Skp1 – Skp1 är ett adapterprotein som är väsentligt för igenkänning och bindning av F-box-proteiner.
- Cullin ( CUL1 ) – Cullin bildar den huvudsakliga strukturella ställningen för SCF-komplexet och länkar skp1-domänen till Rbx1-domänen. Olika kombinationer av Cullin och FBP kan generera i storleksordningen hundra typer av E3 ubiquitinligaser som riktar sig mot olika substrat.
- RBX1 – Rbx1 innehåller en liten, zinkbindande RING-fingerdomän (Rely Interesting New Gene), till vilken det E2 ubiquitin-konjugerande enzymet binder. Denna bindningshändelse tillåter överföring av ubiquitin från E2 till en lysinrest på målproteinet.
Upptäckt
Den första antydan som ledde till upptäckten av SCF-komplexet kom från genetiska screeningar av Saccharomyces cerevisiae , även känd som spirande jäst. Temperaturkänsliga celldelningscykelmutanter (Cdc) - som Cdc4, Cdc34 och Cdc53 - arresterade i G1 med oreplikerat DNA och flera långsträckta knoppar. Fenotypen tillskrevs ett misslyckande med att bryta ned Sic1, en hämmare av S-cyklin-CDK-komplex. Dessa fynd indikerade att proteolys är viktigt i G1/S-övergången.
Därefter visade biokemiska studier att Cdc34 är ett E2-enzym som fysiskt interagerar med ett E3 ubiquitinligaskomplex innehållande Skp1, Cdc4 och flera andra proteiner. Skp1:s kända bindningspartners - specifikt Skp2, Cyclin F och Cdc4 - visade sig dela ett motiv på cirka 40 rester som myntades av F-box-motivet. F-box-hypotesen som följde dessa upptäckter föreslog att F-box-proteiner rekryterar substrat som är inriktade på nedbrytning och att Skp1 länkar F-box-proteinet till kärnubiquitinationskomplexet.
Efterföljande genetiska studier i Caenorhabditis elegans bidrog senare till att belysa andra SCF-komplexkomponenter.
Cellcykelreglering
Den eukaryota cellcykeln regleras genom syntes, nedbrytning, bindningsinteraktioner, posttranslationella modifieringar av regulatoriska proteiner. Av dessa regulatoriska proteiner är två ubiquitinligaser avgörande för progression genom cellcykelkontrollpunkter. Det anafasfrämjande komplexet (APC) styr metafas-anafasövergången, medan SCF-komplexet styr G1/S- och G2/M-övergångar. Specifikt har SCF visat sig reglera centrioluppdelning från sen telofas till G1/S-övergången.
SCF-verksamheten regleras till stor del av post-translationella modifieringar. Till exempel är ubiquitin-medierad autokatalytisk nedbrytning av FBPs en mekanism för att minska SCF-aktivitet.
Välkarakteriserade cellcykelsubstrat av SCF-komplex inkluderar:
- cyklinfamiljens proteiner: Cyclin D, Cyclin E
- transkriptionella regulatorer: Myc, E2f1, p130
- cyklinberoende kinashämmare (CKI): p27 Kip1 , p21, Wee1
- centriolproteiner: Cep250, Ninein
Det finns ungefär sjuttio humana FBP, av vilka flera är involverade i cellcykelkontroll som en komponent i SCF-komplex.
Skp2 är en FBP som binder CKI såsom p27 Kip1 och p21. Skp2 binder p27 Kip1 endast när två villkor är uppfyllda: p27 Kip1 fosforyleras av E/A/CKD2 och binds till Cks1. Som en konsekvens av bindning av Skp2, ubiquitineras p27 Kip1 och riktas mot nedbrytning i sena G1 och tidiga S. SCF-Skp2 riktar sig också mot p130 för nedbrytning på ett fosforyleringsberoende sätt.
Beta-transducin repeat-innehållande protein (βTRCP) är ett FBP som riktar sig mot emi1 – en APC/C-Cdh1-hämmare – och wee1 för nedbrytning under tidig mitos. βTRCP känner igen dessa substrat efter att de är fosforylerade av Polo-liknande kinas 1 eller Cyclin B-CDK1.
Fbw7, som är den humana homologen av cdc4 i jäst, är en FBP som riktar sig mot Cyclin E, Myc, Notch och c-Jun för nedbrytning. Fbw7 är stabil under hela cellcykeln och är lokaliserad till kärnan på grund av närvaron av en nukleär lokaliseringssekvens (NLS). SCF-Fbw7 riktar sig mot Sic1 – när minst sex av nio möjliga platser är fosforylerade – och Swi5 för nedbrytning. Eftersom Sic1 normalt förhindrar för tidigt inträde i S-fas genom att hämma Cyclin B-CDK1, främjar inriktning på Sic1 för nedbrytning inträde i S-fas. Fbw7 är känt för att vara en haplo-otillräcklig tumörsuppressorgen som är inblandad i flera sporadiska karcinom, för vilka en mutant allel räcker för att störa vildtypsfenotypen.
Fbxo4 är en annan tumörsuppressor FBP som har varit inblandad i humana karcinom. SCF-fbxo4 spelar en roll i cellcykelkontroll genom att rikta in sig på cyklin D1 för nedbrytning.
Cyclin F är en FBP som är associerad med amyotrofisk lateral skleros (ALS) och frontotemporal demens (FTD). Mutationer som förhindrar fosforylering av Cyclin F förändrar aktiviteten av SCF-Cyclin F, vilket sannolikt påverkar nedströmsprocesser som är relevanta för neurondegeneration i ALS och FTD. Normalt siktar Cyclin F på E2f1 för nedbrytning.
Cancer
Nyligen har SCF-komplex blivit ett attraktivt anti-cancermål på grund av deras uppreglering i vissa humana cancerformer och deras biokemiskt distinkta aktiva platser. Även om många av de tidigare nämnda FBP har varit inblandade i cancer, har cytotoxicitet varit en begränsande faktor för läkemedelsutveckling.
Skp2-inriktade anti-sense oligonukleotider och siRNA är i utvecklingspipelinen för läkemedel. Preliminära studier har visat att Skp2-nedreglering kan hämma tillväxten av melanom, lungcancerceller, orala cancerceller och glioblastomceller .
βTRCP-inriktade siRNA har visat sig sensibilisera bröstcancerceller och livmoderhalscancerceller för befintliga kemoterapier.
Växthormonsignalering
Växthormonet auxin binder Tir1 (Transport Inhibitor Response 1). Tir1 är ett Auxin Signaling F-box Protein (AFB) som fungerar som en auxinreceptor. Auxinbunden Tir1 stimulerar bindning av SCF-Tir1 till AUX/IAA-repressorn. Efterföljande nedbrytning av repressorn resulterar i aktivering av AUX/IAA (dvs auxin-responsiva) gener.
Växthormonet Jasmonate binder Coi1, en FBP. SCF-Coi1 binder sedan JAZ-transkriptionsfaktorn och riktar in sig på den för nedbrytning. Nedbrytning av JAZ-transkriptionsfaktorn möjliggör transkription av de jasmonatresponsiva generna.
- ^ a b c Ou, Ung; Rattner, JB (2004), "The Centrosome in Higher Organisms: Structure, Composition, and Duplication", International Review of Cytology , Elsevier, 238 : 119–182, doi : 10.1016/s0074-7696(04)38003-4 4 , ISBN 978-0-12-364642-2 , PMID 15364198
- ^ a b c d e Fischer, Martin; Dang, Chi V.; DeCaprio, James A. (2018), "Control of Cell Division", Hematology , Elsevier, s. 176–185, doi : 10.1016/b978-0-323-35762-3.00017-2 , ISBN 978-3576233 -3
- ^ Morgan, David "Proteinnedbrytning i cell-cykelkontroll", Cellen cyklar; Principer för kontroll 2007
- ^ a b c d Den molekylära basen av cancer . Elsevier. 2008. doi : 10.1016/b978-1-4160-3703-3.x5001-7 . ISBN 978-1-4160-3703-3 .
- ^ Hegde, Ashok N. (2010), "Ubiquitin-Dependent Protein Degradation" , Comprehensive Natural Products II , Elsevier, s. 699–752, doi : 10.1016/b978-008045382-8.00697-09 , ISB -09 045382-8 , hämtad 2019-12-01
- ^ a b c Patton, E (1998-06-01). "Kombinatorisk kontroll i ubiquitin-beroende proteolys: skp inte F-box-hypotesen". Trender inom genetik . 14 (6): 236–243. doi : 10.1016/s0168-9525(98)01473-5 . ISSN 0168-9525 . PMID 9635407 .
- ^ Schwob, E (1994-10-21). "B-typ cyklinkinashämmare p40SIC1 kontrollerar G1 till S övergången i S. cerevisiae". Cell . 79 (2): 233–244. doi : 10.1016/0092-8674(94)90193-7 . ISSN 0092-8674 . PMID 7954792 . S2CID 34939988 .
- ^ a b Willems, Andrew R.; Schwab, Michael; Tyers, Mike (november 2004). "En liftares guide till cullin ubiquitin-ligaserna: SCF och dess anhöriga" . Biochimica et Biophysica Acta (BBA) - Molecular Cell Research . 1695 (1–3): 133–170. doi : 10.1016/j.bbamcr.2004.09.027 . ISSN 0167-4889 . PMID 15571813 .
- ^ Vodermaier, Hartmut C. (september 2004). "APC/C och SCF: Styr varandra och cellcykeln" . Aktuell biologi . 14 (18): R787–R796. doi : 10.1016/j.cub.2004.09.020 . ISSN 0960-9822 . PMID 15380093 .
-
^
Lambrus, Bramwell G.; Moyer, Tyler C.; Holland, Andrew J. (2017-08-31). "Tillämpa systemet för auxin-inducerbar nedbrytning (AID) för snabb proteinutarmning i däggdjursceller" . doi : 10.1101/182840 .
{{ citera journal }}: Citera journal kräver|journal=( hjälp ) - ^ Frescas, David; Pagano, Michele (juni 2008). "Avreglerad proteolys av F-boxproteinerna SKP2 och β-TrCP: tippa vågen för cancer" . Naturrecensioner Kräftan . 8 (6): 438–449. doi : 10.1038/nrc2396 . ISSN 1474-175X . PMC 2711846 . PMID 18500245 .
- ^ Mathias, Neal; Steussy, C. Nic; Goebl, Mark G. (1998-02-13). "En viktig domän inom Cdc34p krävs för att binda till ett komplex som innehåller Cdc4p och Cdc53p i Saccharomyces cerevisiae" . Journal of Biological Chemistry . 273 (7): 4040–4045. doi : 10.1074/jbc.273.7.4040 . ISSN 0021-9258 . PMID 9461595 .
- ^ Blondel, M. (2000-11-15). "Kärnspecifik nedbrytning av Far1 styrs av lokaliseringen av F-box-proteinet Cdc4" . EMBO Journal . 19 (22): 6085–6097. doi : 10.1093/emboj/19.22.6085 . ISSN 1460-2075 . PMC 305831 . PMID 11080155 .
- ^ Kishi, T.; Ikeda, A.; Koyama, N.; Fukada, J.; Nagao, R. (2008-09-11). "Ett förfinat tvåhybridsystem avslöjar att SCFCdc4-beroende nedbrytning av Swi5 bidrar till den reglerande mekanismen för S-fasinträde. " Proceedings of the National Academy of Sciences . 105 (38): 14497–14502. Bibcode : 2008PNAS..10514497K . doi : 10.1073/pnas.0806253105 . ISSN 0027-8424 . PMC 2567208 . PMID 18787112 .
- ^ Calhoun, Eric S.; Jones, Jessa B.; Ashfaq, Raheela; Adsay, Volkan; Baker, Suzanne J.; Valentine, Virginia; Hempen, Paula M.; Hilgers, Werner; Yeo, Charles J.; Hruban, Ralph H.; Kern, Scott E. (oktober 2003). "BRAF och FBXW7 (CDC4, FBW7, AGO, SEL10) mutationer i distinkta undergrupper av pankreascancer" . American Journal of Pathology . 163 (4): 1255–1260. doi : 10.1016/s0002-9440(10)63485-2 . ISSN 0002-9440 . PMC 1868306 . PMID 14507635 .
- ^ Yu, Yujiao; Nakagawa, Tadashi; Morohoshi, Akane; Nakagawa, Makiko; Ishida, Noriko; Suzuki, Naoki; Aoki, Masashi; Nakayama, Keiko (2019-09-30). "Patogena mutationer i ALS-genen CCNF orsakar cytoplasmatisk fellokalisering av Cyclin F och förhöjd VCP ATPas-aktivitet" . Human molekylär genetik . 28 (20): 3486–3497. doi : 10.1093/hmg/ddz119 . ISSN 0964-6906 . PMID 31577344 .
- ^ a b Lee, Albert; Rayner, Stephanie L.; De Luca, Alana; Gwee, Serene SL; Morsch, Marco; Sundaramoorthy, Vinod; Shahheydari, Hamideh; Ragagnin, Audrey; Shi, Bingyang; Yang, Shu; Williams, Kelly L. (oktober 2017). "Kaseinkinas II-fosforylering av cyklin F vid serin 621 reglerar Lys48-ubiquitylation E3-ligasaktiviteten hos SCF (cyklin F)-komplexet" . Öppen biologi . 7 (10): 170058. doi : 10.1098/rsob.170058 . ISSN 2046-2441 . PMC 5666078 . PMID 29021214 .
- ^ Skaar, Jeffrey R.; Pagan, Julia K.; Pagano, Michele (december 2014). "SCF ubiquitin ligas-riktade terapier" . Naturrecensioner Drug Discovery . 13 (12): 889–903. doi : 10.1038/nrd4432 . ISSN 1474-1776 . PMC 4410837 . PMID 25394868 .
- ^ a b c Sun, L. Jia och Y. (2011-02-28). "SCF E3 Ubiquitin Ligaser som anticancermål" . Aktuella cancerläkemedelsmål . 11 (3): 347–356. doi : 10.2174/156800911794519734 . PMC 3323109 . PMID 21247385 .
- ^ Dharmasiri, Nihal; Dharmasiri, Sunethra; Estelle, Mark (maj 2005). "F-boxproteinet TIR1 är en auxinreceptor". Naturen . 435 (7041): 441–445. Bibcode : 2005Natur.435..441D . doi : 10.1038/nature03543 . ISSN 0028-0836 . PMID 15917797 . S2CID 4428049 .
- ^ Devoto, Alessandra; Nieto-Rostro, Manuela; Xie, Daoxin; Ellis, Christine; Harmston, Rebecca; Patrick, Elaine; Davis, Jackie; Sherratt, Leigh; Coleman, Mark; Turner, John G. (november 2002). "COI1 länkar jasmonatsignalering och fertilitet till SCF ubiquitin-ligaskomplexet i Arabidopsis". Planttidningen . 32 (4): 457–466. doi : 10.1046/j.1365-313x.2002.01432.x . ISSN 0960-7412 . PMID 12445118 .

