Experiment med en molekyl
Ett experiment med en molekyl är ett experiment som undersöker egenskaperna hos enskilda molekyler . Enkelmolekylstudier kan jämföras med mätningar på en ensemble eller bulksamling av molekyler, där det individuella beteendet hos molekyler inte kan särskiljas och endast genomsnittliga egenskaper kan mätas. Eftersom många mättekniker inom biologi, kemi och fysik inte är tillräckligt känsliga för att observera enstaka molekyler, har enkelmolekylära fluorescenstekniker (som har dykt upp sedan 1990-talet för att sondera olika processer på nivån för enskilda molekyler) orsakat mycket spänning, eftersom dessa gav många nya detaljer om de uppmätta processerna som inte var tillgängliga tidigare. Sedan 1990-talet har många tekniker för att sondera enskilda molekyler utvecklats.
De första experimenten med en enda molekyl var lapptångsexperiment utförda på 1970-talet, men dessa var begränsade till att studera jonkanaler . Idag omfattar system som undersöks med enmolekylära tekniker förflyttning av myosin på aktinfilament i muskelvävnad och de spektroskopiska detaljerna i enskilda lokala miljöer i fasta ämnen. Biologiska polymerers konformationer har mätts med hjälp av atomkraftsmikroskopi ( AFM). Genom att använda kraftspektroskopi kan enstaka molekyler (eller par av interagerande molekyler), vanligtvis polymerer , mekaniskt sträckas ut och deras elastiska svar registreras i realtid.
Historia
I gasfasen vid ultralåga tryck har enmolekylexperiment funnits i årtionden, men i den kondenserade fasen först sedan 1989 med arbetet av WE Moerner och Lothar Kador. Ett år senare kunde Michel Orrit och Jacky Bernard även visa upptäckten av absorptionen av enstaka molekyler genom deras fluorescens.
Många tekniker har förmågan att observera en molekyl i taget, framför allt masspektrometri, där enstaka joner detekteras. Dessutom kom ett av de tidigaste sätten att detektera enstaka molekyler till inom jonkanalerna med utvecklingen av patch clamp -tekniken av Erwin Neher och Bert Sakmann (som senare vann Nobelpriset för sina framstående bidrag) . Men tanken på att mäta konduktans för att titta på enstaka molekyler satte en allvarlig begränsning på vilken typ av system som kunde observeras.
Fluorescens är ett bekvämt sätt att observera en molekyl i taget, mestadels på grund av känsligheten hos kommersiella optiska detektorer, som kan räkna enstaka fotoner. Men spektroskopiskt kräver observationen av en molekyl att molekylen befinner sig i en isolerad miljö och att den avger fotoner vid excitation, vilket tack vare tekniken för att detektera enstaka fotoner med hjälp av fotomultiplikatorrör (PMT) eller lavinfotodioder (APD), gör det möjligt att registrera fotonemissionshändelser med stor känslighet och tidsupplösning.
På senare tid är enkelmolekylär fluorescens föremål för ett intensivt intresse för biologisk avbildning, genom märkning av biomolekyler som proteiner och nukleotider för att studera enzymatisk funktion som inte lätt kan studeras på bulkskalan, på grund av subtila tidsberoende rörelser i katalys och strukturell omorganisation. Det mest studerade proteinet har varit klassen myosin/aktin-enzymer som finns i muskelvävnader. Genom enkelmolekylära tekniker har stegmekanismen observerats och karakteriserats i många av dessa proteiner.
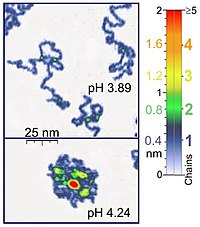
Nanomanipulatorer som atomkraftsmikroskopet är också lämpade för enmolekylexperiment av biologisk betydelse, eftersom de arbetar på samma längdskala som de flesta biologiska polymerer. Dessutom är atomkraftsmikroskopi (AFM) lämplig för studier av syntetiska polymermolekyler. AFM ger en unik möjlighet till 3D-visualisering av polymerkedjor. Till exempel är AFM-tappningsläget skonsamt nog för inspelning av adsorberade polyelektrolytmolekyler (till exempel 0,4 nm tjocka kedjor av poly(2-vinylpyridin)) under flytande medium. Placeringen av tvåkedjeöverlagring motsvarar i dessa experiment två gånger tjockleken av en enkel kedja (0,8 nm i fallet med det nämnda exemplet). Vid tillämpning av korrekta skanningsparametrar förblir konformationen av sådana molekyler oförändrad i timmar, vilket gör det möjligt att utföra experiment under flytande media med olika egenskaper. Genom att kontrollera kraften mellan spetsen och provet kan dessutom högupplösta bilder erhållas. Optisk pincett har också använts för att studera och kvantifiera DNA-proteininteraktioner.
Om experimenten
Begrepp
Enkelmolekyls fluorescensspektroskopi använder en molekyls fluorescens för att få information om dess miljö, struktur och position. Tekniken ger möjligheten att erhålla information som annars inte är tillgänglig på grund av ensemblemedelvärde (det vill säga en signal som erhålls när man registrerar många molekyler samtidigt representerar en genomsnittlig egenskap hos molekylernas dynamik). Resultaten i många experiment av individuella molekyler är tvåtillståndsbanor .
Enkanalsinspelning

Precis som i fallet med fluorescensspektroskopi med en enda molekyl kan tekniken som kallas enkanalsinspelning användas för att erhålla specifik kinetisk information – i det här fallet om jonkanalfunktion – som inte är tillgänglig när ensembleinspelning, såsom helcellsinspelning, är genomförde. Specifikt växlar jonkanaler mellan ledande och icke-ledande klasser, som skiljer sig i konformation. Därför kan jonkanalernas funktionella tillstånd mätas direkt med tillräckligt känslig elektronik, förutsatt att lämpliga försiktighetsåtgärder vidtas för att minimera brus. I sin tur kan var och en av dessa klasser delas in i ett eller flera kinetiska tillstånd med direkt inverkan på jonkanalens underliggande funktion. Att utföra dessa typer av enmolekylstudier under systematiskt varierande förhållanden (t.ex. agonistkoncentration och struktur, permeant jon och/eller kanalblockerare, mutationer i jonkanalens aminosyror), kan ge information om interomvandlingen av olika kinetiska tillstånd i jonkanalen. I en minimal modell för en jonkanal finns det två tillstånd : öppen och stängd. Emellertid behövs ofta andra tillstånd för att korrekt representera data, inklusive flera stängda tillstånd såväl som inaktiva och/eller desensibiliserade tillstånd, som är icke-ledande tillstånd som kan inträffa även i närvaro av stimulans.
Biomolekylmärkning
Enstaka fluoroforer kan fästas kemiskt till biomolekyler, såsom proteiner eller DNA, och dynamiken hos enskilda molekyler kan spåras genom att övervaka den fluorescerande sonden. Rumsliga rörelser inom Rayleigh-gränsen kan spåras, tillsammans med förändringar i emissionsintensitet och/eller strålningslivslängd, vilket ofta indikerar förändringar i den lokala miljön. Till exempel har enkelmolekylär märkning gett en stor mängd information om hur kinesinmotorproteiner rör sig längs mikrotubulisträngar i muskelceller. Enkelmolekylavbildning i levande celler avslöjar intressant information om proteindynamik under dess fysiologiska miljö. Flera biofysiska parametrar om proteindynamik kan kvantifieras såsom diffusionskoefficient, medelkvadratförskjutningar, uppehållstid, andelen bundna och obundna molekyler och målsökningsmekanism för proteinbindning till dess målställe i den levande cellen.
Enkelmolekylär fluorescensresonansenergiöverföring (FRET)
Huvudartikel smFRET .
Vid enkelmolekylär fluorescensresonansenergiöverföring är molekylen märkt på (minst) två ställen. En laserstråle fokuseras på molekylen som exciterar den första sonden. När denna sond slappnar av och avger en foton, har den en chans att excitera den andra sonden. Effektiviteten för absorptionen av fotonen som emitteras från den första sonden i den andra sonden beror på avståndet mellan dessa sonder. Eftersom avståndet förändras med tiden undersöker detta experiment molekylens inre dynamik.
Enkelmolekylexperiment kontra ensembleexperiment
När man tittar på data relaterade till enskilda molekyler kan man vanligtvis konstruera propagatorer och hopptidssannolikhetstäthetsfunktioner av första ordningen, andra ordningen och så vidare, medan man från bulkexperiment vanligtvis erhåller sönderfallet av en korrelationsfunktion. Från informationen som finns i dessa unika funktioner (erhållen från enskilda molekyler) kan man utvinna en relativt tydlig bild av hur systemet beter sig; t.ex. dess kinetiska schema , eller dess aktivitetspotential, eller dess reducerade dimensioner form . I synnerhet kan man konstruera (många egenskaper hos) reaktionsvägen för ett enzym när man övervakar aktiviteten hos ett enskilt enzym. Dessutom har betydande aspekter beträffande analysen av enstaka molekyldata - såsom anpassningsmetoder och tester för homogena populationer - beskrivits av flera författare. Å andra sidan finns det flera problem med analysen av enstaka molekyldata, inklusive konstruktion av en miljö med låg ljudnivå och isolerade pipettspetsar, filtrering av några av de återstående oönskade komponenterna (brus) som finns i inspelningar och hur lång tid som krävs för data analys (förbearbetning, entydig händelsedetektering, plottning av data, anpassning av kinetiska scheman, etc.).
Påverkan
Enkelmolekyltekniker påverkade optik, elektronik, biologi och kemi. Inom de biologiska vetenskaperna var studiet av proteiner och andra komplexa biologiska maskiner begränsade till ensembleexperiment som nästan omöjliggjorde direkt observation av deras kinetik. Till exempel var det först efter att en molekyl fluorescensmikroskopi användes för att studera kinesin-myosin-par i muskelvävnad som direkt observation av gångmekanismerna förstods. Dessa experiment har dock för det mesta varit begränsade till in vitro-studier, eftersom användbara tekniker för avbildning av levande celler ännu inte har realiserats fullt ut. Löftet om enskild molekyl in vivo-avbildning för med sig en enorm potential att direkt observera biomolekyler i inhemska processer. Dessa tekniker är ofta inriktade på studier som involverar lågkopierade proteiner, av vilka många fortfarande upptäcks. Dessa tekniker har också utvidgats till att studera områden inom kemi, inklusive kartläggning av heterogena ytor.
Se även
- En molekyl magnet
- Kraftspektroskopi
- Magnetisk pincett
- Optisk pincett
- Spårning av en partikel
- Raman spektroskopi
- Skanningssondmikroskopi
- Elektronmikroskopi
- Tjudd partikelrörelse (TPM)
- Superupplösningsmikroskopi
- Spänningsklämma
- Avstämbar resistiv pulsavkänning
- En molekyl realtidssekvensering