Boronsyra

En borsyra är en organisk förening besläktad med borsyra ( B(OH) 3 ) där en av de tre hydroxylgrupperna ( −OH ) är ersatt med en alkyl- eller arylgrupp (representerad av R i den allmänna formeln R−B( OH) 2 ). Som en förening som innehåller en kol-borbindning tillhör medlemmarna av denna klass alltså den större klassen av organoboraner .
Boronsyror fungerar som Lewis-syror . Deras unika egenskap är att de kan bilda reversibla kovalenta komplex med sockerarter , aminosyror , hydroxamsyror , etc. (molekyler med vicinala , (1,2) eller ibland (1,3) substituerade Lewis-basdonatorer ( alkohol , amin , karboxylat)). p tetraedriska Ka för en boronsyra är ~9, men de kan bilda boronatkomplex med p Ka ~7 . De används ibland inom området för molekylär igenkänning för att binda till sackarider för fluorescerande detektion eller selektiv transport av sackarider över membran.
Boronsyror används i stor utsträckning i organisk kemi som kemiska byggstenar och mellanprodukter främst i Suzuki-kopplingen . Ett nyckelbegrepp i dess kemi är transmetallering av dess organiska rest till en övergångsmetall.
Sammansättningen bortezomib med en boronsyragrupp är ett läkemedel som används i kemoterapi . Boratomen i denna molekyl är en nyckelsubstruktur eftersom genom den blockeras vissa proteasomer som annars skulle bryta ned proteiner. Boronsyror är kända för att binda till seriner på det aktiva stället och är en del av hämmare av pankreaslipas från svin , subtilisin och proteaset Kex2 . Boronsyraderivat utgör dessutom en klass av inhibitorer för humant acylproteintioesteras 1 och 2, som är cancerläkemedelsmål inom Ras -cykeln.
Den funktionella boronsyragruppen är känd för att ha låg inneboende toxicitet. Detta är en av anledningarna till Suzuki-kopplingens popularitet i utvecklingen och syntesen av farmaceutiska medel. Men en betydande del av de vanligaste boronsyror och deras derivat visade sig nyligen ge ett positivt Ames-test och fungera som kemiska mutagener . Mekanismen för mutagenicitet tros involvera generering av organiska radikaler via oxidation av boronsyran med atmosfäriskt syre.
Struktur och syntes
År 1860 var Edward Frankland den första som rapporterade beredningen och isoleringen av en borsyra. Etylboronsyra syntetiserades genom en tvåstegsprocess. Först reagerade dietylzink och trietylborat för att producera trietylboran . Denna förening oxiderade sedan i luft för att bilda etylboronsyra. Flera syntetiska vägar är nu i vanlig användning, och många luftstabila borsyror är kommersiellt tillgängliga.
Boronsyror har vanligtvis höga smältpunkter. De är benägna att bilda anhydrider genom förlust av vattenmolekyler, vanligtvis för att ge cykliska trimerer .
| Boronsyra | R | Strukturera | Molar massa | CAS-nummer | Smältpunkt °C |
|---|---|---|---|---|---|
| Fenylboronsyra | Fenyl |  |
121,93 | 98-80-6 | 216–219 |
| 2-tienylboronsyra | Thiophen |  |
127,96 | 6165-68-0 | 138–140 |
| Metylboronsyra | Metyl |  |
59,86 | 13061-96-6 | 91–94 |
| cis- propenylboronsyra | propen | 85,90 | 7547-96-8 | 65–70 | |
| trans- propenylboronsyra | propen |  |
85,90 | 7547-97-9 | 123–127 |
Syntes
Boronsyror kan erhållas via flera metoder. Det vanligaste sättet är reaktion av organometalliska föreningar baserade på litium eller magnesium ( Grignards ) med boratestrar . Till exempel framställs fenylboronsyra av fenylmagnesiumbromid och trimetylborat följt av hydrolys
- PhMgBr + B(OMe) 3 → PhB(OMe) 2 + MeOMgBr
- PhB(OMe) 2 + 2 H 2 O → PhB(OH) 2 + 2 MeOH
En annan metod är reaktion av en arylsilan (RSiR 3 ) med bortribromid (BBr 3 ) i en transmetallering till RBBr 2 följt av sur hydrolys.
En tredje metod är genom palladiumkatalyserad reaktion av arylhalider och triflater med diboronylestrar i en kopplingsreaktion känd som Miyaura-boryleringsreaktionen . Ett alternativ till estrar i denna metod är användningen av diboronsyra eller tetrahydroxidibor ([B(OH 2 )] 2 ).
Boronsyraestrar (även kallade boronatestrar)
Boronsyraestrar är estrar som bildas mellan en boronsyra och en alkohol.
| Förening | Allmän formel | Allmän struktur |
|---|---|---|
| Boronsyra | RB(OH) 2 | |
| Boronsyraester | RB(OR) 2 |
Föreningarna kan erhållas från boratestrar genom kondensation med alkoholer och dioler . Fenylboronsyra kan självkondenseras till den cykliska trimeren som kallas trifenylanhydrid eller trifenylboroxin.
| Boronsyraester | Diol | Strukturformel | Molar massa | CAS-nummer | Kokpunkt (°C) |
|---|---|---|---|---|---|
| Allylboronsyra pinacol ester | pinacol | 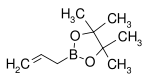 |
168,04 | 72824-04-5 | 50–53 (5 mmHg) |
| Fenylborsyra trimetylenglykolester | trimetylenglykol |  |
161,99 | 4406-77-3 | 106 (2 mm Hg) |
| Diisopropoximetylboran | isopropanol |  |
144,02 | 86595-27-9 | 105-107 |
Föreningar med 5-ledade cykliska strukturer som innehåller C–O–B–O–C-kopplingen kallas dioxaborolaner och de med 6-ledade ringar dioxaborinaner .
Applikationer för organisk kemi
Suzuki kopplingsreaktion
Boronsyror används i organisk kemi i Suzuki-reaktionen . I denna reaktion byter boratomen ut sin arylgrupp med en alkoxigrupp från palladium.
-
()
Chan–Lam koppling
I Chan-Lam-kopplingen reagerar alkyl-, alkenyl- eller arylboronsyra med en N-H- eller O-H-innehållande förening med Cu(II) såsom koppar(II)acetat och syre och en bas såsom pyridin och bildar ett nytt kol –kvävebindning eller kol-syrebindning till exempel i denna reaktion av 2-pyridon med trans -1-hexenylboronsyra:
Reaktionsmekanismsekvensen är deprotonering av aminen, koordinering av aminen till koppar(II), transmetallering (överföring av alkylborgruppen till koppar och kopparacetatgruppen till bor), oxidation av Cu(II) till Cu(III) genom syre och slutligen reduktiv eliminering av Cu(III) till Cu(I) med bildning av produkten. Direkt reduktiv eliminering av Cu(II) till Cu(0) sker också men är mycket långsam. I katalytiska system regenererar syre också Cu(II)-katalysatorn.
Liebeskind–Srogl koppling
I Liebeskind-Srogl-kopplingen kopplas en tiolester med en borsyra för att producera en keton .
Konjugerad addition
Den organiska boronsyraresten är en nukleofil i konjugattillsats också i samband med en metall. I en studie reageras pinakolestern av allylboronsyra med dibensylidenaceton i en sådan konjugattillsats:
- Katalysatorsystemet i denna reaktion är tris(dibensylidenaceton)dipalladium(0 ) / tricyklohexylfosfin .
En annan konjugattillsats är den av gramin med fenylboronsyra katalyserad av cyklooktadien-rhodiumkloriddimer :
Oxidation
Borsyraestrar oxideras till motsvarande alkoholer med bas och väteperoxid (för ett exempel se: karbenoid )
Homologering
I denna reaktion omvandlar diklormetyllitium boronestern till ett boronat. En Lewis-syra inducerar sedan en omlagring av alkylgruppen med undanträngning av klorgruppen. Slutligen ersätter ett organometalliskt reagens såsom ett Grignard-reagens den andra kloratomen, vilket effektivt leder till införande av en RCH2- grupp i CB-bindningen. En annan reaktion med boronatalkylmigrering är Petasis-reaktionen .
Elektrofila allylskift
Allylboronsyraestrar engagerar sig i elektrofila allylskiften mycket som kiselhänge i Sakurai-reaktionen . I en studie kombinerar ett diallyleringsreagens båda:
Hydrolys
Hydrolys av borsyraestrar tillbaka till boronsyran och alkoholen kan åstadkommas i vissa system med tionylklorid och pyridin . Arylboronsyror eller estrar kan hydrolyseras till motsvarande fenoler genom reaktion med hydroxylamin vid rumstemperatur.
C–H-kopplingsreaktioner
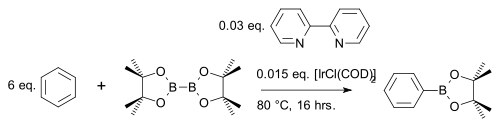
Diborföreningen bis(pinacolato)diboron reagerar med aromatiska heterocykler eller enkla arener till en arylboronatester med iridiumkatalysator [IrCl(COD)] 2 (en modifiering av Crabtrees katalysator ) och bas 4,4'-di-tert-butyl-2 ,2'-bipyridin i en CH- kopplingsreaktion till exempel med bensen :
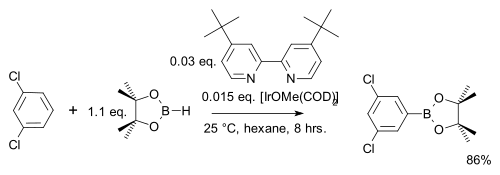
I en modifiering reagerar arenen med endast en stökiometrisk ekvivalent snarare än ett stort överskott med den billigare pinacolboranen :
Till skillnad från vanlig elektrofil aromatisk substitution (EAS) där elektroniska effekter dominerar, bestäms regioselektiviteten i denna reaktionstyp enbart av den steriska bulken av iridiumkomplexet. Detta utnyttjas i en metabromering av m -xylen som enligt standard AES skulle ge ortoprodukten:
Protonolys
Protodeboronering är en kemisk reaktion som involverar protonolys av en boronsyra (eller annan organoboranförening) där en kol-borbindning bryts och ersätts med en kol-vätebindning. Protodeboronation är en välkänd oönskad bireaktion och ofta förknippad med metallkatalyserade kopplingsreaktioner som använder boronsyror (se Suzuki-reaktion) . För en given borsyra är benägenheten att genomgå protodeborering mycket varierande och beror på olika faktorer, såsom de använda reaktionsbetingelserna och den organiska substituenten i boronsyran:
Supramolekylär kemi
Sackaridigenkänning
Den kovalenta parvisa interaktionen mellan boronsyror och hydroxigrupper som finns i alkoholer och syror är snabb och reversibel i vattenlösningar . Jämvikten som etablerats mellan boronsyror och hydroxylgrupperna som finns på sackarider har framgångsrikt använts för att utveckla en rad sensorer för sackarider. En av de viktigaste fördelarna med denna dynamiska kovalenta strategi ligger i boronsyrors förmåga att övervinna utmaningen med att binda neutrala arter i vattenhaltiga medier. Om det är korrekt arrangerat kommer införandet av en tertiär amin i dessa supramolekylära system att tillåta bindning att ske vid fysiologiskt pH och tillåta signaleringsmekanismer såsom fotoinducerad elektronöverföringsmedierad fluorescensemission att rapportera bindningshändelsen.
Potentiella tillämpningar för denna forskning inkluderar blodsockerövervakningssystem för att hantera diabetes mellitus. Eftersom sensorerna använder en optisk respons kan övervakning uppnås med minimalt invasiva metoder, ett sådant exempel är undersökningen av en kontaktlins som innehåller en boronsyrabaserad sensormolekyl för att detektera glukosnivåer i ögonvätskor .


![The Suzuki reaction {\displaystyle {\begin{matrix}{}\\{\ce {{R1-BY2}+R2-X->[{\underset {\text{catalyst}}{\text{Pd}}}][{\text{Base}}]R1-R2}}\\{}\end{matrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c35df36f38fec8abbc8e9d1d9f04e9b2687ae245)