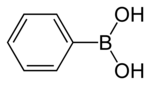
Fenylboronsyra
|
|
|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
Fenylboronsyra |
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| 970972 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.002.456 |
| EG-nummer |
|
| 3328 | |
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C 6 H 7 BO 2 | |
| Molar massa | 121,93 g/mol |
| Utseende | vitt till gult pulver |
| Odör | luktfri |
| Smältpunkt | 216 °C (421 °F; 489 K) |
| 10 g/L (20 ºC) | |
| Löslighet | löslig i dietyleter , etanol |
| Surhet (p K a ) | 8,83 |
| Termokemi | |
|
Std formationsentalpi ( Δ f H ⦵ 298 ) |
-719,6 kJ/mol |
| Faror | |
| GHS- märkning : | |

|
|
| Varning | |
| H302 | |
| P261 , P264 , P270 , P271 , P280 , P301+P312 , P302+P352 , P304+P340 , P305 +P351+P338, P312 , P321 , P332+ P330 , P330 , P31 , P330 , P330, 2 , P403 + P233 , P405 , P501 | |
| Dödlig dos eller koncentration (LD, LC): | |
|
LD 50 ( mediandos )
|
740 mg/ml (råtta, oral) |
| Säkerhetsdatablad (SDS) | [1] |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Fenylboronsyra eller bensenboronsyra , förkortat PhB (OH) 2 där Ph är fenylgruppen C6H5- , är en borsyra som innehåller en fenylsubstituent och två hydroxylgrupper bundna till bor . Fenylboronsyra är ett vitt pulver och används ofta i organisk syntes . Boronsyror är milda Lewis-syror som i allmänhet är stabila och lätta att hantera, vilket gör dem viktiga för organisk syntes.
Egenskaper
Fenylboronsyra är löslig i de flesta polära organiska lösningsmedel och är dåligt löslig i hexaner och koltetraklorid . Denna plana förening har idealiserad C 2V molekylär symmetri . Boratomen är sp 2 -hybridiserad och innehåller en tom p-orbital . De ortorombiska kristallerna använder vätebindning för att bilda enheter som består av två molekyler. Dessa dimera enheter kombineras för att ge ett utökat vätebundet nätverk . Molekylen är plan med en mindre böj runt CB-bindningen på 6,6° och 21,4° för de två PhB(OH) 2 -molekylerna.
Syntes
Det finns många metoder för att syntetisera fenylboronsyra. En av de vanligaste synteserna använder fenylmagnesiumbromid och trimetylborat för att bilda estern PhB(OMe) 2 , som sedan hydrolyseras till produkten.
- PhMgBr + B(OMe) 3 → PhB(OMe) 2 + MeOMgBr
- PhB(OMe) 2 + H 2 O → PhB(OH) 2 + MeOH
Andra vägar till fenylboronsyra involverar elektrofila borater för att fånga fenylmetallintermediärer från fenylhalider eller från riktad ortometallering . Fenylsilaner och fenylstannaner transmetallerar med BBr 3 , följt av hydrolys från fenylboronsyra. Arylhalider eller triflater kan kopplas med diboronylreagens med användning av övergångsmetallkatalysatorer. Aromatisk CH-funktionalisering kan också göras med hjälp av övergångsmetallkatalysatorer .
Reaktioner
Dehydreringen av boronsyror ger boroxiner , trimeranhydriderna av fenylboronsyra . Dehydreringsreaktionen drivs termiskt, ibland med ett dehydreringsmedel .
Fenylboronsyra deltar i många korskopplingsreaktioner där den fungerar som en källa till en fenylgrupp. Ett exempel är Suzuki-reaktionen där, i närvaro av en Pd(0) -katalysator och bas, kopplas fenylboronsyra och vinylhalider för att producera fenylalkener . Denna metod generaliserades till en väg som producerar biaryler genom att koppla fenylboronsyra med arylhalogenider.
CC-bindningsbildande processer använder vanligtvis fenylboronsyra som ett reagens. Alfa-aminosyror kan genereras med hjälp av den okatalyserade reaktionen mellan alfa-ketosyror , aminer och fenylboronsyra. Heck-typ korskoppling av fenylboronsyra och alkener och alkyner har visats.
Arylazider och nitroaromater kan också genereras från fenylboronsyra. Fenylboronsyra kan också regionselektivt halodeborerats med vattenhaltig brom , klor eller jod :
- PhB(OH) 2 + Br2 + H2O → PhBr + B(OH) 3 + HBr
Borsyraestrar är resultatet av kondensation av boronsyror med alkoholer . Denna omvandling är helt enkelt ersättningen av hydroxylgruppen med alkoxi- eller aryloxigrupper . Denna reversibla reaktion drivs vanligtvis till produkt genom användning av Dean-Stark-apparat eller ett dehydratiseringsmedel för att avlägsna vatten.
- PhB(OH) 2 + 2 ROH ⇌ PhB(OR) 2 + 2 H 2 O
Som en förlängning av denna reaktivitet kan PhB(OH) 2 användas som en skyddsgrupp för dioler och diaminer . Denna reaktivitet är grunden för användningen av fenylboronsyras användning som receptor och sensor för kolhydrater, antimikrobiella medel och enzymhämmare , neutroninfångningsterapi för cancer , transmembrantransport och biokonjugering och märkning av proteiner och cellytor.
Se även
Vidare läsning
- Brown, HC Organic Synthesis via Boranses , Wiley, New York, 1975.
- Matteson, DS Stereodirected Synthesis with Organoboranes , Springer, Berlin, 1995 . ISBN 978-3-540-59182-5
- Lappert, MF (1956). "Organiska föreningar av bor". Chem. Upps. 56 (5): 959–1064. doi : 10.1021/cr50011a002 .
- Pelter, A.; Smith, K.; Brown, HC Borane Reagents , Academic Press, New York, 1988.
- Mikhailov, BM; Bubnov, YN Organoboron Compounds in Organic Synthesis , Harwood Academics, Glasgow, 1984. ISBN 3-7186-0113-3
