Krom(III)pikolinat
|
|||
|
|
|||
| Namn | |||
|---|---|---|---|
|
IUPAC-namn
Tris(pikolinat)krom(III)
|
|||
| Identifierare | |||
|
3D-modell ( JSmol )
|
|
||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.131.423 | ||
|
PubChem CID
|
|||
| UNII | |||
|
CompTox Dashboard ( EPA )
|
|||
|
|||
|
|||
| Egenskaper | |||
| Cr ( C6H4NO2 ) 3 _ _ _ | |||
| Molar massa | 418,33 g/mol | ||
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|||
Krom(III) pikolinat är en kemisk förening med formeln Cr(C 5 H 4 N(CO 2 H)) 3 , vanligen förkortad som CrPic 3. Det säljs som ett näringstillskott för att behandla typ 2- diabetes och främja viktminskning. Denna klarröda koordinationsförening är härledd från krom (III) och pikolinsyra . Stora mängder krom behövs för insulinets glukosutnyttjande vid normal hälsa, men brist är extremt vanlig och har observerats hos personer som får 100 % av sitt näringsbehov intravenöst, dvs total parenteral näringsdiet . Krom har identifierats som reglerande insulin genom att öka känsligheten hos insulinreceptorn . Som sådan har krom(III)-pikolinat föreslagits som en behandling för typ 2- diabetes , även om dess effektivitet förblir kontroversiell på grund av motstridiga bevis från mänskliga försök.
Historia
En studie 1989 föreslog att krom(III)-pikolinat kan hjälpa till att gå ner i vikt och öka muskelmassan, vilket ledde till en ökning av användningen av krom(III)-pikolinattillskott, vilket resulterade i att det ett tag var det näst mest använda tillskottet bakom kalcium. En Cochrane-granskning från 2013 kunde inte hitta "tillförlitliga bevis för att informera fasta beslut" för att stödja sådana påståenden. Forskning har generellt visat att det förbättrar insulinkänsligheten genom att antingen förlänga dess aktivitet eller uppreglera produktionen av mRNA för att producera fler insulinreceptorer . [ citat behövs ]
Bland övergångsmetallerna är Cr 3+ den mest kontroversiella när det gäller näringsvärde och toxicitet. Denna kontrovers handlar om huruvida Cr 3+ ger några näringsmässiga fördelar. Dessutom förstärks denna kontrovers av det faktum att inga Cr-innehållande biomolekyler har fått sin struktur karakteriserad, och inte heller har verkningssättet bestämts. Det första experimentet som ledde till upptäckten av Cr 3+ som spelar en roll i glukosmetabolismen föreslog att den biologiskt aktiva formen av metallen fanns i ett protein som kallas glukostoleransfaktor , men nya bevis tyder på att det helt enkelt är en artefakt som erhållits från isolering förfaranden. Den enda accepterade indikatorn på krombrist är omkastningen av symtom som uppstår när krom(III)-tillskott administreras till personer med total parenteral näring .
Fysikalisk-kemiska egenskaper
Krom(III)-pikolinat är en rosaröd förening och rapporterades första gången 1917. Den är dåligt löslig i vatten och har en löslighet på 600 μM i vatten vid nära neutralt pH . I likhet med andra krom(III)-föreningar är det relativt inert och oreaktivt, vilket innebär att detta komplex är stabilt vid omgivningsförhållanden och höga temperaturer krävs för att sönderdela föreningen. Vid lägre pH-nivåer hydrolyserar komplexet för att frigöra pikolinsyra och fri Cr3 + .
Strukturera
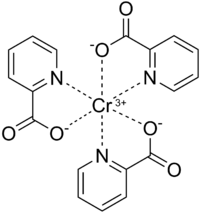
Krom(III)-pikolinat har en förvrängd oktaedrisk geometri och är isostrukturell mot kobolt (III) och mangan (III) motsvarigheter. Krom(III) är en hård Lewissyra och har som sådan hög affinitet till karboxylatsyren och medium affinitet till pyridinkvävet i pikolinat . Varje pikolinatligand fungerar som ett bidentat kelatbildande medel och neutraliserar +3-laddningen av Cr3 + . Bevis på att Cr 3+ centrumkoordinater till pyridinkvävet kommer från en förskjutning i IR-spektra för en C=N- vibration vid 1602,4 cm -1 för fri pikolinsyra till 1565,9 cm -1 för krom(III)-pikolinat. Bindningslängden mellan Cr3 + och kväveatomen i pyridinringen på picoliante sträcker sig från 2,047 till 2,048 Å . Picolinatliganden koordinerar till Cr 3+ endast när den deprotoneras och detta är uppenbart genom försvinnandet av IR-band som sträcker sig från 2400 till 2800 cm -1 (centrerat på 2500 cm -1 ) och 1443 cm -1 , vilket motsvarar OH-sträckningen och böjningen på den karboxylfunktionella gruppen. Dessutom indikerar detta IR-skifte också att endast en syreatom från karboxylatet av pikolinat koordinerar till Cr 3+ centrum. Cr-O-bindningslängden sträcker sig från 1,949 till 1,957 Å . Kristallstrukturen har bara nyligen beskrivits 2013. Vatten koordinerar inte till Cr 3+ -centrum och tros istället vätebinda mellan andra Cr(Pic) 3 -komplex för att bilda ett nätverk av Cr(Pic) 3 - komplex.
Biokemi av krom(III)pikolinat
Krom har identifierats som ett viktigt näringsämne för att upprätthålla normala blodsockernivåer och som sådan föreslås det interagera med två naturligt förekommande molekyler som finns i kroppen. Dessa interaktioner kommer troligen att ske genom koordination med hårda ligander som aspartat och glutamat, eftersom Cr(III) i sig är en hårdmetall.
Absorption och utsöndring av krom(III)pikolinat
När krom(III)-pikolinat väl har intagits och kommer in i magen , sker sur hydrolys av komplexet när det kommer i kontakt med magslemhinnan . Den hydrolyserade Cr 3+ är närvarande i hexaaqua-form och polymeriserar för att bilda en olöslig Cr(III)-hydroxid-oxid (oleringsprocessen) när den når det alkaliska pH-värdet i tunntarmen . Cirka 2 % av Cr 3+ absorberas genom tarmen som krom(III)-pikolinat via omättad passiv transport . Även om absorptionen är låg, absorberar CrPic 3 mer effektivt än andra organiska och oorganiska källor (dvs. CrCl 3 och kromnikotinat) och ackumuleras således i högre koncentrationer i vävnader. Detta har varit ett stort försäljningsargument för krom(III)-pikolinat jämfört med andra krom(III)-tillskott. Organiska källor tenderar att absorberas bättre eftersom de har ligander som är mer lipofila och vanligtvis neutraliserar laddningen av metallen, vilket möjliggör lättare passage genom tarmmembranet.
Det har också visat sig att kostfaktorer påverkar Cr 3+ absorptionen. Stärkelse , enkla sockerarter , oxalsyra och vissa aminosyror tenderar att öka absorptionshastigheten för krom(III). Detta är ett resultat av ligandkelering som omvandlar hexaaqua Cr 3+ till mer lipofila former. Däremot minskar kalcium, magnesium, titan, zink, vanadin och järn absorptionshastigheten. Förmodligen introducerar dessa joner nya metall-ligandjämvikter, vilket minskar den lipofila ligandpoolen tillgänglig för Cr3 + . När det väl har absorberats i blodomloppet förs 80 % av Cr 3+ från CrPic 3 vidare till transferrin. Den exakta mekanismen för frisättning är för närvarande okänd, men den antas dock inte ske genom en enda elektronreduktion, som i fallet med Fe3+, på grund av den höga instabiliteten hos Cr2 + . Administrerat Cr 3+ kan hittas i alla vävnader från 10 till 100 μg/kg kroppsvikt. Det utsöndras främst i urinen (80%) medan resten utsöndras i svett och avföring.
Bindning av krom(III) till transferrin
Transferrin , förutom kromodulin , har identifierats som ett viktigt fysiologiskt kromtransportmedel, även om en nyligen genomförd studie fann att Cr 3+ faktiskt hindrar transferrin från att fungera som ett metalljontransportmedel. Även om transferrin är mycket specifik för ferrijoner, vid normala förhållanden är endast 30 % av transferrinmolekylerna mättade med ferrijoner, vilket gör att andra metaller, särskilt de med ett stort förhållande mellan laddning och storlek, också kan binda. Bindningsställena består av en C-lob och en N-lob som är nästan identiska till sin struktur. Varje lob innehåller asparaginsyra , histidin , 2 tyrosinrester och en bikarbonatjon som fungerar som en bidentat ligand för att tillåta järn eller andra metaller att binda till transferrin i en förvrängd oktaedrisk geometri . Bevis som stöder bindningen av Cr 3+ till transferrin kommer från omfattande kliniska studier som visade en positiv korrelation mellan nivåer av ferritin och nivåer av fasteglukos , insulin och glykerat hemoglobin (Hb1Ac). Vidare visade en in vivo- studie på råttor att 80 % av isotopiskt märkt Cr 3+ hamnade på transferrin medan resten var bundna till albumin . En in vitro- studie visade att när krom(III)klorid tillsattes till isolerat transferrin, binds Cr 3+ lätt till transferrin, på grund av förändringar i UV-Vis-spektrumet. Bildningskonstanten för Cr 3+ i C-loben är 1,41 x 10 10 M −1 och 2,04 x 10 5 M −1 i N-loben, vilket indikerar att Cr 3+ företrädesvis binder C-loben. Sammantaget är bildningskonstanten för krom(III) lägre än den för ferrijonen. Bikarbonatliganden är avgörande för att binda Cr3 + eftersom när bikarbonatkoncentrationerna är mycket låga är bindningsaffiniteten också betydligt lägre. Studier av elektronparamagnetisk resonans (EPR) har visat att under pH 6 binder krom(III) endast till N-loben och att vid nära neutralt pH binder krom(III) även till C-loben. Krom(III) kan konkurrera med ferrijonen om bindning till C-loben när mättnaden kraftigt överstiger 30 %. Som sådana ses dessa effekter endast hos patienter med hemokromatos , en järnlagringssjukdom som kännetecknas av överdriven järnmättnad i transferrin.
Handlingsmekanism
Lågmolekylärt krombindande ämne (LMWCr; även känd som kromodulin) är en oligopeptid som verkar binda krom(III) i kroppen. Den består av fyra aminosyrarester; aspartat , cystein , glutamat och glycin , bundna med fyra (Cr3 + ) centra. Det interagerar med insulinreceptorn genom att förlänga kinasaktiviteten genom att stimulera tyrosinkinasvägen, vilket leder till förbättrad glukosabsorption. Det har förväxlats med glukostoleransfaktor . Trots senaste försök att karakterisera kromodulin är den exakta strukturen fortfarande relativt okänd.
Även om kromodulins exakta verkningsmekanism på insulinreceptorn för närvarande är okänd, presenteras en vanligen beskriven mekanism nedan. Denna föreslagna mekanism har den högsta graden av överensstämmelse med olika experiment som involverar kromodulin.
Normalt finns kromodulin i apochromodulinformen, som är fri från Cr(III)-joner och har minimal aktivitet på insulinreceptorer. Apochromodulinet lagras i insulinkänsliga celler i kärnan. När blodsockernivåerna stiger insulin i blodomloppet och binder till en extern α-subenhet av insulinreceptorn, ett transmembranprotein . Insulinreceptorn består av 2 extracellulära α-subenheter och 2 transmembrana β-subenheter. Så snart insulin binder till insulinreceptorn sker en konformationsförändring i receptorn, vilket gör att alla 3 tyrosinrester (som finns i β-subenheterna) blir fosforylerade. Detta aktiverar receptorn och gör att den kan överföra signalen från insulin till cellen. Som nämnts ovan avger absorberat krom(III)-pikolinat så småningom Cr 3+ till transferrin. Transferrin transporterar i sin tur Cr 3+ till insulinkänsliga celler (dvs adipocyter ) där det binder till apochromodulin för att bilda holochromodulin. Holochromodulin binder till insulinreceptorn, vilket hjälper till att bibehålla insulinreceptorns aktiva konformation genom att förlänga kinasaktiviteten hos kinaser eller uppreglera mängden insulinreceptor- mRNA -nivåer, och därmed minska blodsockernivåerna.
Experiment kunde visa att krom(III) kunde uppreglera insulinstimulerad insulinsignaltransduktion genom att påverka nedströms molekyler av IR, vilket framgår av ökade nivåer av tyrosinfosforylering av IRS-1, förhöjd Thr308- och Ser473 - fosforylering av Akt och ökad PI3-K -aktivitet i en mängd olika cellulära och djurmodeller. Den ökade IRS-1-fosforyleringen ledde till ökad insulinreceptorkänslighet medan Akt och PI3-K ledde till ökad GLUT4- translokation till cellytan, vilket orsakade större upptag av glukos.
Det har också visat sig att krom(III) kan lindra insulinresistens genom att minska stress i endoplasmatisk retikulum (ER). ER-stress definieras som en ansamling av felveckade och oveckade proteiner i ER-lumen. ER-stress leder till stimulering av c-Jun-terminalt kinas ( JNK ), som i sin tur fosforylerar serinresten av IRS, vilket leder till undertryckande av insulinsignaleringskaskaden och mindre glukosupptag. Experimentella fynd tyder på att krom hämmar ER-stress och därför höjs undertryckandet av insulinsignalering. Den exakta mekanismen är okänd.
Ett annat sätt som Cr(III) kan förlänga insulinreceptorns kinasaktivitet är genom oxidation av en kritisk aktiv cysteinrest på proteintyrosinfosfatas 1B ( PTP1B ). Normalt defosforylerar PTP1B fosfotyrosinrester genom att utföra nukleofila attacker på fosfatgruppen via dess cysteinrester, vilket inaktiverar insulinreceptorn. Denna process tar bort fosfatgruppen från tyrosinresten för att bilda en Cys—S—PO 3 2−- grupp som därefter hydrolyseras av vatten för att regenerera cysteinresten, vilket möjliggör ytterligare en omgång av verkan. Forskning har visat att krom(III) faktiskt kan orsaka irreversibel hämning av PTP1B. Man tror att Cr(III) omvandlas till Cr(VI) eller Cr(V) (genom inverkan av oxidoreduktaser ) som sedan oxiderar tiolen i cysteinresten på PTP1B till sulfensyra , vilket gör den oförmögen att angripa fosfatet. grupp på fosfotyrosin. Detta är dock bara en rimlig mekanism, och inga direkta bevis har visat sig stödja denna hypotes. När signalkaskaden stängs av elimineras holochromodulin i urinen eftersom bildningskonstanten är för stor för att avlägsna Cr(III) direkt. Experimentella bevis har visat att förlusten av kromodulin från celler är korrelerad med en ökning av kromkoncentrationer i urinen efter att ha intagit mat rik på kolhydrater (dvs. glukos).
Hälsopåståenden och debatter
Kroppsvikt
Chromium(III) picolinate har marknadsförts i USA som ett hjälpmedel för kroppsutveckling för idrottare och som ett sätt att gå ner i vikt . Recensioner har rapporterat antingen ingen effekt på vare sig muskeltillväxt eller fettförlust, eller också en blygsam men statistiskt signifikant viktminskning på -1,1 kg (2,4 lb) i försök längre än 12 veckor. Europeiska myndigheten för livsmedelssäkerhet granskade litteraturen och drog slutsatsen att det inte fanns tillräckliga bevis för att stödja ett påstående.
Diabetes
Det finns påståenden om att pikolinatformen av kromtillskott hjälper till att minska insulinresistens och förbättra glukosmetabolismen, särskilt hos typ 2- diabetiker , men recensioner visade inget samband mellan krom- och glukos- eller insulinkoncentrationer för icke-diabetiker, och ofullständiga resultat för diabetiker. Författarna till den andra recensionen nämnde att krompicolinat minskade HbA1c- nivåerna med 0,7 % hos patienter med typ 2-diabetes, de observerade att studier av dålig kvalitet gav större positiva resultat än studier av högre kvalitet. Två recensioner drog slutsatsen att krom(III)-pikolinat kan vara mer effektivt för att sänka blodsockernivåerna jämfört med andra kosttillskott som innehåller krom.
År 2005 godkände US Food and Drug Administration (FDA) ett kvalificerat hälsopåstående för krompicolinat som ett kosttillskott relaterat till insulinresistens och risk för typ 2-diabetes. Alla företag som vill göra ett sådant påstående måste använda den exakta formuleringen: "En liten studie tyder på att krompicolinat kan minska risken för insulinresistens och därför eventuellt kan minska risken för typ 2-diabetes. FDA drar dock slutsatsen att existensen om ett sådant samband mellan krompicolinat och antingen insulinresistens eller typ 2-diabetes är mycket osäkert." Som en del av granskningsprocessen för framställningar avvisade FDA andra påståenden om att minska onormalt förhöjt blodsocker, risk för hjärt-kärlsjukdom, risk för retinopati eller risk för njursjukdom. 2006 tillade FDA att "sambandet mellan intag av krom(III) pikolinat och insulinresistens är mycket osäkert".
Variabilitet av studier
Det observerades ingen konsistens i kliniska resultat som relaterade krom(III)-pikolinat till adekvat behandling av typ 2-diabetes. Detta beror på graden av glukosintolerans hos patienter som deltar i de kliniska studierna. Glukosintolerans är en gradient och intensiteten påverkas av etnicitet, grad av fetma, ålder, fördelning av kroppsfett och många andra faktorer. I vissa studier gavs låga doser av tillägget, men en lämplig mängd krom(III)-pikolinat måste administreras till en person innan någon märkbar minskning av glukosnivåerna observeras på grund av olika nivåer av insulinresistens. En annan viktig punkt att nämna är att diabetes inte alltid orsakas av glukosintolerans. Som tidigare nämnts har Cr(III) visat sig endast påverka glukosintolerans och inte insulinnivåer. Dessutom var miljöerna där studierna utfördes inte konsekventa. Nivåerna av stress, dieter som konsumerades av patienter och patientgenetik var varierande bland studieämnen. Detta gäller även kontrollerna bland olika studier där patienter som har diabetes redan behandlades med en mängd olika antidiabetiska läkemedel, vilket kan minska effekterna av krom på att påverka insulinaktiviteten. Detta kan förklara varför djurstudier tenderar att ge mer positiva resultat på grund av att dessa diabetiska djur inte behandlades med antidiabetiska läkemedel för kontrollgruppen. Dessutom, som nämnts i avsnittet om absorption och utsöndring, påverkas absorptionen/biotillgängligheten av krom(III)-pikolinat av kosten. Sammantaget har dessa olika faktorer bidragit till variabiliteten i studierna.
Säkerhet och toxicitet
Initial oro togs upp att krom(III)-pikolinat är mer sannolikt att orsaka DNA-skador och mutationer än andra former av trivalent krom, men dessa resultat diskuteras också. Dessa farhågor baserades delvis på studier på fruktflugor, där krom(III)-pikolinattillskott genererar kromosomavvikelser, hämmar avkommans utveckling och orsakar sterilitet och dödliga mutationer.
En studie publicerades för att bedöma toxiciteten av Cr(III) pikolinat på människor. Forskarna som genomförde denna studie använde tidigare kunskap om att Cr(III) reduceras till Cr(II) av cellreduktanter som NADH eller cystein . Denna reducerade form av Cr(II) har visat sig reagera med H 2 O 2 för att generera radikala arter som i sin tur oxiderar DNA-baspar . Med denna kunskap i åtanke administrerade forskarna tio kvinnor med 400 μg krom(III) pikolinat om dagen under en åtta veckors period. Genom att mäta mängden av ett oxiderat DNA-baspar, 5-hydroximetyluracil, med användning av antikroppstitrar , kunde gruppen sluta sig till mängden DNA-basparoxidation som inträffar i direkt relation till krom(III)-pikolinat. Resultaten av studien antydde att krom(III)-pikolinat i sig inte orsakar signifikant kromosomskada in vivo .
Generellt sett har det visat sig att krom(III)pikolinat inte är giftigt för människor. För de flesta vuxna kan det tas oralt i doser upp till 1000 μg per dag. Denna låga toxicitet har i allmänhet associerats med låg absorbans av Cr(III) i kroppen genom lungorna , huden och mag-tarmkanalen , i kombination med hög utsöndring. Normalt kan 99 % av intaget krom(III) återvinnas i användarens avföring. Det har förekommit isolerade fall [ stavning? ] av krom(III)-tillskott som leder till njursvikt, men detta samband är oklart och har ännu inte testats.
Reglering av krom(III)pikolinat
År 2004 rådde UK Food Standards Agency konsumenter att använda andra former av trevärt krom framför krom(III)-pikolinat tills specialistråd erhölls från kommittén för mutagenicitet. Detta berodde på farhågor som tagits upp av expertgruppen för vitaminer och mineraler att krom(III)-pikolinat kan vara genotoxiskt (orsaka cancer). Kommittén noterade också två fallrapporter om njursvikt som kan ha orsakats av detta tillägg och efterlyste ytterligare forskning om dess säkerhet. I december 2004 publicerade kommittén för mutagenicitet sina slutsatser, som drog slutsatsen att "överlag kan man dra slutsatsen att balansen av uppgifterna tyder på att krom(III)-pikolinat inte bör anses vara mutagent in vitro" och att "den tillgängliga i -vivo-tester på däggdjur med krom(III)pikolinat är negativa". Efter dessa upptäckter drog UK Food Standards Agency tillbaka sitt råd att undvika krom(III)-pikolinat, även om man planerar att hålla sina råd om kromtillskott under översyn.
2010 godkändes krom(III)-pikolinat av Health Canada för att användas i kosttillskott. Godkända märkningsuppgifter inkluderar: en faktor för att upprätthålla god hälsa, ger stöd för en sund glukosmetabolism, hjälper kroppen att metabolisera kolhydrater och hjälper kroppen att metabolisera fetter.
externa länkar
-
 Media relaterade till Chromium(III) picolinate på Wikimedia Commons
Media relaterade till Chromium(III) picolinate på Wikimedia Commons - Merck manual






