EZH2
| EZH2 | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identifierare | |||||||||||||||||||||||||||||||||||||||||||||||
| , ENX-1, ENX1, EZH1, EZH2b, KMT6, KMT6A, WVS, WVS2, förstärkare av zeste 2 polycomb repressivt komplex 2 subenhet | |||||||||||||||||||||||||||||||||||||||||||||||
| Externa IDs | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Enhancer of zeste homolog 2 (EZH2) är ett histon-lysin-N-metyltransferasenzym ( EC 2.1.1.43 ) kodat av EZH2 -genen , som deltar i histonmetylering och, slutligen, transkriptionell repression . EZH2 katalyserar tillägget av metylgrupper till histon H3 vid lysin 27, genom att använda kofaktorn S-adenosyl-L-metionin . Metyleringsaktivitet av EZH2 underlättar heterokromatinbildning och tystar därigenom genens funktion. Ombyggnad av kromosomalt heterokromatin med EZH2 krävs också under cellmitos.
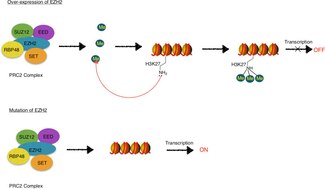
EZH2 är den funktionella enzymatiska komponenten i Polycomb Repressive Complex 2 ( PRC2 ), som är ansvarig för frisk embryonal utveckling genom det epigenetiska underhållet av gener som är ansvariga för att reglera utveckling och differentiering . EZH2 är ansvarig för metyleringsaktiviteten av PRC2, och komplexet innehåller också proteiner som krävs för optimal funktion ( EED , SUZ12 , JARID2 , AEBP2 , RbAp46/48 och PCL ).
Mutation eller överuttryck av EZH2 har kopplats till många former av cancer. EZH2 hämmar gener som är ansvariga för att undertrycka tumörutveckling, och blockering av EZH2-aktivitet kan bromsa tumörtillväxt. EZH2 har varit inriktat på hämning eftersom det är uppreglerat i flera cancerformer inklusive, men inte begränsat till, bröst-, prostata- , melanom och blåscancer. Mutationer i EZH2-genen är också associerade med Weavers syndrom , en sällsynt medfödd sjukdom, och EZH2 är involverad i att orsaka neurodegenerativa symtom i nervsystemets störning, ataxi telangiectasia .
Fungera
| Histon-lysin-N-metyltransferas- | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| identifierare | |||||||||
| EG nr. | 2.1.1.43 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA inträde | ||||||||
| ExPASy | NiceZyme-vy | ||||||||
| KEGG | KEGG inträde | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB- strukturer | RCSB PDB PDBe PDB summa | ||||||||
| |||||||||
EZH2 är den katalytiska subenheten av Polycomb Repressive Complex 2 (PRC2). EZH2:s katalytiska aktivitet är beroende av dess bildning av ett komplex med minst två andra PRC2-komponenter, SUZ12 och EED . Som histonmetyltransferas (HMTase) är EZH2:s primära funktion att metylera Lys-27 på histon 3 (H3K27me) genom att överföra en metylgrupp från kofaktorn S-adenosyl-L-metionin (SAM). EZH2 kan mono-, di- och trimetylering av H3K27 och har associerats med en mängd olika biologiska funktioner, inklusive transkriptionell reglering i hematopoiesis , utveckling och celldifferentiering .
Nyligen genomförda studier har visat att EZH2 också kan metylera icke- histonproteiner .
Transkriptionsförtryck
EZH2, som en del av PRC2, katalyserar trimetylering av H3K27 ( H3K27me3 ), vilket är en histonmodifiering som har karakteriserats som en del av histonkoden . Histonkoden är teorin om att kemiska modifieringar, såsom metylering , acetylering och ubiquitinering , av histonproteiner spelar utmärkande roller i epigenetisk reglering av gentranskription . EZH2-medierad katalys av H3K27me3 är associerad med långvarig transkriptionsrepression.
EZH2, liksom andra Polycomb-gruppproteiner, är involverade i att etablera och upprätthålla genrepression genom celldelning . Detta transkriptionellt repressiva tillstånd tros bero på PRC2/EZH2-EED-medierad H3K27-metylering och efterföljande rekrytering av PRC1 vilket underlättar kondensation av kromatin och bildning av heterokromatin . Heterokromatin är tätt packat kromatin som begränsar transkriptionsmaskineriets tillgänglighet till det underliggande DNA:t och därigenom undertrycker transkription.
Under celldelning krävs heterokromatinbildning för korrekt kromosomsegregering . PRC2/EED-EZH2-komplex kan också vara involverat i rekryteringen av DNA-metyltransferaser ( DNMTs ), vilket resulterar i ökad DNA-metylering , ett annat epigenetiskt lager av transkriptionsrepression. Specifika gener som har identifierats som mål för EZH2-medierad transkriptionell repression inkluderar HOXA9 , HOXC8 , MYT1 , CDKN2A och retinsyramålgener .
Transkriptionsaktivering
I cancer kan EZH2 spela en roll vid aktivering av transkription, oberoende av PRC2 . I bröstcancerceller har EZH2 visats aktivera NF-KB- målgener, som är involverade i svar på stimuli. Den funktionella rollen för denna aktivitet och dess mekanism är fortfarande okända.
Utveckling och celldifferentiering
EZH2 spelar en viktig roll i utvecklingen. I synnerhet hjälper det till att kontrollera transkriptionell repression av gener som reglerar celldifferentiering. I embryonala stamceller verkar EZH2-medierad trimetylering av H3K27me3 i regioner som innehåller utvecklingsgener vara viktig för att upprätthålla normal celldifferentiering. H3K27me3 är också viktigt för att driva X-inaktivering , tystnad av en X-kromosom hos kvinnor under utveckling. Under X-inaktivering tror man att EZH2 är involverad i att initiera heterokromatinbildning genom att trimetylera H3K27 och att andra histonmetyltransferaser och histonmärken kan vara involverade i att bibehålla det tystade tillståndet.
Vidare har EZH2 identifierats som ett viktigt protein involverat i utveckling och differentiering av B-celler och T-celler . H3K27me3 är involverad i att undertrycka gener som främjar differentiering, vilket upprätthåller ett odifferentierat tillstånd av B- och T-celler och spelar en viktig roll för att reglera hematopoiesis .
Reglering av EZH2-aktivitet
Aktiviteten hos EZH2 regleras av post-translationell fosforylering av treonin- och serinrester på EZH2. Specifikt fosforylering av T350 kopplats till en ökning av EZH2-aktivitet medan fosforylering av T492 och S21 har kopplats till en minskning av EZH2-aktivitet. Fosforylering av T492 har föreslagits störa kontakter mellan human EZH2 och dess bindningspartners i PRC2-komplexet, vilket hindrar dess katalytiska aktivitet.
Förutom fosforylering har det också visats att PRC2/EZH2-EED-aktivitet antagoniseras av transkriptionsaktiverande histonmärken, såsom acetylering av H3K27 ( H3K27ac ) och metylering av H3K36 ( H3K36me ).
EZH2-uttryck regleras av östrogensignalering i humant normalt bröstepitel och humana bröstcancer.
Enzymatisk aktivitet
EZH2-funktionen är starkt beroende av dess rekrytering av PRC2-komplexet. I synnerhet behövs WD40-upprepad protein embryonal ektodermutveckling (EED) och zinkfingerproteinsuppressor av zeste 12 (SUZ12) för att stabilisera interaktionen av EZH2 med dess histonsubstrat. Nyligen har två isoformer av EZH2 genererade från alternativ splitsning identifierats i människor: EZH2α och EZH2β. Båda isoformerna innehåller element som har identifierats som viktiga för EZH2-funktionen inklusive den nukleära lokaliseringssignalen , EED- och SUZ12-bindningsställena såväl som den konserverade SET-domänen. De flesta studier har hittills fokuserat på den längre isoformen EZH2α, men EZH2β, som saknar exon 4 och 8, har visat sig vara aktiv. Vidare verkar PRC2/EZH2β-komplex på olika gener från dess PRC2/EZH2α-motsvarighet, vilket tyder på att varje isoform kan verka för att reglera en specifik undergrupp av gener. Ytterligare bevis tyder på att EZH2 också kan vara kapabel till lysinmetylering oberoende av association med PRC2, när EZH2 är starkt uppreglerad.
Lysinmetylering
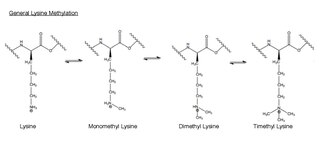
Metylering är tillsatsen av en -CH3 , eller metylgrupp, till en annan molekyl. Inom biologin katalyseras metylering vanligtvis av enzymer, och metylgrupper tillsätts vanligtvis till antingen proteiner eller nukleinsyror. Vid EZH2-katalyserad metylering metyleras aminosyran lysin i histonen h3. Denna aminosyrarest kan metyleras upp till tre gånger på sin terminala ammoniumgrupp . Dessa metylerade lysiner är viktiga i kontrollen av däggdjursgenexpression och har en funktionell roll i heterokromatinbildning , X-kromosominaktivering och transkriptionsreglering. I däggdjurskromosomer kan histonlysinmetylering antingen aktivera eller undertrycka gener beroende på metyleringsstället. Nyligen arbete har visat att åtminstone en del av den tystande funktionen hos EZH2-komplexet är metyleringen av histon H3 på lysin 27. Metylering och andra modifieringar äger rum på histonerna. Metylmodifieringar kan påverka bindningen av proteiner till dessa histoner och antingen aktivera eller hämma transkription .
Katalysmekanism
EZH2 är en medlem av SET- domänfamiljen av lysinmetyltransferaser som fungerar för att lägga till metylgrupper till lysinsidokedjor av substratproteiner . SET-metyltransferaser är beroende av en S-Adenosylmetionin (SAM) kofaktor för att fungera som en metyldonator för deras katalytiska aktivitet. SET-domänproteiner skiljer sig från andra SAM-beroende metyltransferaser genom att de binder deras substrat och SAM-kofaktor på motsatta sidor av enzymets aktiva ställe . Denna orientering av substrat och kofaktor tillåter SAM att dissociera utan att störa substratbindning och kan leda till flera omgångar av lysinmetylering utan substratdissociation.
Även om varken en substratbunden eller SAM-bunden kristallstruktur för EZH2 har bestämts, visar STAMP-strukturanpassning med det humana SET7/9-metyltransferaset konserverade tyrosinrester i nästan identiska positioner inom det förmodade aktiva stället för EZH2.
Det hade tidigare föreslagits att tyrosin 726 i det aktiva stället EZH2 fungerade som en allmän bas för att deprotonera substratet lysin, men kinetiska isotopeffekter har indikerat att rester av det aktiva stället inte är direkt involverade i kemin av metyltransferasreaktionen. Istället stöder dessa experiment en mekanism i vilken resterna sänker pKa för substratets lysinrest samtidigt som de tillhandahåller en kanal för vatten för att komma åt lysinsidokedjan i det inre av det aktiva stället. Lösningsmedelsvatten i bulk kan sedan lätt deprotonera lysinsidokedjan, aktivera den för nukleofil attack av SAM-kofaktorn i en S N 2 -liknande reaktion som resulterar i överföring av metylgruppen från SAM till lysinsidokedjan.
EZH2 katalyserar primärt mono- och dimetylering av H3K27 men en kliniskt relevant mutation av rest tyrosin 641 till fenylalanin (Y641F) resulterar i högre H3K27-trimetyleringsaktivitet. Det föreslås att avlägsnandet av hydroxylgruppen på Y641 upphäver steriskt hinder och möjliggör ackommodation av en tredje metylgrupp på substratet lysin.
Klinisk signifikans
Cancer
EZH2 är ett attraktivt mål för anti-cancerterapi eftersom det hjälper cancerceller att dela sig och föröka sig. Det finns i större mängder än i friska celler i ett brett spektrum av cancerformer inklusive cancer i bröst, prostata, urinblåsa, livmoder och njure , såväl som melanom och lymfom . EZH2 är en gensuppressor , så när den blir överuttryckt stängs många tumörsuppressorgener som normalt är påslagna av. Hämning av EZH2-funktion krymper maligna tumörer i vissa rapporterade fall eftersom dessa tumörsuppressorgener inte tystas av EZH2. EZH2 uttrycks vanligtvis inte hos friska vuxna; det finns bara i aktivt delande celler, som de som är aktiva under fosterutvecklingen. På grund av denna egenskap kan överuttryck av EZH2 användas som en diagnostisk markör för cancer och vissa neurodegenerativa störningar. Det finns dock fall där det är svårt att avgöra om överuttryck av EZH2 är orsaken till en sjukdom, eller helt enkelt en konsekvens. Om det bara är en konsekvens kan inriktning på EZH2 för hämning inte bota sjukdomen. Ett exempel på en cancerväg där EZH2 spelar en roll är pRB-E2F-vägen. Det är nedströms från pRB-E2F- vägen, och signaler från denna väg leder till EZH2-överuttryck. En annan viktig egenskap hos EZH2 är att när EZH2 överuttrycks kan det aktivera gener utan att bilda PRC2 . Detta är ett problem eftersom det betyder att enzymets metyleringsaktivitet inte medieras av komplexbildning. I bröstcancerceller aktiverar EZH2 gener som främjar cellproliferation och överlevnad. Det kan också aktivera regulatoriska gener som c-myc och cyclin D1 genom att interagera med Wnt-signalfaktorer . Viktigt är att mutationen av tyrosin 641 i den aktiva SET-domänen till ett antal olika aminosyror är en vanlig egenskap hos vissa B-cellslymfom.
Inhibitorer
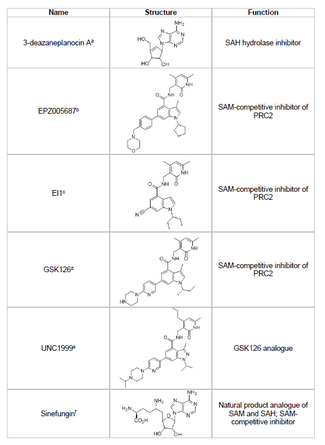
Att utveckla en hämmare av EZH2 och förhindra oönskad histonmetylering av tumörsuppressorgener är ett livskraftigt område för cancerforskning. Utvecklingen av EZH2-hämmare har fokuserat på att rikta in sig på det SET-domänen för proteinet. Flera hämmare av EZH2 har utvecklats från och med 2015, inklusive 3-deazaneplanocin A (DZNep), EPZ005687, EI1, GSK126 och UNC1999.
- DZNep
- DZNep har potentiella antivirala och anticanceregenskaper eftersom det sänker EZH2-nivåerna och inducerar apoptos i bröst- och tjocktarmscancerceller. DZNep hämmar hydrolysen av S-adenosyl-L-homocystein (SAH), som är en produktbaserad hämmare av alla proteinmetyltransferaser, vilket leder till ökade cellulära koncentrationer av SAH som i sin tur hämmar EZH2. DZNep är dock inte specifik för EZH2 och hämmar även andra DNA-metyltransferaser.
- EPZ005687
- År 2012 avslöjade ett företag som heter Epizyme EPZ005687, en S-adenosylmetionin ( SAM ) kompetitiv hämmare som är mer selektiv än DZNep; den har en 50-faldig ökning i selektivitet för EZH2 jämfört med EZH1 . Läkemedlet blockerar EZH2-aktivitet genom att binda till SET-domänens aktiva ställe för enzymet. EPZ005687 kan också hämma Y641- och A677-mutanterna av EZH2, vilket kan vara tillämpligt för behandling av non-Hodgkins lymfom.
- Tazemetostat
- Under 2013 påbörjade Epizyme kliniska fas I-prövningar med en annan EZH2-hämmare, tazemetostat (EPZ-6438), för patienter med B-cellslymfom. År 2020 tazemetostat , med handelsnamnet Tazverik, ett FDA- accelererat godkännande för behandling av metastaserande eller lokalt avancerad epiteloid sarkom [ citat behövs ] och ett accelererat godkännande för behandling av patienter med återfallande follikulärt lymfom senare samma år.
- Sinefungin
- Sinefungin är en annan SAM-kompetitiv hämmare, men som DZNep är den inte specifik för EZH2. Det fungerar genom att binda i kofaktorbindningsfickan av DNA-metyltransferaser för att blockera metylöverföring. EI1 är en annan hämmare, utvecklad av Novartis , som visade EZH2-hämmande aktivitet i lymfomtumörceller, inklusive celler med Y641-mutationen. Mekanismen för denna inhibitor involverar också att konkurrera med SAM-kofaktorn för bindning till EZH2.
- GSK126
- GSK126 är en potent, SAM-kompetitiv EZH2-hämmare utvecklad av GlaxoSmithKline , som har 150-faldig selektivitet över EZH1 och ett Ki på 0,5-3 nM. UNC1999 utvecklades som en analog till GSK126 och var den första oralt biotillgängliga EZH2-hämmaren som visade aktivitet. Den är dock mindre selektiv än sin motsvarighet GSK126, och den binder också till EZH1, vilket ökar potentialen för effekter utanför målet.
Kombinationsterapier studeras som möjliga behandlingar när primärbehandlingar börjar misslyckas. Etoposid , en topoisomerasinhibitor , i kombination med en EZH2-hämmare, blir mer effektiv för icke-småcellig lungcancer med BRG1- och EGFR -mutationer. Emellertid kan EZH2- och lysinmetylering ha tumörundertryckande aktivitet, till exempel vid myelodysplastiskt syndrom , vilket indikerar att EZH2-hämning kanske inte är fördelaktigt i alla fall.
Weavers syndrom
Mutationer i EZH2-genen har kopplats till Weavers syndrom , en sällsynt sjukdom som kännetecknas av framskriden benålder, makrocefali och hypertelorism . Histidinresten på det aktiva stället av vildtyp EZH2 muterades till tyrosin hos patienter som diagnostiserades med Weavers syndrom . Mutationen stör sannolikt kofaktorbindningen och orsakar störningar av proteinets naturliga funktion.
Taxonomisk fördelning

Förstärkare av zeste (E(z)) identifierades ursprungligen i Drosophila melanogaster , och dess däggdjurshomologer identifierades därefter och benämndes EZH1 (förstärkare av zeste homolog 1) och EZH2 (förstärkare av zeste homolog 2). EZH2 är mycket konserverat genom evolutionen . Det och dess homologer spelar viktiga roller i utveckling, celldifferentiering och celldelning hos växter, insekter, fiskar och däggdjur. Följande taxonomiska träd är en skildring av EZH2:s utbredning över en mängd olika arter.
Se även
Vidare läsning
- Zeidler M, Kleer CG (september 2006). "The Polycomb group protein Enhancer of Zeste 2: dess kopplingar till DNA-reparation och bröstcancer". Journal of Molecular Histology . 37 (5–7): 219–223. doi : 10.1007/s10735-006-9042-9 . PMID 16855786 . S2CID 2332105 .
- De Haan G, Gerrits A (juni 2007). "Epigenetisk kontroll av hematopoetisk stamcells åldrande fallet med Ezh2". Annals of the New York Academy of Sciences . 1106 (1): 233–239. Bibcode : 2007NYASA1106..233D . doi : 10.1196/annals.1392.008 . PMID 17332078 . S2CID 25177748 .
- Hobert O, Jallal B, Ullrich A (juni 1996). "Interaktion av Vav med ENX-1, en förmodad transkriptionell regulator av homeobox-genuttryck" . Molekylär och cellulär biologi . 16 (6): 3066–3073. doi : 10.1128/MCB.16.6.3066 . PMC 231301 . PMID 8649418 .
- Bonaldo MF, Lennon G, Soares MB (september 1996). "Normalisering och subtraktion: två metoder för att underlätta genupptäckt" . Genomforskning . 6 (9): 791-806. doi : 10.1101/gr.6.9.791 . PMID 8889548 .
- Abel KJ, Brody LC, Valdes JM, Erdos MR, McKinley DR, Castilla LH, et al. (oktober 1996). "Karakterisering av EZH1, en human homolog av Drosophila Enhancer av zeste nära BRCA1" . Genomik . 37 (2): 161–171. doi : 10.1006/geno.1996.0537 . PMID 8921387 .
- Laible G, Wolf A, Dorn R, Reuter G, Nislow C, Lebersorger A, et al. (juni 1997). "Däggdjurshomologer av polycomb-gruppgenen Enhancer of zeste medierar gentystnad i Drosophila heterochromatin och vid S. cerevisiae telomerer" . EMBO Journal . 16 (11): 3219–3232. doi : 10.1093/emboj/16.11.3219 . PMC 1169939 . PMID 9214638 .
- Cardoso C, Timsit S, Villard L, Khrestchatisky M, Fontès M, Colleaux L (april 1998). "Specifik interaktion mellan XNP/ATR-X-genprodukten och SET-domänen för det humana EZH2-proteinet" . Human molekylär genetik . 7 (4): 679–684. doi : 10.1093/hmg/7.4.679 . PMID 9499421 .
- van Lohuizen M, Tijms M, Voncken JW, Schumacher A, Magnuson T, Wientjens E (juni 1998). "Interaktion mellan mus polycomb-grupp (Pc-G) proteiner Enx1 och Enx2 med Eed: indikation för separata Pc-G komplex" . Molekylär och cellulär biologi . 18 (6): 3572–3579. doi : 10.1128/MCB.18.6.3572 . PMC 108938 . PMID 9584197 .
- Sewalt RG, van der Vlag J, Gunster MJ, Hamer KM, den Blaauwen JL, Satijn DP, et al. (juni 1998). "Karakterisering av interaktioner mellan däggdjurspolykamgruppsproteinerna Enx1/EZH2 och EED antyder förekomsten av olika däggdjurspolykamgruppproteinkomplex" . Molekylär och cellulär biologi . 18 (6): 3586–3595. doi : 10.1128/mcb.18.6.3586 . PMC 108940 . PMID 9584199 .
- Denisenko O, Shnyreva M, Suzuki H, Bomsztyk K (oktober 1998). "Punktmutationer i WD40-domänen av Eed blockerar dess interaktion med Ezh2" . Molekylär och cellulär biologi . 18 (10): 5634–5642. doi : 10.1128/MCB.18.10.5634 . PMC 109149 . PMID 9742080 .
- van der Vlag J, Otte AP (december 1999). "Transkriptionell repression förmedlad av det mänskliga polycomb-gruppproteinet EED involverar histondeacetylering". Naturgenetik . 23 (4): 474–478. doi : 10.1038/70602 . PMID 10581039 . S2CID 6748531 .
- Cardoso C, Mignon C, Hetet G, Grandchamps B, Fontes M, Colleaux L (mars 2000). "Den mänskliga EZH2-genen: genomisk organisation och reviderad kartläggning i 7q35 inom den kritiska regionen för maligna myeloidsjukdomar" . European Journal of Human Genetics . 8 (3): 174–180. doi : 10.1038/sj.ejhg.5200439 . PMID 10780782 .
- Raaphorst FM, Otte AP, van Kemenade FJ, Blokzijl T, Fieret E, Hamer KM, et al. (maj 2001). "Distinkt BMI-1 och EZH2 uttrycksmönster i tymocyter och mogna T-celler tyder på en roll för Polycomb-gener i human T-cellsdifferentiering" . Journal of Immunology . 166 (10): 5925–5934. doi : 10.4049/jimmunol.166.10.5925 . PMID 11342607 .
- O'Connell S, Wang L, Robert S, Jones CA, Saint R, Jones RS (november 2001). "Polycomblike PHD-fingrar förmedlar konserverad interaktion med förstärkare av zesteprotein" . Journal of Biological Chemistry . 276 (46): 43065–43073. doi : 10.1074/jbc.M104294200 . PMID 11571280 .
- Varambaly S, Dhanasekaran SM, Zhou M, Barrette TR, Kumar-Sinha C, Sanda MG, et al. (oktober 2002). "Polycomb-gruppproteinet EZH2 är involverat i utvecklingen av prostatacancer". Naturen . 419 (6907): 624–629. Bibcode : 2002Natur.419..624V . doi : 10.1038/nature01075 . hdl : 2027.42/62896 . PMID 12374981 . S2CID 4414767 .
- Kleer CG, Cao Q, Varambaly S, Shen R, Ota I, Tomlins SA, et al. (september 2003). "EZH2 är en markör för aggressiv bröstcancer och främjar neoplastisk transformation av bröstepitelceller" . Proceedings of the National Academy of Sciences of the United States of America . 100 (20): 11606–11611. Bibcode : 2003PNAS..10011606K . doi : 10.1073/pnas.1933744100 . PMC 208805 . PMID 14500907 .