Phytanoyl-CoA dioxygenas
| phytanoyl-CoA dioxygenas | |||||||||
|---|---|---|---|---|---|---|---|---|---|
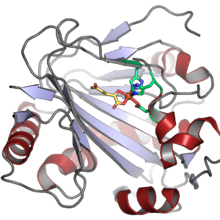 Strukturen hos human PAHX (). Fe (II) -kofaktorn visas som en orange sfär, koordinerad av två histidin- och en aspartatrest (visad i grönt) och av 2-oxoglutarat- samsubstratet (visad i gult).
| |||||||||
| Identifierare | |||||||||
| EG nr. | 1.14.11.18 | ||||||||
| CAS-nr. | 185402-46-4 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA inträde | ||||||||
| ExPASy | NiceZyme-vy | ||||||||
| KEGG | KEGG inträde | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB- strukturer | RCSB PDB PDBe PDB summa | ||||||||
| Genontologi | AmiGO / QuickGO | ||||||||
| |||||||||
| fytanoyl-CoA 2- | |||||||
|---|---|---|---|---|---|---|---|
| hydroxylasidentifierare | |||||||
| Symbol | PHYH | ||||||
| Alt. symboler | PAHX | ||||||
| NCBI-genen | 5264 | ||||||
| HGNC | 8940 | ||||||
| OMIM | 602026 | ||||||
| RefSeq | NM_001037537 | ||||||
| UniProt | O14832 | ||||||
| Övriga uppgifter | |||||||
| Ställe | Chr. 10 p15.3-10p12.2 | ||||||
| |||||||
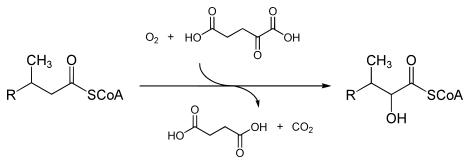
Inom enzymologi är ett fytanoyl-CoA-dioxygenas ( EC 1.14.11.18 ) ett enzym som katalyserar den kemiska reaktionen
- fytanoyl-CoA + 2-oxoglutarat + O 2 2-hydroxifytanoyl-CoA + succinat + CO 2
De tre substraten för detta enzym är fytanoyl-CoA , 2-oxoglutarat (2OG) och O 2 , medan dess tre produkter är 2-hydroxyphytanoyl-CoA, succinat och CO 2 .
Detta enzym tillhör familjen av järn(II)-beroende oxygenaser , som vanligtvis innehåller en atom dioxygen i substratet och en atom i succinatkarboxylatgruppen. Mekanismen är komplex, men tros involvera ordnad bindning av 2-oxoglutarat till det järn(II) -innehållande enzymet följt av substrat. Bindning av substrat orsakar förskjutning av en vattenmolekyl från järn(II)-kofaktorn, vilket lämnar en tom koordinationsposition till vilken dioxygen binder. En omarrangemang inträffar för att bilda en järn-syreart med hög energi (som allmänt anses vara en järn(IV)=O-art) som utför den faktiska oxidationsreaktionen.
Nomenklatur
Det systematiska namnet på denna enzymklass är fytanoyl-CoA, 2-oxoglutarat:syreoxidoreduktas (2-hydroxylerande) . Detta enzym kallas även fytanoyl-CoA-hydroxylas och fytanoyl-CoA-alfa-hydroxylas .
Exempel
Hos människor kodas phytanoyl-CoA-hydroxylas av PHYH -genen ( alias PAHX ) och krävs för alfa-oxidation av grenkedjiga fettsyror (t.ex. fytansyra ) i peroxisomer . PHYH-brist resulterar i ackumulering av stora vävnadslager av fytansyra och är den främsta orsaken till Refsums sjukdom .
Besläktade enzymer
Järn(II)- och 2OG-beroende oxygenaser är vanliga i mikroorganismer , växter och djur; det mänskliga genomet förutspås innehålla cirka 80 exempel, och modellväxten Arabidopsis thaliana innehåller sannolikt fler. I växter och mikroorganismer är denna enzymfamilj associerad med en stor mångfald av oxidativa reaktioner.
Vidare läsning
- Jansen GA, Mihalik SJ, Watkins PA, Jakobs C, Moser HW, Wanders RJ (mars 1998). "Karakterisering av phytanoyl-koenzym A-hydroxylas i mänsklig lever och aktivitetsmätningar hos patienter med peroxisomala störningar". Clinica Chimica Acta; International Journal of Clinical Chemistry . 271 (2): 203–11. doi : 10.1016/S0009-8981(97)00259-3 . PMID 9565335 .
- Jansen GA, Mihalik SJ, Watkins PA, Moser HW, Jakobs C, Denis S, Wanders RJ (dec 1996). "Fytanoyl-CoA-hydroxylas finns i mänsklig lever, lokaliserad i peroxisomer och bristfällig i Zellwegers syndrom: direkta, otvetydiga bevis för den nya, reviderade vägen för alfa-oxidation av fytansyra hos människor". Biokemisk och biofysisk forskningskommunikation . 229 (1): 205–10. doi : 10.1006/bbrc.1996.1781 . PMID 8954107 .
- Jansen GA, Ofman R, Ferdinandusse S, Ijlst L, Muijsers AO, Skjeldal OH, Stokke O, Jakobs C, Besley GT, Wraith JE, Wanders RJ (okt 1997). "Refsums sjukdom orsakas av mutationer i phytanoyl-CoA hydroxylasgenen". Naturgenetik . 17 (2): 190–3. doi : 10.1038/ng1097-190 . PMID 9326940 . S2CID 5856245 .
- Mihalik SJ, Rainville AM, Watkins PA (sep 1995). "Fytansyra alfa-oxidation i råttleverperoxisomer. Produktionen av alfa-hydroxifytanoyl-CoA och formiat förstärks av dioxygenas-kofaktorer". European Journal of Biochemistry . 232 (2): 545–51. doi : 10.1111/j.1432-1033.1995.545zz.x . PMID 7556205 .