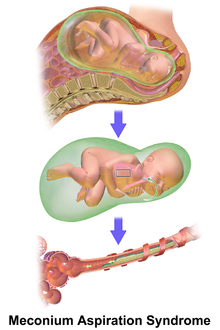
Mekoniumaspirationssyndrom
| Mekoniumaspirationssyndrom | |
|---|---|
| Andra namn | Neonatal aspiration av mekonium |
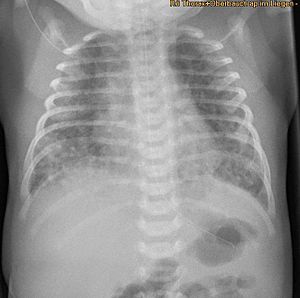 | |
| Röntgen som visar omfattningen av lungepitelskada som svar på mekonium sett hos nyfödda med mekoniumaspirationssyndrom. | |
| Specialitet | Neonatologi |
Mekoniumaspirationssyndrom ( MAS ) även känt som neonatal aspiration av mekonium är ett medicinskt tillstånd som drabbar nyfödda spädbarn. Den beskriver spektrumet av störningar och patofysiologi hos nyfödda födda i mekoniumfärgat fostervatten (MSAF) och har mekonium i sina lungor. Därför har MAS ett brett spektrum av svårighetsgrad beroende på vilka tillstånd och komplikationer som utvecklas efter förlossningen. Dessutom är patofysiologin för MAS multifaktoriell och extremt komplex, vilket är anledningen till att den är den främsta orsaken till sjuklighet och dödlighet hos fullgångna spädbarn.
Ordet meconium kommer från det grekiska ordet mēkōnion som betyder saft från opiumvallmo då de lugnande effekterna det hade på fostret observerades av Aristoteles .
Mekonium är en klibbig mörkgrön substans som innehåller mag- och tarmsekret, fostervatten , gallsyror , galla , blod, slem , kolesterol , bukspottkörtelsekret, lanugo , vernix caseosa och cellrester. Mekonium ackumuleras i fostrets mag-tarmkanal under graviditetens tredje trimester och det är den första utsläppen från tarmen som frigörs inom de första 48 timmarna efter födseln. Noterbart, eftersom mekonium och hela innehållet i mag-tarmkanalen är lokaliserat "extrakorporealt", är dess beståndsdelar dolda och normalt inte igenkända av fostrets immunsystem.
För att mekoniet i fostervattnet framgångsrikt ska orsaka MAS måste det komma in i andningssystemet under den period då de vätskefyllda lungorna övergår till ett luftfyllt organ som kan gasutbyte .
Orsaker
De huvudsakliga teorierna om mekoniumpassage till fostervatten orsakas av fostermognad eller från fosterpåfrestning som ett resultat av hypoxi eller infektion. Andra faktorer som främjar passagen av mekonium i livmodern inkluderar placentainsufficiens, maternell hypertoni, havandeskapsförgiftning och moderns droganvändning av tobak och kokain . Den exakta mekanismen för mekoniumpassage in i fostervattnet är dock inte helt klarlagd och det kan vara en kombination av flera faktorer.
Mekoniumpassage till följd av fosterbesvär
Det kan finnas ett viktigt samband mellan fosterbesvär och hypoxi med MSAF. Man tror att fosterbesvär utvecklas till fosterhypoxi som får fostret att göra avföring av mekonium vilket resulterar i MSAF och sedan kanske MAS. Andra stressfaktorer som orsakar fosterbesvär, och därför mekoniumpassage, inkluderar när syremättnaden i navelvenen är under 30 %.
Fetal hypoxisk stress under förlossningen kan stimulera kolonaktivitet genom att förbättra tarmperistaltiken och avslappna analsfinktern, vilket resulterar i passage av mekonium. Sedan, på grund av intrauterin flämtning eller från de första andetag efter förlossningen, kan MAS utvecklas. Dessutom leder aspiration av tjockt mekonium till obstruktion av luftvägarna vilket resulterar i en mer allvarlig hypoxi .
3 ⁄4 fosterbesvär och mekoniumpassage är inte ett bestämt orsak-verkningssamband eftersom över av spädbarn med MSAF är kraftiga vid födseln och inte har någon plåga eller hypoxi. Dessutom förekommer fosterbesvär ofta utan passage av mekonium också.
Mekoniumpassage som ett resultat av fostrets mognad
Även om mekonium finns i mag-tarmkanalen tidigt i utvecklingen, inträffar MSAF sällan före 34 veckors graviditet .
Peristaltiken av fostrets tarmar är närvarande så tidigt som 8 veckors graviditet och analsfinktern utvecklas vid cirka 20–22 veckor. De tidiga kontrollmekanismerna för analsfinktern är inte väl förstått, men det finns bevis för att fostret rutinmässigt gör avföring i fostervattenhålan även i frånvaro av besvär. Förekomsten av fostrets tarmenzymer har hittats i fostervattnet hos kvinnor som är gravida i vecka 14–22. Detta tyder på att tarminnehållet kan passera fritt in i fostervattnet.
Motilin finns i högre koncentrationer i mag-tarmkanalen efter foster än för tidigt. På liknande sätt ökar intestinal parasympatisk innervation och myelinisering också i senare graviditeter. Därför kan den ökade förekomsten av MAS i post-terma graviditeter återspegla mognaden och utvecklingen av peristaltiken i mag-tarmkanalen hos den nyfödda.
Patofysiologi
Eftersom MAS beskriver ett spektrum av störningar hos nyfödda födda genom MSAF, utan några medfödda andningsrubbningar eller annan underliggande patologi, finns det många hypotesmekanismer och orsaker till uppkomsten av detta syndrom. Långsiktiga konsekvenser kan uppstå av dessa störningar, till exempel har spädbarn som utvecklar MAS högre frekvenser av att utveckla neuroutvecklingsdefekter på grund av dålig andning.
Luftvägsobstruktion
Under de första 15 minuterna av mekoniumaspiration finns det obstruktion av större luftvägar vilket orsakar ökat lungmotstånd, minskad lungkompliance , akut hypoxemi , hyperkapni , atelektas och respiratorisk acidos . Efter 60 minuters exponering färdas mekoniumet vidare ner i de mindre luftvägarna. Väl inne i de terminala bronkiolerna och alveolerna utlöser mekonium inflammation, lungödem , vasokonstriktion , bronkokonstriktion , kollaps av luftvägarna och inaktivering av ytaktivt ämne .
Fetal hypoxi
De lungområden som inte eller endast delvis deltar i ventilationen , på grund av obstruktion och/eller förstörelse, kommer att bli hypoxiska och ett inflammatoriskt svar kan följaktligen uppstå. Partiell obstruktion kommer att leda till luftinfångning och hyperinflation av vissa lungområden och pneumothorax kan följa. Kronisk hypoxi kommer att leda till en ökning av pulmonell vaskulär glattmuskeltonus och ihållande pulmonell hypertoni som orsakar andnings- och cirkulationssvikt.
Infektion
Mikroorganismer, oftast gramnegativa stavar, och endotoxiner finns i prover av MSAF i högre hastighet än i klart fostervatten, till exempel hade 46,9 % av patienterna med MSAF även endotoxiner närvarande. En mikrobiell invasion av amnionhålan (MIAC) är vanligare hos patienter med MSAF och detta kan i slutändan leda till en intra-amnioninflammatorisk respons. MIAC är associerat med höga koncentrationer av cytokiner (såsom IL-6 ), kemokiner (såsom IL-8 och monocyt kemoattraktant protein-1 ), komplement , fosfolipas A2 och matrisnedbrytande enzymer. Därför kan dessa ovannämnda mediatorer i fostervattnet under MIAC och intra-amnioninfektion, när de aspireras in utero , inducera lunginflammation hos fostret.
Lunginflammation
Mekonium har en komplex kemisk sammansättning, så det är svårt att identifiera ett enda medel som är ansvarigt för de flera sjukdomar som uppstår. Eftersom mekonium lagras inuti tarmarna och delvis är oexponerat för immunförsvaret , känner det medfödda immunsystemet igen sig som ett främmande och farligt ämne när det aspireras . Immunsystemet, som är närvarande vid födseln, svarar inom några minuter med låg specificitet och inget minne för att försöka eliminera mikrober . Mekonium leder kanske till kemisk pneumonit eftersom det är en potent aktivator av inflammatoriska mediatorer som inkluderar cytokiner , komplement , prostaglandiner och reaktiva syrearter .
Mekonium är en källa till pro-inflammatoriska cytokiner , inklusive tumörnekrosfaktor (TNF) och interleukiner ( IL-1 , IL-6 , IL-8 ), och mediatorer producerade av neutrofiler , makrofager och epitelceller som kan skada lungvävnaden direkt eller indirekt. Till exempel proteolytiska enzymer från neutrofila granuler och dessa kan skada lungmembranet och ytaktiva proteiner. Dessutom genererar aktiverade leukocyter och cytokiner reaktiva kväve- och syrearter som har cytotoxiska effekter. Oxidativ stress resulterar i vasokonstriktion , bronkokonstriktion , trombocytaggregation och accelererad cellulär apoptos . Nyligen har det antagits att mekonium är en potent aktivator av toll-like receptor (TLR) och komplement , nyckelmediatorer vid inflammation, och kan således bidra till det inflammatoriska svaret vid MAS.
Mekonium innehåller höga mängder fosfolipas A 2 (PLA 2 ), ett potent proinflammatoriskt enzym, som direkt (eller genom stimulering av arakidonsyra ) kan leda till dysfunktion av ytaktiva ämnen, förstörelse av lungepitel, vävnadsnekros och en ökning av apoptos . Mekonium kan också aktivera koagulationskaskaden , produktion av trombocytaktiverande faktor (PAF) och andra vasoaktiva ämnen som kan leda till förstörelse av kapillärendotel och basalmembran . Skada på det alveolokapillära membranet resulterar i läckage av vätska, plasmaproteiner och celler till interstitium och alveolära utrymmen .
Inaktivering av ytaktiva ämnen
Ytaktivt ämne syntetiseras av typ II alveolära celler och är gjord av ett komplex av fosfolipider , proteiner och sackarider . Det fungerar för att sänka ytspänningen (för att möjliggöra lungexpansion under inspiration ), stabilisera alveolerna vid slutet av utandningen (för att förhindra alveolär kollaps) och förhindrar lungödem . Surfactant bidrar också till lungskydd och försvar eftersom det också är ett antiinflammatoriskt medel. Ytaktivt medel förbättrar avlägsnandet av inhalerade partiklar och åldrande celler bort från alveolstrukturen.
Omfattningen av hämning av ytaktivt ämne beror på både koncentrationen av ytaktivt ämne och mekonium. Om koncentrationen av ytaktiva ämnen är låg, kan även mycket högt utspätt mekonium hämma funktionen av ytaktiva ämnen, medan effekterna av mekonium är begränsade i höga koncentrationer av ytaktiva ämnen. Mekonium kan påverka ytaktiva mekanismer genom att förhindra att ytaktiva ämnen sprids över alveolytan, minska koncentrationen av ytaktiva proteiner ( SP-A och SP-B ) och genom att ändra viskositeten och strukturen hos det ytaktiva medlet. Flera morfologiska förändringar inträffar efter exponering av mekonium, de mest anmärkningsvärda är att luftvägsepitel lossnar från stroma och utsöndring av epitelceller i luftvägarna. Dessa indikerar en direkt skadlig effekt på lungalveolära celler på grund av införandet av mekonium i lungorna.
Ihållande pulmonell hypertoni
Persistent pulmonell hypertension (PPHN) är att fostrets cirkulation inte anpassar sig till extrauterina tillstånd efter födseln. PPHN är associerat med olika luftvägssjukdomar, inklusive MAS (eftersom 15-20% av spädbarn med MAS utvecklar PPHN), men även lunginflammation och sepsis . En kombination av hypoxi , pulmonell vasokonstriktion och ventilation / perfusionsfelmatchning kan utlösa PPHN, beroende på koncentrationen av mekonium i luftvägarna . PPHN hos nyfödda är den vanligaste dödsorsaken vid MAS.
Apoptos
Apoptos är en viktig mekanism vid eliminering av skadade celler och vid vävnadsreparation, men för mycket apoptos kan orsaka skada, såsom akut lungskada. Mekonium inducerar apoptos och DNA -klyvning av epitelceller från lungluftvägarna, detta detekteras genom närvaron av fragmenterat DNA i luftvägarna och i alveolära epitelkärnor. Mekonium inducerar en inflammatorisk reaktion i lungorna eftersom det finns en ökning av autofagocytiska celler och nivåer av kaspas 3 efter exponering. Efter 8 timmars exponering för mekonium hos kaninfoster är den totala mängden apoptotiska celler 54 %. Därför kan majoriteten av mekonium-inducerad lungskada bero på apoptos av lungepitel.
Diagnos
Andnöd hos ett spädbarn som föds genom den mörkfärgade MSAF samt mekonium som blockerar luftvägarna är vanligtvis tillräckligt för att diagnostisera MAS. Dessutom kan nyfödda med MAS ha andra typer av andningsbesvär som takypné och hyperkapni . Ibland är det svårt att diagnostisera MAS eftersom det kan förväxlas med andra sjukdomar som också orsakar andnöd, såsom lunginflammation . Dessutom kan röntgen och lungultraljud vara snabba, enkla och billiga avbildningstekniker för att diagnostisera lungsjukdomar som MAS.
Förebyggande
Generellt sett har förekomsten av MAS minskat avsevärt under de senaste två decennierna eftersom antalet post-term leveranser har minimerats.
Förebyggande under graviditeten
Förebyggande åtgärder under graviditet kan inkludera amnioninfusion och antibiotika, men effektiviteten av dessa behandlingar är tveksam.
Förebyggande under förlossningen
Som tidigare nämnts är orofaryngeal och nasofaryngeal sugning inte en idealisk förebyggande behandling för både kraftiga och deprimerade (inte andningsbara) spädbarn.
Behandling
De flesta spädbarn som föds genom MSAF kräver inga behandlingar (annat än rutinmässig postnatalvård) eftersom de inte visar några tecken på andningsbesvär, eftersom endast cirka 5 % av spädbarn som föds genom MSAF utvecklar MAS. Men spädbarn som utvecklar MAS måste läggas in på en neonatalavdelning där de kommer att observeras noggrant och ges eventuella behandlingar som behövs. Observationer inkluderar övervakning av hjärtfrekvens , andningsfrekvens , syremättnad och blodsocker (för att upptäcka försämrad respiratorisk acidos eller utveckling av hypoglykemi ). I allmänhet är behandling av MAS mer stödjande till sin natur.
Assisterade ventilationstekniker
För att rensa luftvägarna från mekonium kan trakealsugning användas, men effektiviteten av denna metod är ifrågasatt och den kan orsaka skada.
I fall av MAS finns ett behov av extra syre i minst 12 timmar för att bibehålla syremättnaden av hemoglobin på 92 % eller mer. Svårighetsgraden av andningsbesvär kan variera avsevärt mellan nyfödda med MAS, eftersom vissa kräver minimalt eller inget extra syrebehov och i svåra fall kan mekanisk ventilation behövas. Den önskade syremättnaden är mellan 90 och 95 % och PaO 2 kan vara så hög som 90 mmHg. I de fall där det finns tjock mekonium djupt i lungorna mekanisk ventilation krävas. I extrema fall extrakorporeal membransyresättning (ECMO) användas hos spädbarn som inte svarar på ventilationsbehandling. Medan på ECMO kan kroppen få tid att absorbera mekoniumet och för att alla associerade störningar ska lösas. Det har varit ett utmärkt svar på denna behandling, eftersom överlevnaden av MAS under ECMO är mer än 94 %.
Ventilation av spädbarn med MAS kan vara utmanande och eftersom MAS kan påverka varje individ på olika sätt kan ventilationsadministrationen behöva anpassas. Vissa nyfödda med MAS kan ha homogena lungförändringar och andra kan ha inkonsekventa och ojämna förändringar i lungorna. Det är vanligt att sedering och muskelavslappnande medel används för att optimera ventilationen och minimera risken för pneumothorax i samband med dyssynkron andning.
Inhalerad kväveoxid
Inhalerad kväveoxid (iNO) verkar på vaskulär glatt muskulatur och orsakar selektiv pulmonell vasodilatation . Detta är idealiskt vid behandling av PPHN eftersom det orsakar vasodilatation i ventilerade områden i lungan, vilket minskar ventilations-perfusionsfelet och därmed förbättrar syresättningen. Behandling med iNO minskar behovet av ECMO och dödlighet hos nyfödda med hypoxisk andningssvikt och PPHN till följd av MAS. Emellertid svarar cirka 30-50 % av spädbarn med PPHN inte på iNO-behandling.
Antiinflammatoriska medel
Eftersom inflammation är ett så stort problem vid MAS har behandlingen bestått av antiinflammatoriska medel.
Glukokortikoider
Glukokortikoider har en stark antiinflammatorisk aktivitet och arbetar för att minska migrationen och aktiveringen av neutrofiler , eosinofiler , mononukleära celler och andra celler. De minskar migrationen av neutrofiler in i lungorna, vilket minskar deras vidhäftning till endotelet . Således finns det en minskning av verkan av mediatorer som frigörs från dessa celler och därför ett minskat inflammatoriskt svar.
Glukokortikoider har också en genomisk verkningsmekanism där det aktiverade komplexet, när det väl är bundet till en glukokortikoidreceptor , rör sig in i kärnan och hämmar transkription av mRNA . I slutändan påverkar det om olika proteiner produceras eller inte. Inhibering av transkriptionen av nukleär faktor ( NF-KB ) och proteinaktivator ( AP-1 ) dämpar uttrycket av pro-inflammatoriska cytokiner ( IL-1 , IL-6 , IL-8 och TNF etc.), enzymer ( PLA 2 , COX-2 , iNOs etc.) och andra biologiskt aktiva substanser. Den antiinflammatoriska effekten av glukokortikoider demonstreras också genom att förstärka aktiviteten av lipokortiner som hämmar aktiviteten av PLA 2 och därför minskar produktionen av arakidonsyra och mediatorer av lipoxygenas- och cyklooxygenasvägar .
Antiinflammatoriska medel måste administreras så snabbt som möjligt eftersom effekten av dessa läkemedel kan minska till och med bara en timme efter mekoniumaspiration. Till exempel ökade tidig administrering av dexametason signifikant gasutbytet , minskade ventilationstryck, minskade antalet neutrofiler i bronkoalveolområdet, minskade ödembildning och oxidativ lungskada. Glukokortikoider kan dock öka risken för infektion och denna risk ökar med dosen och varaktigheten av glukokortikoidbehandlingen. Andra problem kan uppstå, såsom förvärring av diabetes mellitus , osteoporos , hudatrofi och tillväxthämning hos barn .
Inhibitorer av fosfodiesteras
Fosfodiesteraser (PDE) bryter ned cAMP och cGMP och inom andningssystemet hos en nyfödd med MAS kan olika isoformer av PDE vara involverade på grund av deras pro-inflammatoriska och kontraktila aktivitet i glatt muskulatur . Därför skulle icke-selektiva och selektiva hämmare av PDE potentiellt kunna användas i MAS-terapi. Användningen av PDE-hämmare kan dock orsaka kardiovaskulära biverkningar. Icke-selektiva PDE-hämmare, såsom metylxantiner , ökar koncentrationerna av cAMP och cGMP i cellerna, vilket leder till bronkodilation och vasodilatation . Dessutom minskar metylxantiner koncentrationerna av kalcium, acetylkolin och monoaminer , detta kontrollerar frisättningen av olika mediatorer av inflammation och bronkokonstriktion , inklusive prostaglandiner . Selektiva PDE-hämmare riktar sig mot en subtyp av fosfodiesteras och i MAS kan aktiviteterna för PDE-3 , PDE-4 , PDE-5 och PDE-7 bli förstärkta. Till exempel Milrinone (en selektiv PDE3-hämmare) syresättning och överlevnad för nyfödda med MAS.
Hämmare av cyklooxygenas
Arakidonsyra metaboliseras, via cyklooxygenas (COX) och lipoxygenas , till olika substanser inklusive prostaglandiner och leukotriener , som uppvisar potenta pro-inflammatoriska och vasoaktiva effekter. Genom att hämma COX, och mer specifikt COX-2 , (antingen genom selektiva eller icke-selektiva läkemedel) kan inflammation och ödem minskas. COX-hämmare kan dock inducera magsår och orsaka hyperkalemi och hypernatremi . Dessutom har COX-hämmare inte visat något bra svar vid behandling av MAS.
Antibiotika
Mekonium är vanligtvis sterilt, men det kan innehålla olika bakteriekulturer så lämpliga antibiotika kan behöva förskrivas.
Behandling av ytaktiva ämnen
Lungsköljning med utspädd tensid är en ny behandling med potentiellt fördelaktiga resultat beroende på hur tidigt den ges till nyfödda med MAS. Denna behandling visar lovande eftersom den har en betydande effekt på luftläckor, pneumothorax , behovet av ECMO och dödsfall. Tidig intervention och användning av det på nyfödda med mild MAS är mer effektivt. Det finns dock risker eftersom en stor volym vätskeinstillation till lungan hos en nyfödd kan vara farlig (särskilt i fall av svår MAS med pulmonell hypertoni ) eftersom det kan förvärra hypoxi och leda till dödlighet.
Tidigare behandlingar
Ursprungligen trodde man att MAS utvecklades som ett resultat av att mekoniumet var en fysisk blockering av luftvägarna. För att förhindra att nyfödda, som föddes genom MSAF, utvecklar MAS, användes sugning av det orofaryngeala och nasofaryngeala området före leverans av axlarna följt av trakeal aspiration i 20 år. Denna behandling ansågs vara effektiv eftersom den rapporterades minska förekomsten av MAS signifikant jämfört med de nyfödda födda genom MSAF som inte behandlades. Detta påstående motbevisades senare och framtida studier drog slutsatsen att orofaryngeal och nasofaryngeal sugning, före leverans av axlarna hos spädbarn födda genom MSAF, inte förhindrar MAS eller dess komplikationer. Faktum är att det kan orsaka fler problem och skador (t.ex. slemhinneskador ), så det är inte en rekommenderad förebyggande behandling. Sugning kanske inte avsevärt minskar förekomsten av MAS eftersom mekoniumpassage och aspiration kan förekomma in utero. Därigenom gör sugningen överflödig och värdelös eftersom mekoniumet kan vara djupt inne i lungorna vid tidpunkten för födseln.
Historiskt har fostervatteninfusion använts när MSAF var närvarande, vilket innebär en transcervikal infusion av vätska under förlossningen. Tanken var att späda ut det tjocka mekoniumet för att minska dess potentiella patofysiologi och minska fall av MAS, eftersom MAS är vanligare i fall av tjockt mekonium. Det finns dock associerade risker, såsom framfall av navelsträngen och förlängning av förlossningen. Riktlinjerna från UK National Institute of Health and Clinical Excellence (NICE) rekommenderar användning av amnioninfusion hos kvinnor med MSAF.
Utbredning
1 av 7 graviditeter har MSAF och av dessa fall utvecklar cirka 5 % av dessa spädbarn MAS. MSAF observeras 23-52% i graviditeter vid 42 veckor, därför ökar frekvensen av MAS när graviditetslängden ökar , så att prevalensen är störst vid post-terma graviditeter. Omvänt för tidigt födda inte ofta förknippade med MSAF (endast cirka 5 % totalt innehåller MSAF). Graden av MAS minskar i populationer där förlossningen induceras hos kvinnor som har graviditeter som överstiger 41 veckor. Det finns många misstänkta predisponerande faktorer som tros öka risken för MAS. Till exempel är risken för MSAF högre hos mödrar från afroamerikaner, afrikanska och Stillahavsöar, jämfört med mödrar från andra etniska grupper.
Framtida forskning
Forskningen fokuseras på att utveckla såväl en framgångsrik metod för att förebygga MAS som en effektiv behandling. Till exempel görs undersökningar av effektiviteten av antiinflammatoriska medel, ersättningsterapi för ytaktiva ämnen och antibiotikaterapi . Mer forskning behöver göras om de farmakologiska egenskaperna hos till exempel glukokortikoider , inklusive doser, administrering, tidpunkt eller andra läkemedelsinteraktioner. Dessutom pågår det fortfarande forskning om huruvida intubation och sugning av mekonium hos nyfödda med MAS är fördelaktigt, skadligt eller helt enkelt är en överflödig och föråldrad behandling. I allmänhet finns det fortfarande inget allmänt accepterat terapeutiskt protokoll och effektiv behandlingsplan för MAS.