Galaktosoxidas
| Galaktosoxidas | |||||||||
|---|---|---|---|---|---|---|---|---|---|
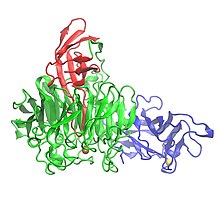 Kristallstruktur av galaktosoxidas som visar tre domäner:
| |||||||||
| Identifierare för domän 1 (blå), domän 2 (grön) och domän 3 (röd). | |||||||||
| EG nr. | 1.1.3.9 | ||||||||
| CAS-nr. | 9028-79-9 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA inträde | ||||||||
| ExPASy | NiceZyme-vy | ||||||||
| KEGG | KEGG inträde | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB- strukturer | RCSB PDB PDBe PDB summa | ||||||||
| Genontologi | AmiGO / QuickGO | ||||||||
| |||||||||
Galaktosoxidas ( D-galaktos:syre 6-oxidoreduktas , D-galaktosoxidas , beta-galaktosoxidas ; förkortat GAO , GAOX , GOase ; EC 1.1.3.9 ) är ett enzym som katalyserar oxidationen av D-galaktos i vissa arter av svamp . .
Galaktosoxidas tillhör familjen oxidoreduktaser . Kopparjon krävs som en kofaktor för galaktosoxidas. En anmärkningsvärd egenskap hos galaktosoxidas är att det är ett enzym med fria radikaler . Dess katalytiska ställe innehåller en friradikalligand som koordinerar till kopparcentrumet. Denna friradikalligand är en kovalent tvärbunden cystein- och tyrosin -sidokedjor som bildas under posttranslationell modifiering .
Bakgrund
Funnet i flera svamparter såsom Fusarium graminearum NRRL 2903 (tidigare felidentifierad som Dactylium dendroides ) och andra arter av Fusarium och Aspergillus släkten , isolerades galaktosoxidas först 1959. Detta enzym utsöndras av svampar för att fungera i extracellulärt utrymme. Även om oxidationsreaktionen av D-galaktos ger galaktosoxidas dess namn, tros den kopplade reduktionen av dioxygen till väteperoxid ha större fysiologisk betydelse i jästsvampar. Väteperoxid som kan produceras av jäst på detta sätt är möjligen ett bakteriostatiskt medel .
Proteinstruktur
Galaktosoxidas innehåller 639 aminosyror . Det är en enkel peptidmonomer som har tre β- strukturella domäner . Domän 1 (resterna 1-155) är en β-smörgås som består av åtta antiparallella β-strängar . Den innehåller ett möjligt bindningsställe för Na + eller Ca2 + , som kan tjäna strukturella roller i proteinet. En annan egenskap hos domän 1 är närvaron av ett kolhydratbindningsställe som styr enzymet att binda till extracellulära kolhydrater. Domän 2 (resterna 156-552) innehåller kopparbindningsstället. β-strängarna i domän 2 är organiserade som en sjufaldig propeller, och var och en av de sju strukturella enheterna är en underdomän som består av fyra antiparallella β-strängar. Domän 3 (resterna 553-639) består av sju antiparallella β-strängar och bildar ett "lock" över domän 2. En histidin (His581) från domän 3 fungerar som ligand för koppar, vilket bidrar till det metallinnehållande aktiva stället av enzymet.
Aktiv sida
Galaktosoxidas är ett kopparprotein av typ II . Den innehåller ett enda kopparcentrum som antar kvadratisk plan eller kvadratisk pyramidal koordinationsgeometri . Kopparcentret har fem koordinerande ligander: två tyrosiner (Tyr272 och Tyr495), två histidiner (His496 och His581) och en lösningsmedelsmolekyl som vanligtvis är vatten. Kopparet i det aktiva stället för galaktosoxidas beskrivs ha en "förvrängd kvadratisk pyramidal" koordinationsgeometri. Tyr495 är den axiella liganden, de andra fyra liganderna ligger ungefär i ett plan. Båda histidinerna koordinerar med koppar genom 3-kväve . Koppar-H 2 O-bindningen är den längsta koordinatbindningen ; den är labil och kan ersättas av en substratmolekyl. Tyr272 bildar en dimer med ett cystein (Cys228) genom ett ortokol av tyrosin och svavelatomen i cystein, vilket stöds av röntgenkristallografistudier . Tyr-Cys tvärbindningen minskar den strukturella flexibiliteten hos Tyr272. Detta tvärbundna tyrosinat är också en fri radikal. I den helt oxiderade formen av galaktosoxidas kopplas den fria radikalen till koppar(II)-centret antiferromagnetiskt , med stöd av EPR-spektroskopiska studier . Dessutom tros bildningen av tvärbindande tioeterbindning sänka oxidationspotentialen för Tyr272- fenoxid , vilket gör denna fenoxyl lättare att oxidera för att bilda radikalen vid posttranslationell modifiering.
Den fria radikalen i galaktosoxidas är ovanligt stabil jämfört med många andra proteinfria radikaler. Den fria radikalliganden stabiliseras huvudsakligen på två sätt. För det första, som avslöjats av beräkningskemiska studier, stabiliseras den oparade elektronen genom delokalisering av den aromatiska ringen av tyrosin och det tvärbundna cysteinsvaveln, med syreatomen i Tyr272 som har hög oparad elektrondensitet . Vissa experimentella bevis tyder också på att axiell Tyr495 också är involverad i oparad elektrondelokalisering. För det andra indolringen av en tryptofan (Trp290) ovanför och parallellt med tyrosin-cystein, och beter sig som en sköld som skyddar radikalen från den externa lösningsmedelsmiljön. Stödbevis kommer från att mutation av denna tryptofanrest leder till en lägre stabilitet hos den aktiva formen av galaktosoxidas. Dessutom består den yttre sfären av det aktiva stället av många aromatiska rester som ger det aktiva stället en hydrofob karaktär. Det finns också omfattande vätebindningsnätverk som omger den aktiva platsen.
Reaktion
I jäst katalyserar galaktosoxidas följande reaktion:
- D-galaktos + O 2 D-galakto-hexodialdos + H 2 O 2
Denna reaktion är i huvudsak oxidation av primär alkohol med hjälp av dioxygen för att bilda motsvarande aldehyd och väteperoxid . Det har visats att galaktosoxidas också kan katalysera olika primära alkoholer andra än galaktos. Faktum är att galaktosoxidas katalyserar dihydroxiaceton tre gånger snabbare än det gör till galaktos. Reaktionen är regioselektiv , eftersom den inte kan oxidera sekundär alkohol.
Denna tvåelektronoxidation uppnås genom dubbelredoxstället: koppar(II)-metallcentret och den fria radikalen, som var och en kan ta emot en elektron från substratet. Detta dubbelredoxcenter har tre tillgängliga oxidationsnivåer. I galaktosoxidasens katalytiska cykel pendlar enzymet mellan den helt oxiderade formen och den helt reducerade formen. Den halvoxiderade formen är den inaktiva formen.
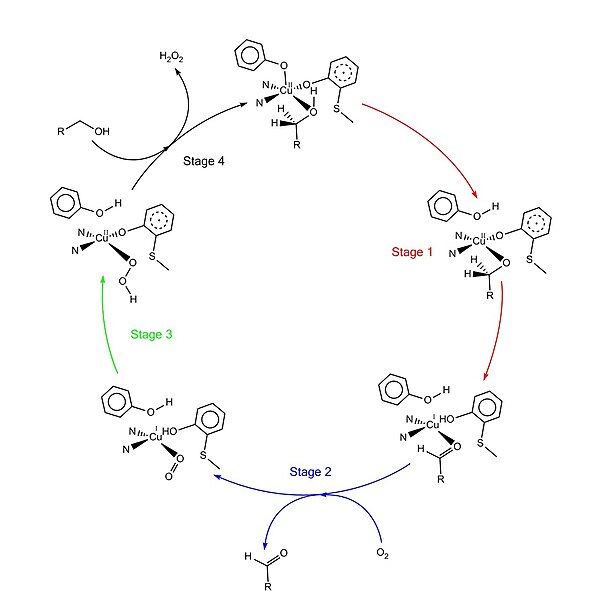
Katalytisk mekanism
Den accepterade katalytiska mekanismen, kallad "pingismekanismen", består av fyra huvudsteg. Det första steget är oxidationen av substratet genom dubbelredoxcentret. Efter att hydroxylgruppen i substratalkoholen upptar lösningsmedlets koordinationsställe, deprotoneras hydroxylgruppen av Tyr495, följt av frisättningen av Tyr495. Detta steg gör alkoholen mer benägen att oxidera. Protonen på kolet som hydroxylgruppen brukade fästas till överförs sedan till Tyr272 (fungerar som väteacceptorn), kopplat till oxidationen av substratet. En elektron går till den radikala liganden, den andra elektronen går till koppar(II)centrum, som sedan reduceras till koppar(I) som ett resultat. Samtidigt reduceras också Tyr272-radikal. Protonsubtraktionssteget är hastighetsbestämmande och stereospecifikt eftersom endast pro-S- vätet på alkoholkolet avlägsnas (understödd av studier av dess kinetiska isotopeffekt). Det övergripande resultatet av steg 1 är avlägsnandet av två väteatomer och avlägsnandet av två elektroner från substratet, vars ordningsföljd dock är oklar. Det andra steget är frisättningen av oxiderat substrat (aldehyd i detta fall) och koordineringen av dioxygen vid substratets koordinationsställe. I det tredje steget reduceras dioxygen snabbt av koppar(I) för att bilda superoxid . Superoxiden är en reaktiv substans som subtraherar protonen och en elektron från Tyr272 och återbildar tyrosinradikalen. I det fjärde steget deprotonerar hydroperoxiden Tyr496 och frisätts som H 2 O 2 . Efterföljande axiell koordination av Tyr496 och ekvatorial koordination av ny substratmolekyl till kopparcentrum fullbordar omsättningen av enzymet.
Modifiering efter översättning
Prepro -GAOX (galaktosoxidas med signalsekvens) bearbetas två gånger genom proteolytisk klyvning i ledarsekvensen för att bilda den mogna GAOX-peptiden (pro-GAOX). Den första klyvningen tar bort en sekvens av 24 aminosyror genom signalpeptidas . Den andra klyvningen tar bort en annan sekvens med 17 aminosyror.
Den kovalenta kopplingen mellan Tyr272 och Cys228 bildas efter att pro -GAOX har gjorts. Förekomsten av denna modifiering verkar inte kräva några andra "hjälparproteiner". Den nuvarande mekanismen för bildandet av denna kovalenta koppling antyder kravet på koppar(I) och dioxygen. Mekanismen för denna tyrosin-cystein-koppling är inte helt klarlagd, men några viktiga händelser har förutspåtts: koppar(I) koordinerar med Tyr272 och histidiner vid den (framtida) aktiva platsen. Reaktion av dioxygen med komplexet av det aktiva stället genererar en fri radikal- mellanprodukt . Två möjliga former av den fria radikalen, tiyl och fenoxyl , är möjliga; tillsats av tiylradikal till fenol, eller tillsats av fenoxylradikal till tiol, genererar den kovalenta kopplingen mellan svavelatomen i cystein och den aromatiska ringen av tyrosin; En andra dioxygenmolekyl reagerar med kopparcentrumet koordinerat med tvärbundet tyrosin-cystein för att generera radikal-kopparkomplex.
Ansökningar
Bioanalys
Biomolekyler i prover som galaktos kan kvantifieras med hjälp av syrgasdetekteringsmetod, eftersom en ekvivalent förbrukning av syre motsvarar en ekvivalent primär hydroxylgrupp oxiderad. Bildandet av väteperoxid under substratoxidation kan också användas för kolorimetrisk detektion av galaktos med användning av färgämnen som oxideras av väteperoxid. Eftersom kolhydrater normalt kan ha primära hydroxylgrupper, kan galaktosoxidas användas för att modifiera cellytglykoproteiner för att uppnå cellmärkning.
Organisk syntes
Galaktosoxidas har använts som en biokatalysator vid syntesen av aldehyder och karboxylsyror från primära alkoholer.
Biomimetiska föreningar
Vår förståelse av mekanismen för galaktosoxidas inspirerar forskare att utveckla modellföreningar som efterliknar strukturen och funktionen av galaktosoxidas. Det verkar som att elektrondelning mellan kopparn och den fria radikalen är det avgörande elementet för framgången med att syntetisera dessa föreningar. Den första modellföreningen av GAOX som tillverkas är [Cu(II)(dnc)], som använder duncamine ( dnc ) som kelatbildande ligand . Andra modellföreningar har studerats och rapporterats i litteraturen.