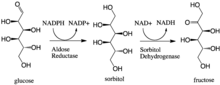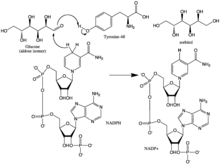Aldosreduktas
| Aldosreduktas | |||||||||
|---|---|---|---|---|---|---|---|---|---|

Banddiagram över humant aldosreduktas i komplex med NADP + , citrat och IDD594, en hämmare av små molekyler . Från .
| |||||||||
| Identifierare | |||||||||
| EG nr. | 1.1.1.21 | ||||||||
| CAS-nr. | 9028-31-3 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA inträde | ||||||||
| ExPASy | NiceZyme-vy | ||||||||
| KEGG | KEGG inträde | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB- strukturer | RCSB PDB PDBe PDB summa | ||||||||
| |||||||||
Inom enzymologi är aldosreduktas (eller aldehydreduktas ) ( EC 1.1.1.21 ) ett cytosoliskt NADPH -beroende oxidoreduktas som katalyserar reduktionen av en mängd olika aldehyder och karbonyler, inklusive monosackarider . Det är främst känt för att katalysera reduktionen av glukos till sorbitol , det första steget i polyolvägen för glukosmetabolism.
Reaktioner
Aldosreduktas katalyserar den NADPH-beroende omvandlingen av glukos till sorbitol , det första steget i polyolvägen för glukosmetabolism. Det andra och sista steget i vägen katalyseras av sorbitoldehydrogenas , som katalyserar den NAD-kopplade oxidationen av sorbitol till fruktos. Således resulterar polyolvägen i omvandling av glukos till fruktos med stökiometriskt utnyttjande av NADPH och produktion av NADH.
Galaktos är också ett substrat för polyolvägen, men motsvarande ketosocker produceras inte eftersom sorbitoldehydrogenas inte kan oxidera galaktitol. Ändå kan aldosreduktas katalysera reduktionen av galaktos till galaktitol
- galaktos + NADPH + H + galaktitol + NADP +
Fungera
Aldosreduktasreaktionen, i synnerhet den sorbitol som produceras, är viktig för funktionen hos olika organ i kroppen. Till exempel används det i allmänhet som det första steget i en syntes av fruktos från glukos; det andra steget är oxidationen av sorbitol till fruktos katalyserad av sorbitoldehydrogenas . Huvudvägen från glukos till fruktos ( glykolys ) involverar fosforylering av glukos genom hexokinas för att bilda glukos 6-fosfat , följt av isomerisering till fruktos 6-fosfat och hydrolys av fosfatet, men sorbitolvägen är användbar eftersom den inte kräver tillförsel. energi i form av ATP :
- Sädesblåsor : Fruktos producerad av sorbitol används av spermiecellerna .
- Lever : Fruktos framställd av sorbitol kan användas som energikälla för glykolys och glykoneogenes .
Aldosreduktas finns också i linsen , näthinnan , Schwann-cellerna i perifera nerver, placenta och röda blodkroppar . [ citat behövs ]
I Drosophila kodade CG6084 för ett mycket konserverat protein av humant Aldo-keto-reduktas 1B. dAKR1B i hemocyter, är nödvändigt och tillräckligt för ökning av plasmasockeralkoholer efter tarminfektion. Ökat sorbitol aktiverade därefter Metalloproteas 2, som klyver PGRP-LC för att aktivera systemiskt immunsvar i fettkroppar. Således ger aldosreduktas en kritisk metabolisk kontrollpunkt i det globala inflammatoriska svaret.
Enzymstruktur
Aldosreduktas kan betraktas som ett prototypiskt enzym av aldo-keto-reduktasenzymsuperfamiljen. Enzymet omfattar 315 aminosyrarester och viker sig till ett β/α-fat strukturellt motiv som består av åtta parallella β-strängar. Intilliggande strängar är förbundna med åtta perifera α-helixsegment som löper antiparallellt med β-arket. Den katalytiskt aktiva platsen belägen i trumkärnan. NADPH-kofaktorn är belägen på toppen av β/α-cylindern, med nikotinamidringen som skjuter ut i mitten av behållaren och pyrofosfat gränsar över hylsan.


Enzymmekanism
Reaktionsmekanismen för aldosreduktas i riktning mot aldehydreduktion följer en sekventiellt ordnad väg där NADPH binder, följt av substratet . Bindning av NADPH inducerar en konformationsförändring (Enzyme•NADPH → Enzyme*•NADPH) som involverar gångjärnsliknande rörelse av en ytögla (rester 213-217) för att täcka en del av NADPH på ett sätt som liknar det hos en säkerhetsbälte. Alkoholprodukten bildas via en överföring av pro-R-hydriden av NADPH till baksidan av substratets karbonylkol. Efter frisättning av alkoholprodukten sker ytterligare en konformationsförändring (E*•NADP + → E•NADP + ) för att frigöra NADP + . Kinetiska studier har visat att omorientering av denna slinga för att tillåta frisättning av NADP + verkar representera det hastighetsbegränsande steget i riktning mot aldehydreduktion. Eftersom hastigheten för frisättning av koenzym begränsar den katalytiska hastigheten, kan det ses att störningar av interaktioner som stabiliserar koenzymbindning kan ha dramatiska effekter på den maximala hastigheten (Vmax).
Hydriden som överförs från NADP + till glukos kommer från C-4 i nikotinamidringen vid basen av den hydrofoba kaviteten. Positionen för detta kol definierar således enzymets aktiva ställe. Det finns tre rester i enzymet inom ett lämpligt avstånd från C-4 som kan vara potentiella protondonatorer: Tyr-48, His-110 och Cys-298. Evolutionära, termodynamiska och molekylära modelleringsbevis förutspådde Tyr-48 som protondonator. Denna förutsägelse bekräftades av resultaten av mutagenesstudier. Således tros en [vätebindning] interaktion mellan den fenoliska hydroxylgruppen i Tyr-48 och ammoniumsidokedjan i Lys-77 hjälpa till att underlätta hydridöverföring.
Roll i diabetes
Diabetes mellitus anses vara en ledande orsak till nya fall av blindhet och är associerad med ökad risk för smärtsam neuropati, hjärtsjukdomar och njursvikt. Många teorier har utvecklats för att förklara mekanismer som leder till diabetiska komplikationer, inklusive stimulering av glukosmetabolism genom polyolvägen. Dessutom finns enzymet i ögat ( hornhinna , näthinna , lins ), njure och myelinskidan – vävnader som ofta är involverade i diabeteskomplikationer. Under normala glykemiska förhållanden metaboliseras endast en liten del av glukos genom polyolvägen, eftersom majoriteten fosforyleras av hexokinas, och den resulterande produkten, glukos-6-fosfat, används som ett substrat för glykolys eller pentosfosfatmetabolism. Som svar på den kroniska hyperglykemi som finns hos diabetiker ökar emellertid glukosflödet genom polyolvägen signifikant. Upp till 33 % av det totala glukosutnyttjandet i vissa vävnader kan ske via polyolvägen. Glukoskoncentrationerna är ofta förhöjda hos diabetiker och aldosreduktas har länge ansetts vara ansvarigt för diabetiska komplikationer som involverar ett antal organ. Många aldosreduktashämmare har utvecklats som läkemedelskandidater men praktiskt taget alla har misslyckats även om vissa såsom epalrestat är kommersiellt tillgängliga i flera länder. Ytterligare reduktashämmare som ranirestat , ponalrestat, risarestat, sorbinil och berberin är för närvarande i kliniska prövningar.
Se även
Vidare läsning
- Denise R., PhD. Ferrier (2005). Lippincott's Illustrated Reviews: Biochemistry (Lippincott's Illustrated Reviews) . Hagerstown, Maryland: Lippincott Williams & Wilkins. sid. 319. ISBN 0-7817-2265-9 .
- Attwood MA, Doughty CC (december 1974). "Rening och egenskaper hos kalvleveraldosreduktas". Biochim. Biophys. Acta . 370 (2): 358–68. doi : 10.1016/0005-2744(74)90097-7 . PMID 4216364 .
- Boghosian RA, McGuinness ET (april 1979). "Affinitetsrening och egenskaper hos aldosreduktas från grishjärna". Biochim. Biophys. Acta . 567 (2): 278–86. doi : 10.1016/0005-2744(79)90113-x . PMID 36151 .