Tebbes reagens
|
|

|
|
| Namn | |
|---|---|
|
IUPAC namn
μ-klor[di(cyklopenta-2,4-dien-1-yl)]dimetyl(μ-metylen)titan-aluminium
|
|
| Andra namn Tebbe reagens
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard | 100.157.162 |
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C13H18AlClTi _ _ _ _ | |
| Molar massa | 284,60 g/mol |
| Löslighet i andra lösningsmedel |
toluen, bensen, diklormetan, THF (endast låga temperaturer) |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
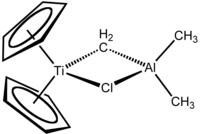
Tebbes reagens är den organometalliska föreningen med formeln (C 5 H 5 ) 2 TiCH 2 ClAl(CH 3 ) 2 . Det används vid metylenering av karbonylföreningar , det vill säga det omvandlar organiska föreningar som innehåller R2C = O-gruppen till det besläktade R2C = CH2- derivatet . Det är en röd fast substans som är pyrofor i luften, och därför hanteras vanligtvis med luftfria tekniker . Det syntetiserades ursprungligen av Fred Tebbe vid DuPont Central Research .
Tebbes reagens innehåller två tetraedriska metallcentra sammanlänkade av ett par överbryggande ligander . Titanet har två cyklopentadienyl ( [C
5 H
5 ] −
eller Cp) ringar och aluminium har två metylgrupper. Titan- och aluminiumatomerna är sammanlänkade av både en metylenbrygga (-CH 2 -) och en kloridatom i en nästan kvadratisk plan (Ti-CH 2 -Al-Cl) geometri. Tebbe-reagenset var den första rapporterade föreningen där en metylenbrygga förbinder en övergångsmetall (Ti) och en huvudgruppmetall (Al).
Förberedelse
Tebbe-reagenset syntetiseras från titanocendiklorid och trimetylaluminium i toluenlösning .
- Cp 2 TiCl 2 + 2 Al(CH 3 ) 3 → CH 4 + Cp 2 TiCH 2 AlCl(CH 3 ) 2 + Al(CH 3 ) 2 Cl
Efter ca 3 dagar erhålls produkten efter omkristallisation för att avlägsna Al( CH3 ) 2Cl . Även om synteser med det isolerade Tebbe-reagenset ger en renare produkt, har framgångsrika förfaranden med användning av reagenset "in situ" rapporterats. Istället för att isolera Tebbe-reagenset kyls lösningen bara ned i ett isbad eller torrisbad innan utgångsmaterialet tillsätts.
En alternativ men mindre bekväm syntes innebär användning av dimetyltitanocen (Petasis-reagens):
- Cp 2 Ti(CH 3 ) 2 + Al(CH 3 ) 2 Cl → Cp 2 TiCH 2 AlCl(CH 3 ) 2 + CH 4
En nackdel med denna metod, förutom att kräva Cp2Ti( CH3 ) 2 , är svårigheten att separera produkt från oreagerat startreagens.
Reaktionsmekanism
Tebbes reagens i sig reagerar inte med karbonylföreningar, utan måste först behandlas med en mild Lewis-bas , såsom pyridin , som genererar den aktiva Schrock-karbenen .
Också analogt med Wittig-reagenset verkar reaktiviteten drivas av den höga oxofilisiteten hos Ti(IV). Schrock-karbenen ( 1 ) reagerar med karbonylföreningar ( 2 ) för att ge en postulerad oxatitanacyklobutan-mellanprodukt ( 3 ). Denna cykliska intermediär har aldrig isolerats direkt, förmodligen för att den bryts ned omedelbart för att producera den önskade alkenen ( 5 ).
Omfattning
Tebbe-reagenset används i organisk syntes för karbonylmetylenering. Denna omvandling kan också utföras med hjälp av Wittig-reaktionen , även om Tebbe-reagenset är mer effektivt speciellt för steriskt belastade karbonyler. Dessutom är Tebbe-reagenset mindre basiskt än Wittig-reagenset och ger inte β-elimineringsprodukterna.
Metyleneringsreaktioner förekommer även för aldehyder samt estrar , laktoner och amider . Tebbe-reagenset omvandlar estrar och laktoner till enoleter och amider till enaminer. I föreningar som innehåller både keton- och estergrupper reagerar ketonen selektivt i närvaro av en ekvivalent av Tebbe-reagenset.
Tebbe-reagenset metylenerar karbonyler utan att racemisera ett kiralt α-kol. Av denna anledning har Tebbe-reagenset funnit tillämpningar i reaktioner av sockerarter där upprätthållande av stereokemi kan vara avgörande.
Tebbe-reagenset reagerar med syraklorider för att bilda titan-enolater genom att ersätta Cl − .
Ändringar
Det är möjligt att modifiera Tebbes reagens genom användning av olika ligander. Detta kan förändra komplexets reaktivitet, vilket möjliggör ett bredare spektrum av reaktioner. Till exempel cyklopropanering uppnås med användning av en klorerad analog.
Se även
Relaterade organotitanreagenser och reaktioner
- Kulinkovich reaktion
- Petasis reagens
- Lombardo-reagens
- McMurry reaktion




