Koppar(II)hydroxid

|
|

|
|
| Namn | |
|---|---|
|
IUPAC-namn
Koppar(II)hydroxid
|
|
| Andra namn Koppar(II)hydroxid
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard | 100.039.817 |
| KEGG | |
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| Cu(OH) 2 | |
| Molar massa | 97,561 g/mol |
| Utseende | Blå eller blågrön fast |
| Densitet | 3,368 g/cm3 , fast |
| Smältpunkt | 80 °C (176 °F; 353 K) ungefärlig, sönderdelas till CuO |
| försumbar | |
|
Löslighetsprodukt ( K sp )
|
2,20 x 10 −20 |
| Löslighet |
olöslig i etanol ; löslig i NH4OH _ |
| +1170,0·10 -6 cm3 / mol | |
| Termokemi | |
|
Std molär entropi ( S ⦵ 298 ) |
108 J.mol -1 -K -1 |
|
Std formationsentalpi ( Δ f H ⦵ 298 ) |
−450 kJ·mol −1 |
| Faror | |
| Arbetssäkerhet och hälsa (OHS/OSH): | |
|
Huvudsakliga faror
|
Irriterande för hud, ögon och andningsvägar |
| NFPA 704 (branddiamant) | |
| Flampunkt | Ej brandfarlig |
| Dödlig dos eller koncentration (LD, LC): | |
|
LD 50 ( mediandos )
|
1000 mg/kg (oral, råtta) |
| NIOSH (USA:s hälsoexponeringsgränser): | |
|
PEL (tillåtet)
|
TWA 1 mg/m 3 (som Cu) |
|
REL (rekommenderas)
|
TWA 1 mg/m 3 (som Cu) |
|
IDLH (Omedelbar fara)
|
TWA 100 mg/m 3 (som Cu) |
| Säkerhetsdatablad (SDS) | SDS |
| Besläktade föreningar | |
|
Andra anjoner
|
Koppar(II)oxid Koppar(II)karbonat Koppar(II)sulfat Koppar(II)klorid |
|
Andra katjoner
|
Nickel(II)hydroxid Zinkhydroxid Järn(II)hydroxid Kobolthydroxid |
|
Besläktade föreningar
|
Koppar(I)oxid Koppar(I)klorid |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Koppar(II)hydroxid är hydroxiden av koppar med den kemiska formeln Cu(OH) 2 . Det är en blekgrönblå eller blågrön fast substans. Vissa former av koppar(II)hydroxid säljs som "stabiliserad" koppar(II)hydroxid, även om de sannolikt består av en blandning av koppar(II)karbonat och hydroxid. Koppar(II)hydroxid är en stark bas, även om dess låga löslighet i vatten gör detta svårt att observera direkt.
Förekomst
Koppar(II)hydroxid har varit känd sedan kopparsmältningen började omkring 5000 f.Kr. även om alkemisterna förmodligen var de första som tillverkade den genom att blanda lösningar av lut (natrium- eller kaliumhydroxid) och blåvitriol (koppar(II)sulfat). Källor till båda föreningarna fanns tillgängliga i antiken.
Den tillverkades i industriell skala under 1600- och 1700-talen för användning i pigment som blå verditer och Bremengrön . Dessa pigment användes i keramik och målning .
Mineral
Mineralet med formeln Cu(OH) 2 kallas spertinit . Koppar(II)hydroxid finns sällan som ett okombinerat mineral eftersom det långsamt reagerar med koldioxid från atmosfären för att bilda ett basiskt koppar(II)karbonat . Sålunda får koppar långsamt en matt grön beläggning i fuktig luft genom reaktionen:
- 2 Cu(OH) 2 + CO 2 → Cu 2 CO 3 (OH) 2 + H 2 O
Det gröna materialet är i princip en 1:1 molblandning av Cu(OH) 2 och CuCO 3 . Denna patina bildas på brons och andra kopparlegeringsstatyer som Frihetsgudinnan .
Produktion
Koppar(II)hydroxid kan framställas genom att tillsätta natriumhydroxid till en lösning av ett lösligt koppar(II)salt, såsom koppar(II)sulfat (CuSO 4 · 5H 2 O):
- 2NaOH + CuSO4 · 5H2O → Cu (OH ) 2 + 6H2O + Na2SO4
Den på detta sätt framställda fällningen innehåller emellertid ofta vatten och en avsevärd mängd natriumhaltiga föroreningar. Dessutom tenderar denna form av kopparhydroxid att omvandlas till svart koppar(II)oxid :
- Cu(OH) 2 → CuO + H2O
En renare produkt kan uppnås om ammoniumklorid tillsätts till lösningen i förväg för att generera ammoniak in situ. Alternativt kan den framställas i en tvåstegsprocedur från koppar(II)sulfat via "basiskt kopparsulfat:"
- 4 CuSO 4 + 6 NH 3 + 6H 2 O → Cu 4 SO 4 (OH) 6 + 3 (NH 4 ) 2 SO 4
- Cu 4 SO 4 (OH) 6 + 2 NaOH → 4 Cu(OH) 2 + Na 2 SÅ 4
Alternativt tillverkas kopparhydroxid lätt genom elektrolys av vatten (innehållande lite elektrolyt som natriumsulfat eller magnesiumsulfat ) med en kopparanod :
- Cu + 2OH - → Cu(OH) 2 + 2e -
Strukturera
Strukturen av Cu(OH) 2 har bestämts genom röntgenkristallografi. Kopparcentrum är fyrkantigt pyramidformigt. Fyra Cu-O-avstånd i det plana området är 1,96 Å, och det axiella Cu-O-avståndet är 2,36 Å. Hydroxidliganderna i planet är antingen dubbelbryggande eller trippelbryggande.
Reaktioner
Det är stabilt till cirka 100 °C.
Koppar(II)hydroxid reagerar med en lösning av ammoniak för att bilda en djupblå lösning av tetramminkoppar [Cu(NH 3 ) 4 ] 2+ komplexjon .
Koppar(II)hydroxid katalyserar oxidationen av ammoniaklösningar i närvaro av dioxygen, vilket ger upphov till kopparaminnitrit, såsom Cu(NO 2 ) 2 ( NH 3 ) n .
Koppar(II)hydroxid är milt amfoter . Det löser sig något i koncentrerad alkali och bildar [Cu(OH) 4 ] 2− .
Reagens för organisk kemi
Koppar(II)hydroxid har en ganska specialiserad roll i organisk syntes . När det används för detta ändamål framställs det ofta in situ genom att blanda ett lösligt koppar(II)salt och kaliumhydroxid .
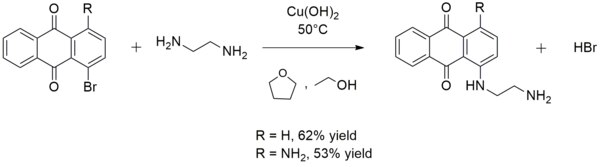
Det används ibland vid syntes av arylaminer . Till exempel katalyserar koppar(II)hydroxid reaktionen av etylendiamin med 1-bromantrakinon eller 1-amino-4-bromantrakinon för att bilda 1-((2-aminoetyl)amino)antrakinon eller 1-amino-4-((2-aminoetyl) )amino)antrakinon, respektive:
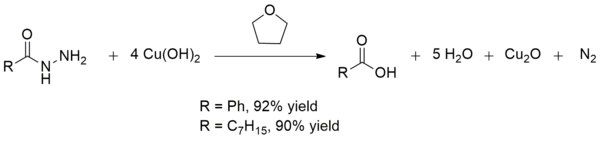
Koppar(II)hydroxid omvandlar också sura hydrazider till karboxylsyror vid rumstemperatur. Denna omvandling är användbar vid syntes av karboxylsyror i närvaro av andra bräckliga funktionella grupper . Utbytena är i allmänhet utmärkta, vilket är fallet med produktionen av bensoesyra och oktansyra :
Används
Koppar(II)hydroxid i ammoniaklösning, känd som Schweizers reagens , har den intressanta förmågan att lösa upp cellulosa . Denna egenskap ledde till att den användes vid tillverkning av rayon , en cellulosafiber .
Det används också flitigt i akvarieindustrin för sin förmåga att förstöra yttre parasiter hos fisk, inklusive flukes, marine ich , Brooklynellose och marin sammet , utan att döda fisken. Även om andra vattenlösliga kopparföreningar kan vara effektiva i denna roll, resulterar de i allmänhet i hög fiskdödlighet.
Koppar(II)hydroxid har använts som ett alternativ till Bordeaux-blandningen , en fungicid och nematicid . Sådana produkter inkluderar Kocide 3000, tillverkad av Kocide LLC. Koppar(II)hydroxid används också ibland som keramiskt färgämne .
Koppar(II)hydroxid har kombinerats med latexfärg, vilket gör en produkt utformad för att kontrollera rottillväxt i krukväxter. Sekundära och laterala rötter frodas och expanderar, vilket resulterar i ett tätt och friskt rotsystem. Den såldes under namnet Spin Out, som först introducerades av Griffin LLC. Rättigheterna ägs nu av SePRO Corp. Den säljs nu som Microkote antingen i en lösning du applicerar själv, eller som behandlade krukor.
Andra koppar(II)hydroxider

Tillsammans med andra komponenter är koppar(II)hydroxider många. Flera koppar(II)-haltiga mineraler innehåller hydroxid. Anmärkningsvärda exempel inkluderar azurit , malakit , antlerit och brochantite . Azurit (2CuCO 3 ·Cu(OH) 2 ) och malakit (CuCO 3 · Cu(OH) 2 ) är hydroxikarbonater , medan antlerit (CuSO 4 · 2Cu(OH) 2 ) och brochantit (CuSO 4 · 3Cu(OH) 2 ) är hydroxisulfater .
Många syntetiska koppar(II)hydroxidderivat har undersökts.