Multipel förskjutningsförstärkning
Multiple displacement amplification (MDA) är en DNA- amplifieringsteknik. Denna metod kan snabbt amplifiera små mängder DNA-prover till en rimlig mängd för genomisk analys. Reaktionen startar genom att slumpmässiga hexamerprimrar hybridiseras till mallen: DNA-syntes utförs av ett högtroget enzym , företrädesvis Φ29 DNA-polymeras . Jämfört med konventionella PCR -amplifieringstekniker använder MDA inte sekvensspecifika primrar utan amplifierar allt DNA, genererar större produkter med en lägre felfrekvens och arbetar vid en konstant temperatur. MDA har använts aktivt i helgenomamplifiering (WGA) och är en lovande metod för tillämpning på encellsgenomsekvensering och sekvenseringsbaserade genetiska studier.
Bakgrund
Många biologiska och kriminaltekniska fall som involverar genetisk analys kräver sekvensering av DNA från små mängder prov, såsom DNA från oodlade enstaka celler eller spårmängder av vävnad som samlats in från brottsplatser. Konventionella polymeraskedjereaktions ( PCR )-baserade DNA-amplifieringsmetoder kräver sekvensspecifika oligonukleotidprimrar och värmestabilt (vanligtvis Taq ) polymeras , och kan användas för att generera betydande mängder DNA från små mängder DNA. Detta är dock inte tillräckligt för moderna tekniker som använder sekvenseringsbaserad DNA-analys. Därför är en mer effektiv icke-sekvensspecifik metod för att amplifiera små mängder DNA nödvändig, särskilt i encelliga genomiska studier.
Material
Phi 29 DNA-polymeras
Bakteriofag Φ29 DNA-polymeras är ett enzym med hög processivitet som kan producera DNA-amplikoner större än 70 kilobaspar. Dess högtrohet och 3'–5' korrekturläsningsaktivitet minskar amplifieringsfelfrekvensen till 1 på 10 6 -10 7 baser jämfört med konventionellt Taq - polymeras med en rapporterad felfrekvens på 1 på 9 000. Reaktionen kan utföras vid måttliga isotermiska förhållanden på 30 °C och kräver därför ingen termocykler . Det har använts aktivt i cellfri kloning, vilket är den enzymatiska metoden för att amplifiera DNA in vitro utan cellodling och DNA-extraktion . Det stora fragmentet av Bst DNA-polymeras används också i MDA, men Ф29 är generellt föredraget på grund av dess tillräckliga produktutbyte och korrekturläsningsaktivitet.
Hexamer primers
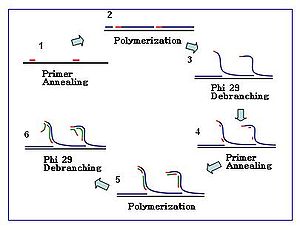
Hexamerprimrar är sekvenser som består av sex slumpmässiga nukleotider . För MDA-applikationer är dessa primrar vanligtvis tiofosfatmodifierade i 3'-änden för att förmedla resistens mot 3'–5' exonukleasaktiviteten av Ф29 DNA- polymeras . MDA-reaktioner börjar med hybridisering av sådana primrar till DNA-mallen följt av polymerasmedierad kedjeförlängning. Ett ökande antal primer-annealing-händelser inträffar längs amplifieringsreaktionen.
Reaktion
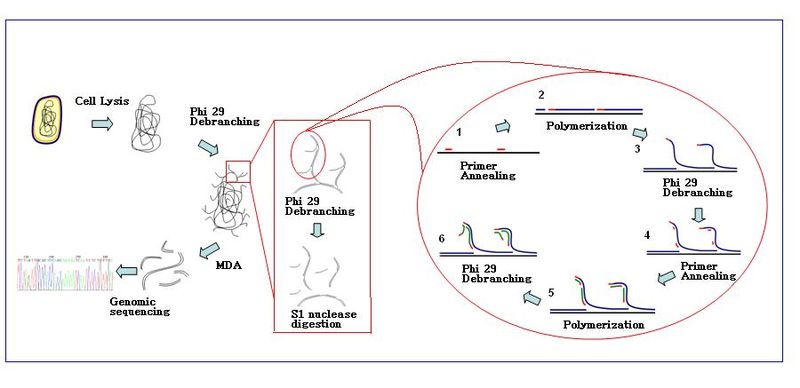
Amplifieringsreaktionen initieras när flera primerhexamerer hybridiserar till mallen. När DNA-syntesen fortsätter till nästa startställe förskjuter polymeraset den nyproducerade DNA-strängen och fortsätter sin strängförlängning. Strängförskjutningen genererar en nysyntetiserad enkelsträngad DNA-mall för fler primrar att hybridisera. Ytterligare primer-annealing och strängförskjutning på den nyligen syntetiserade mallen resulterar i ett hypergrenat DNA-nätverk. Sekvensavgreningen under amplifiering resulterar i ett högt utbyte av produkterna. För att separera DNA-förgreningsnätverket S1-nukleaser för att klyva fragmenten vid undanträngningsställen. Hacken på de resulterande DNA-fragmenten repareras av - polymeras I.
Produktkvalité
MDA kan generera 1–2 µg DNA från en cell med genomtäckning på upp till 99 %. Produkter har också lägre felfrekvens och större storlekar jämfört med PCR-baserad Taq -förstärkning.
Allmänt arbetsflöde för MDA:
- Provberedning : Prover samlas in och späds i lämplig reaktionsbuffert (Ca 2+ och Mg 2+ fria). Celler lyseras med alkalisk buffert .
- Villkor : MDA-reaktionen med Ф29-polymeras utförs vid 30 °C. Reaktionen tar vanligtvis cirka 2,5–3 timmar.
- Slut på reaktionen : Inaktivera enzymer vid 65 °C före uppsamling av de amplifierade DNA-produkterna
- DNA-produkter kan renas med kommersiellt reningskit.
Fördelar
MDA genererar tillräckligt utbyte av DNA-produkter. Det är ett kraftfullt verktyg för att amplifiera DNA-molekyler från prover, såsom oodlade mikroorganismer eller enstaka celler till den mängd som skulle vara tillräcklig för sekvenseringsstudier . Den stora storleken på MDA-amplifierade DNA-produkter ger också önskvärd provkvalitet för att identifiera storleken på polymorfa repeterande alleler. Dess högtrohet gör den också tillförlitlig att användas i singelnukleotidpolymorfism ( SNP) alleldetektering. På grund av dess strängförskjutning under amplifiering har det amplifierade DNA:t tillräcklig täckning av käll-DNA-molekylerna, vilket ger en högkvalitativ produkt för genomisk analys. Produkterna av undanträngda strängar kan därefter klonas in i vektorer för att konstruera bibliotek för efterföljande sekvenseringsreaktioner .
Begränsningar
Allelic dropout (ADO)
ADO definieras som den slumpmässiga icke-amplifieringen av en av allelerna som finns i ett heterozygot prov. Vissa studier har rapporterat att ADO-frekvensen för MDA-produkterna är 0–60 %. Denna nackdel minskar noggrannheten av genotypning av enstaka prov och feldiagnostik i andra MDA-inblandade applikationer. ADO verkar vara oberoende av fragmentstorlekarna och har rapporterats ha en liknande hastighet i andra encellstekniker. Möjliga lösningar är användningen av olika lysförhållanden eller att utföra flera omgångar av amplifieringar från de utspädda MDA-produkterna eftersom PCR- medierad amplifiering från odlade celler har rapporterats ge lägre ADO-hastigheter.
Företrädesvis förstärkning
"Preferentiell amplifiering" är överamplifiering av en av allelerna i jämförelse med den andra. De flesta studier på MDA har rapporterat detta problem. Amplifieringsbiasen observeras för närvarande vara slumpmässig. Det kan påverka analysen av små sträckor av genomiskt DNA vid identifiering av Short Tandem Repeats (STR) alleler.
Primer-primer-interaktioner
Endogen malloberoende primer-primer-interaktion beror på den slumpmässiga utformningen av hexamer-primers. En möjlig lösning är att designa begränsade randomiserade hexanukleotidprimrar som inte korshybridiserar.
Ansökningar
Encellsgenomsekvensering
, arkéer och protister, samt enskilda viruspartiklar och enstaka svampsporer har sekvenserats med hjälp av MDA.
Förmågan att sekvensera individuella celler är också användbar för att bekämpa mänskliga sjukdomar. Genom från enstaka mänskliga embryonala celler har framgångsrikt amplifierats för sekvensering med hjälp av MDA, vilket möjliggör preimplantationsgenetisk diagnos (PGD): screening för genetiska hälsoproblem i ett tidigt embryo före implantation . Sjukdomar med heterogena egenskaper, såsom cancer , drar också nytta av MDA-baserad genomsekvensering förmåga att studera mutationer i enskilda celler.
MDA-produkterna från en enda cell har också framgångsrikt använts i array-jämförande genomiska hybridiseringsexperiment, som vanligtvis kräver en relativt stor mängd amplifierat DNA.
Kromatinimmunfällning
Chromatin Immunoprecipitation resulterar i produktion av komplexa blandningar av relativt korta DNA-fragment, vilket är utmanande att amplifiera med MDA utan att orsaka en bias i fragmentrepresentationen. En metod för att kringgå detta problem föreslogs, vilken är baserad på omvandling av dessa blandningar till cirkulära konkatemerer med hjälp av ligering, följt av Φ29 DNA-polymerasmedierad MDA.
Forensisk analys
Spårmängden av prover som samlats in från brottsplatser kan förstärkas av MDA till den kvantitet som räcker för kriminalteknisk DNA-analys, som vanligtvis används för att identifiera offer och misstänkta.
Se även
- Polymeraskedjereaktion
- Helgenomförstärkning