Protectin D1
|
|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
(4Z , 7Z ,10R , 11E , 13E , 15Z , 17S , 19Z ) -10,17 -dihydroxydocosa-4,7,11,13,15,19-hexaensyra |
|
| Andra namn 10R,17S-dihydroxi-docosa-4Z,7Z,11E,13E,15Z,19Z-hexaenoat; 10R,17S-dihydroxi-docosa-4Z,7Z,11E,13E,15Z,19Z-hexaensyra; Neuroprotektin D1
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChemSpider | |
|
PubChem CID
|
|
| UNII | |
|
|
|
|
| Egenskaper | |
| C22H32O4 _ _ _ _ _ | |
| Molar massa | 360,4871 g/mol |
| Densitet | 1,049 g/cm 3 |
| Kokpunkt | 559,379 °C (1 038,882 °F; 832,529 K) |
| 0,0069 | |
| log P | 4,95 |
| Surhet (p K a ) | 4,82 |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Protectin D1 , även känt som neuroprotectin D1 (när det verkar i nervsystemet) och oftast förkortat som PD1 eller NPD1 är en medlem av klassen specialiserade proresolving-mediatorer . Liksom andra medlemmar av denna klass av fleromättade fettsyrametaboliter har den stark antiinflammatorisk, anti-apoptotisk och neuroprotektiv aktivitet. PD1 är en alifatisk acyklisk alken med en längd av 22 kolatomer med två hydroxylgrupper vid 10- och 17-kolpositionerna och en karboxylsyragrupp vid en kolposition.
Specifikt är PD1 en endogen stereoselektiv lipidmediator klassificerad som ett autokoid- protetin. Autacoider är enzymatiskt härledda kemiska mediatorer med distinkta biologiska aktiviteter och molekylära strukturer. Protectiner är signalmolekyler som produceras enzymatiskt från omättade fettsyror. Deras molekylära struktur kännetecknas av närvaron av ett konjugerat system av dubbelbindningar. PD1, liksom andra protectiner, produceras genom syresättning av den fleromättade ω-3 fettsyran dokosahexaensyra (DHA) och den finns i många vävnader, såsom näthinnan, lungorna och nervsystemet.
PD1 har en betydande roll som en antiinflammatorisk, anti-apoptotisk och neuroprotektiv molekyl. Studier i Alzheimers sjukdom , hos strokepatienter och i humana pigmentepitelceller från näthinnan (RPE) har visat att PD1 potentiellt kan minska inflammation inducerad av oxidativ stress och hämma den pro-apoptotiska signalen och därigenom förhindra cellulär degeneration. Slutligen har nya studier som undersöker patogeniciteten hos influensavirus, inklusive fågelinfluensan (H5N1), föreslagit att PD1 potentiellt kan stoppa spridningen av viruset och på så sätt skydda luftvägsceller från dödliga virusinfektioner.
Biosyntes av PD1
In vivo produceras PD1 huvudsakligen som ett svar på inflammatoriska signaler och det finns i olika vävnader, såsom retinapigmentepitelceller, lungepitelceller , perifera mononukleära blodceller (PBMC) och neurala vävnader. Studier i PBMC har visat att endogen DHA, den huvudsakliga prekursorn till PD1, frisätts av aktiviteten av fosfolipas A2 . Enligt dessa studier syntetiseras PD1 företrädesvis i PBMC-celler snedställda till Typ 2 T-hjälparcellsfenotypen (TH 2 ). Detta tyder på att T-cellsdifferentiering spelar en viktig roll i aktiveringen av PD1 biosyntesvägen. Interaktionen mellan PBMC och interleukin 4 (IL-4), en potent inflammatorisk signal, leder till differentieringen av PBMC till lymfocyter av TH 2 -typ. Dessutom frisätter aktiverade TH 2 -celler ytterligare IL-4, vilket leder till uppreglering av enzymet 15-lipoxygenas-1 (15-LO-1). 15-LO-1 är ett icke -hemjärnbärande dioxygenas som tillför syreatomer på ett stereospecifikt sätt på fria och förestrade ω-3 fleromättade fettsyror som DHA. Sammantaget fortsätter biosyntesen av PD1 genom tre distinkta steg genom vilka aktiviteten av 15-LO-1 är väsentlig. I det första steget av biosyntesvägen leder bindningen av 15-LO-1 till dess substrat (DHA) till bildningen av (17S ) -hydro(peroxi)-DHA-mellanprodukten. Denna mellanprodukt bearbetas snabbt för att bilda en 16(17)-epoxidinnehållande molekyl, som är den andra mellanprodukten. Slutligen, i det tredje steget av vägen, leder enzymatisk hydrolys av den 16(17)-epoxidinnehållande intermediären till bildningen av PD1.
Funktioner av PD1
I allmänhet uppvisar PD1 in vivo en potent anti-apoptotisk och antiinflammatorisk aktivitet i de vävnader i vilka den är lokaliserad. DHA, den huvudsakliga PD1-prekursorn, finns mestadels i vävnader som retinala synapser, fotoreceptorer , lungorna och hjärnan, vilket tyder på att dessa vävnader är mer benägna att dra nytta av den skyddande aktiviteten hos PD1.
Aktivitet av PD1 i näthinnan
RPE är avgörande för överlevnaden och förnyelsen av fotoreceptorerna i näthinnan. Dessa celler uppvisar en potent fagocytisk aktivitet som säkerställer en korrekt funktion av näthinnan. Därför kan oxidativ stress potentiellt skada RPE-cellerna och orsaka synnedsättning. Studier på mänskliga RPE-celler har föreslagit att närvaron av oxidativ stress som utlöser molekyler, såsom H 2 O 2 , orsakar fragmentering av DNA som i sin tur utlöser apoptos . Dessa studier har föreslagit att PD1 fungerar som en signalmolekyl och genom sin ligand-receptor-interaktion nedreglerar uttrycket av gener, såsom transkriptionsfaktorn NF -KB . Hämningen av NF-KB resulterar i nedreglering av den pro-inflammatoriska genen COX-2 ( cyklooxygenas-2 ) som är ansvarig för frisättningen av prostaglandiner , en potent pro-inflammatorisk mediator. Dessutom har PD1 en viktig roll för att reglera uttrycket av Bcl-2 -familjens proteiner (Bcl-2, Bcl-xL , Bax och Bad) som föregår frisättningen av cytokrom c- komplexet från mitokondrierna och bildandet av apoptosom . Närvaron av PD1 uppreglerar uttrycket av de anti-apoptotiska proteinerna Bcl-2 och Bcl-xL, medan det hämmar uttrycket av de pro-apoptotiska proteinerna Bax och Bad. Specifikt reglerar PD1 denna proteinfamilj genom att främja defosforyleringen av Bcl-xL av proteinfosfatas 2A (PP2A) vid rest Ser-62 som i sin tur heterodimeriserar med det pro-apoptotiska proteinet Bax och inaktiverar det. Följaktligen resulterar aktiviteten hos Bcl-2-familjens proteiner i hämning av kaspas 3- enzymet, vilket förhindrar apoptos och främjar RPE-cellöverlevnad.
Effekter av PD1 vid Alzheimers sjukdom
Alzheimers sjukdom kännetecknas bland annat av den minskade koncentrationen av PD1 och av den ökade koncentrationen av amyloid-β-peptiden (Aβ42) som är ansvarig för bildandet av senila plack och även inducerar inflammation och apoptos i neuronala vävnader. Aβ42 genereras av den enzymatiska klyvningen av β-amyloidprekursorproteinet (βΑPP) genom β- och γ-sekretaser. Liksom andra pro-inflammatoriska mediatorer inducerar Aβ42 inflammation genom aktivering av det pro-inflammatoriska enzymet COX-2 och frisättning av prostaglandiner. Dessutom nedreglerar frisättningen av Aβ42 de anti-apoptotiska proteinerna Bcl-2 och Bcl-xL och uppreglerar de pro-apoptotiska proteinerna Bax och Bad som i slutändan leder till bildandet av apoptosomen. PD1 i humana neuronala gliaceller (HNG) har visat sig utlösa nedregleringen av βΑPP, vilket minskar Aβ42-innehållet i neuronala vävnader och minskar inflammation och apoptos. Specifikt har PD1 i Alzheimers sjukdomsmodeller visat sig svara på den ökade koncentrationen av den pro-inflammatoriska molekylen Aβ42 genom att binda och aktivera den peroxisomproliferatoraktiverade receptorgamma (PPARy) antingen direkt eller via andra mekanismer. Enligt vissa modeller leder aktiveringen av PPARγ till ökad ubiquitination och nedbrytning av βAPP, vilket minskar frisättningen av Aβ42. Vidare hämmar PD1 produktionen av Aβ42-peptid genom att nedreglera β-sekretas-1 (BACE1), samtidigt som α-sekretaset ADAM10 och det utsöndrade amyloidprekursorproteinet-α (sAPPα) uppregleras. Sammantaget leder ovanstående mekanism till klyvning av βAPP-protein genom en icke-amyloidogen väg som stoppar bildningen av Aβ42 och förhindrar den förtida neuronala degenerationen.
Antiviral aktivitet av PD1
Studier på odlade humana lungepitelceller infekterade med influensaviruset H1N1 eller H5N1 har funnit att endogen produktion av PD1 minskar dramatiskt under infektion på grund av hämningen av 15-LO-1. Dessutom har samma studier visat att in vivo-administration av PD1 till H1N1-infekterade möss potentiellt kan hämma både spridningen av viruset och inflammationen som orsakas av infektionen, vilket ökar överlevnaden. PD1 skyddar mot virusinfektioner genom att störa virusets livscykel. Specifikt hämmar PD1 bindningen av viralt RNA till specifika kärnexportfaktorer i värdcellerna, vilket blockerar exporten av viralt RNA från kärnan till cytosolen. Den nukleära RNA-exportfaktorn 1 (NXF1) är av särskilt intresse för attenueringen av virusinfektioner via aktiviteten av PD1. Närmare bestämt NXF1- transportören genom dess mitt- och C-terminala domäner till fenylalanin/glycinupprepningarna i nukleoporinerna ( Nups ) som kantar kärnporen . I frånvaro av PD1 binder influensavirus-RNA till NXF1-transportören som senare binder specifikt till Nup62-nukleoporin och exporterar det virala RNA:t till cytosolen . Administrering av PD1 har emellertid visat att denna lipidmediator specifikt hämmar bindningen av det virala RNA:t till NXF1, och därmed stör spridningen av viruset.
Laboratoriesyntes av PD1
Den storskaliga industriella produktionen av PD1 är av stort intresse för läkemedelsföretag för att skörda de potenta antiinflammatoriska och anti-apoptotiska aktiviteterna hos denna lipidmediator. Hittills har mycket få stereoselektiva laboratoriesynteser av PD1 rapporterats, men med ett relativt lågt utbyte.
Konvergent stereoselektiv syntes
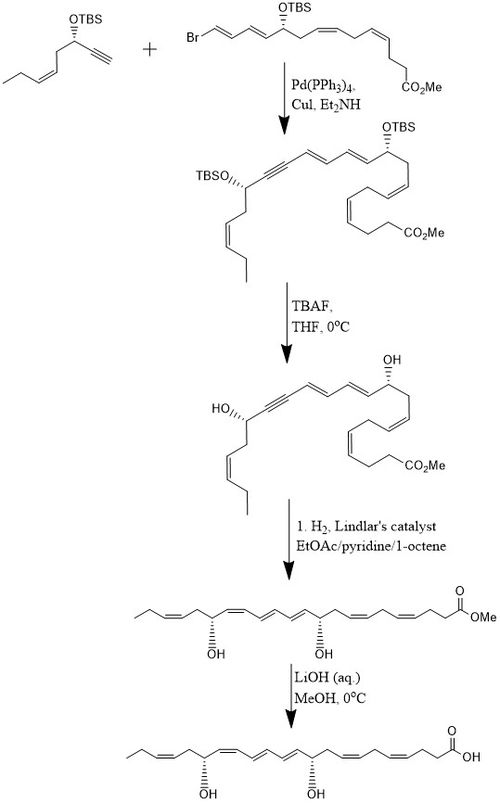
Enligt en metod syntetiseras PD1 i 15 % utbyte genom en 8-stegs konvergent stereoselektiv process . Inledningsvis alkyn , ( Z )-3-tertbutyldimetylsiloxi-okt-5-en-1-yn med brom- E , E , Z , Z - tetraenester i en Sonogashira-korskopplingsreaktion vid rumstemperatur i närvaro av Pd-(PPh3 ) 4 och Cul med dietylamin som lösningsmedel som producerar den bis-hydroxylskyddade metylestern. Avlägsnande av de två tert-butyldimetylsilyletrarna (TBS-skyddande grupper) uppnås med ett överskott av TBAF i THF vid 0°C vilket ger en diol innehållande en konjugerad alkyn. Den konjugerade alkynen reduceras till metylestern. Dessutom hydreras diolen med hjälp av Lindlar-katalysatorn , med 1-okten tillsatt som en offerolefin, för att producera en mycket stereoselektiv trien, medan vatten elimineras från diolen genom en Boland-reduktion. Slutligen genomgår metylestern förtvålning vid 0 °C med utspädd LiOH (aq.) i metanol följt av sur upparbetning med NaH 2 PO 4 (aq.) för att producera PD1.
Alternativ stereoselektiv syntes
Alternativt fortsätter PD1 laboratoriesyntes genom en annan stereoselektiv metod. Initialt producerar hydroborering av en TBS-skyddad acetylen med Sia2BH en TBS-skyddad vinylboran . Den TBS-skyddade vinylboranen reagerar med vinyljodid i närvaro av en Pd-katalysator, natriumhydroxid (NaOH) och THF för att producera en TBS-skyddad alkohol. Senare behandling av den TBS-skyddade alkoholen med TBAF tar bort skyddsgruppen och producerar en diol. Slutligen hydrolyseras diolen med LiOH i THF (aq.) för att producera PD1.
Andra PD:er
22-hydroxi-NPDl
( 22-OH-PD1; dvs. 10R , 17S , 20-trihydroxi-4Z , 7Z , 11E , 13E ,15Z , 19Z - dokosahexaensyra) är en omega-oxidationsprodukt av PD1 bildas troligen i celler genom verkan av ett oidentifierat Cytokrom P450 omega hydroxylas (se specialiserade förupplösningsmediatorer#Protectins/neuroprotectins ) . Medan omega-oxidationen av många bioaktiva fettsyrametaboliter såsom leukotrien B4 , 5-HETE , 5-oxo-eicosatetraensyra (dvs. 5-oxo-ETE) resulterar i en ~100-faldig minskning av deras aktivitet, den omega-oxiderade produkten av PD1 har visat sig ha potent lätthet uppvisar potenta anti-inflammatoriska och prolösande effekter genom att hämma PMN-kemotaxi in vivo och in vitro och minskade pro-inflammatoriska mediatornivåer i inflammatoriska exsudat från en djurmodell vid nivåer jämförbara med PD1.
Protectin DX
Protectin DX (PDX; dvs. 10S , 17S - dihydroxi-4Z , 7Z , 11E , 13Z , 15E ,19Z - dokosahexaensyra) är 13Z , 15E , 19Z - isomeren av NPD1 (som har 13E ,15Z ,19Z - dubbelbindningskonfigurationen)(se specialiserade förupplösningsmediatorer#Protectins/ neuroprotectins ) . En tidig studie använde felaktigt PDX istället för PD1 för att tillskriva PD1 antireplikativa och kliniskt fördelaktiga effekter vid viral influensasjukdom i en musmodell. PDX hämmar också inflödet av cirkulerande leukocyter i bukhinnan i en musmodell av inflammation. PDX har andra antiinflammatoriska effekter. Det hämmar COX-1 och COX-2 och blockerar därigenom bildningen av pro-inflammatoriska prostaglandiner ; det hämmar också trombocytaggregationsverkan av tromboxan A2 och blockerar därigenom blodplättsaggregationssvaren på medel som är beroende av trombocyter för att frigöra tromboxan A2.
Aspirin-utlöst PD1
( AT-PD1 eller 17 - epi-PD1: dvs 10R , 17R - dihydroxi-4Z , 7Z , 11E ,13E , 15Z , 19Z -dokosahexaensyra) är 10R- hydroxiisomer av PD1 (som har 10 S hydroxiresten) (se specialiserade förupplösningsmediatorer#Protectins/neuroprotectins ) . AT-PD1 har visats a) minska infiltrationen av neutrofiler i bukhinnan i en musmodell av inflammatorisk sjukdom; b) stimulera efferocytos (dvs uppslukning och avlägsnande) av neutrofiler; och c) minska hjärninfarkt och stroke i en gnagarmodell.
10-epi-PD1
: dvs 10S , 17S - Dihydroxi-4Z , 7Z , 11E , 13E , 15Z ,19Z - dokosahexaensyra) är 10S - hydroxiisomeren av AT-PD1 (som har en 10 R -hydroxirest) (se specialiserade förupplösningsmediatorer#Protectins/neuroprotectins ) . 10-Epi-PD1 detekterades i endast en liten mängd i humana PMN-extrakt men var mer potent än PD1 eller PDX för att blockera det inflammatoriska svaret på zymosan A-inducerad murin akut peritonit.
- ^ a b c d e f g h Ariel A, Li PL, Wang W, Tang WX, Fredman G, Hong S, Serhan CN (oktober 2010). "Docosatrien-protetin D1 produceras av TH2-skevning och främjar mänsklig T-cellsapoptos via lipidflotta-klustring" . J. Biol. Chem . 280 (52): 43079–43086. doi : 10.1074/jbc.M509796200 . PMID 16216871 .
- ^ a b c d e f g h i Mukherjee PK, Marcheselli VL, Serhan CN, Bazan NG (juni 2004). "Neuroprotectin D1: en dokosahexaensyra-deriverad dokosatrien skyddar mänskliga retinala pigmentepitelceller från oxidativ stress" . Proc. Natl. Acad. Sci. USA . 101 (22): 8491–8496. doi : 10.1073/pnas.0402531101 . PMC 420421 . PMID 15152078 .
- ^ a b c d e f Calandria JM, Marcheselli VL, Mukherjee PK, Uddin J, Winkler JW, Petasis NA, Bazan NG (april 2009). "Selektiv överlevnadsräddning i 15-lipoxygenas-1-bristiga retinala pigmentepitelceller av den nya docosahexaensyra-härledda mediatorn, neuroprotectin D1" . J. Biol. Chem . 284 (26): 17877–17882. doi : 10.1074/jbc.M109.003988 . PMC 2719426 . PMID 19403949 .
- ^ a b c d e Antony R, Lukiw WJ, Bazan NG (april 2010). "Neuroprotectin D1 inducerar defosforylering av Bcl-xL på ett PP2A-beroende sätt under oxidativ stress och främjar överlevnad av retinala pigmentepitelceller" . J. Biol. Chem . 285 (24): 18301–18308. doi : 10.1074/jbc.M109.095232 . PMC 2881755 . PMID 20363734 .
- ^ a b c d e f Zhao Y, Calon F, Julien C, Winkler JW, Petasis NA, Lukiw WJ, Bazan NG (januari 2011). "Dokosahexaensyra-härlett neuroprotektin D1 inducerar neuronal överlevnad via sekretas- och PPARy-medierade mekanismer i Alzheimers sjukdomsmodeller" . PLOS One . 6 (1): e15816. Bibcode : 2011PLoSO...615816Z . doi : 10.1371/journal.pone.0015816 . PMC 3016440 . PMID 21246057 .
- ^ a b c García-Sastre A (juli 2013). "Lektioner från lipider i kampen mot influensa" . Cell . 154 (1): 22–23. doi : 10.1016/j.cell.2013.06.024 . PMID 23827671 .
- ^ a b c d e f Morita M, Kuba K, Ichikawa A, Nakayama M, Katahira J, Iwamoto R, Imai Y (mars 2013). "Lipidmediatorn protectin D1 hämmar replikering av influensavirus och förbättrar svår influensa. " Cell . 153 (1): 112–125. doi : 10.1016/j.cell.2013.02.027 . PMID 23477864 .
- ^ Serhan CN, Gotlinger K, Hong S, Lu Y, Siegelman J, Baer T, Petasis NA (februari 2006). "Anti-inflammatoriska effekter av neuroprotectin D1/protectin D1 och dess naturliga stereoisomerer: tilldelningar av dihydroxi-innehållande docosatriener" . J. Immunol . 176 (3): 1848–59. doi : 10.4049/jimmunol.176.3.1848 . PMID 16424216 .
- ^ a b c Clementi ME, Pezzotti M, Orsini F, Sampaolese B, Mezzogori D, Grassi C, Misiti F (mars 2006). "Alzheimers amyloid β-peptid (1–42) inducerar celldöd i humant neuroblastom via ökning av bax/bcl-2-förhållandet: En spännande roll för metionin 35". Biochem Biophys Res Commun . 342 (1): 206–213. doi : 10.1016/j.bbrc.2006.01.137 . PMID 16472763 .
- ^ a b c Aursnes M, Tungen JE, Vik A, Dalli J, Hansen TV (november 2013). "Stereoselektiv syntes av protectin D1: en potent antiinflammatorisk och prolösande lipidmediator" . Org Biomol Chem . 12 (3): 432–437. doi : 10.1039/c3ob41902a . PMC 3904955 . PMID 24253202 .
- ^ a b c Ogawa N, Kobayashi Y (juni 2011). "Total syntes av det antiinflammatoriska och lösande skyddet D1". Tetrahedron Lett . 52 (23): 3001–3004. doi : 10.1016/j.tetlet.2011.03.152 .
- ^ Tungen JE, Aursnes M, Vik A, Ramon S, Colas RA, Dalli J, Serhan CN, Hansen TV (2014). "Syntes och antiinflammatoriska och pro-upplösande aktiviteter av 22-OH-PD1, en monohydroxylerad metabolit av protectin D1" . Journal of Natural Products . 77 (10): 2241–7. doi : 10.1021/np500498j . PMC 4208671 . PMID 25247845 .
- ^ a b Balas L, Durand T (2016). "Dihydroxylerade E,E,Z-dokosatriener. En översikt över deras syntes och biologiska betydelse". Framsteg inom lipidforskning . 61 : 1–18. doi : 10.1016/j.plipres.2015.10.002 . PMID 26545300 .
- ^ Balas L, Guichardant M, Durand T, Lagarde M (2014). "Förvirring mellan protectin D1 (PD1) och dess isomer protectin DX (PDX). En översikt över de dihydroxi-docosatriener som hittills beskrivits". Biochimie . 99 : 1–7. doi : 10.1016/j.biochi.2013.11.006 . PMID 24262603 .
- ^ Stein K, Stoffels M, Lysson M, Schneiker B, Dewald O, Krönke G, Kalff JC, Wehner S (2016). "En roll för 12/15-lipoxygenas-härledda proresolving mediatorer i postoperativ ileus: protectin DX-reglerad neutrofil extravasation" . Journal of Leukocyte Biology . 99 (2): 231–9. doi : 10.1189/jlb.3HI0515-189R . PMID 26292977 . S2CID 28347830 .
- ^ Lagarde M, Véricel E, Liu M, Chen P, Guichardant M (2014). "Struktur-funktionsförhållanden för icke-cykliska dioxygenasprodukter från fleromättade fettsyror: poxytriner som en klass av bioaktiva derivat" . Biochimie . 107 Pt A: 91–4. doi : 10.1016/j.biochi.2014.09.008 . PMID 25223888 .
- ^ Serhan CN, Dalli J, Colas RA, Winkler JW, Chiang N (2015). "Protectins and maresins: New pro-resolving familys of mediators in akut inflammation and resolution bioactive metabolome" . Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids . 1851 (4): 397–413. doi : 10.1016/j.bbalip.2014.08.006 . PMC 4324013 . PMID 25139562 .
externa länkar
- Protectin D1 / PubChem-förening
- Neuroprotectin D1 / Human Metabolome Database (HMDB)
- Protectin D1 / Gratis kemisk strukturdatabas (ChemSpider)
- Neuroprotectin D1 / Food Component Database (FooDB)
- Neuroprotektin D1 / Lipid Metabolites and Pathways Strategy (LIPID MAPS)