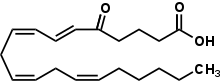
5-Oxo-eikosatetraensyra
|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
(6E , 8Z , 11Z , 14Z ) -5-Oxoicosa-6,8,11,14-tetraensyra |
|
Andra namn
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| KEGG | |
|
PubChem CID
|
|
|
|
|
|
| Egenskaper | |
| C20H30O3 _ _ _ _ _ | |
| Molar massa | 318,457 g·mol -1 |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
5-oxo-eikosatetraensyra ( dvs. 5-oxo-6 E ,8Z ,11Z , 14Z -eikosatetraensyra; även kallad 5 -oxo-ETE och 5-oxoETE ) är en icke-klassisk eikosanoidmetabolit av arakidonsyra och den mest potent naturligt förekommande medlem av 5-HETE- familjen av cellsignaleringsmedel . Liksom andra cellsignaleringsmedel tillverkas 5-oxo-ETE av en cell och återkopplas sedan för att stimulera sin modercell (se Autokrin signalering ) och/eller lämnar denna cell för att stimulera närliggande celler (se parakrin signalering ). 5-Oxo-ETE kan stimulera olika celltyper, särskilt humana leukocyter , men har sin högsta styrka och kraft för att stimulera den humana eosinofil typen av leukocyter. Det föreslås därför bildas under och vara ett viktigt bidrag till bildandet och progressionen av eosinofilbaserade allergiska reaktioner; Det föreslås också att 5-oxo-ETE bidrar till utvecklingen av inflammation , cancercelltillväxt och andra patologiska och fysiologiska händelser.
Biokemi och produktion
På det vanligaste sättet för dess produktion, gör celler 5-oxo-ETE i en fyrstegsväg som involverar deras stimulusinducerade aktivering av följande väg: a) frisättning av arakidonsyra (dvs 5Z,8Z,11Z,14Z- eikosatetraensyra) från dess lagringsställen i membranfosfolipider på grund av aktiveringen av fosfolipas A2- enzymer; b) syresättning av denna arakidonsyra med aktiverat arakidonat-5-lipoxygenas ( ALOX5) för att bilda 5( S )-hydroperoxi-6E , 8Z ,11Z ,14Z - eikosatetraensyra (5( S )-HpETE) ; c) reduktion av denna 5( S )-HpETE genom allestädes närvarande cellulära peroxidaser för att bilda 5( S )-hydroxi-6E , 8Z ,11Z , 14Z -eikosatetraensyra (5( S ) -HETE); och ( d ) oxidationen av 5( S )-HETE av ett mikrosombundet nikotinamidadenindinukleotidfosfat (NADP + )-beroende dehydrogenasenzym, nämligen ( 5 -Hydroxyeicosanoid dehydrogenas eller 5-HEDH) för att bilda 5-oxo-ETE :
5-HEDH har liten eller ingen förmåga att metabolisera R- stereoisomeren av 5( S )-HETE, nämligen 5( R )-HETE, till 5-oxo-ETE. Dessutom verkar den på ett helt reversibelt sätt, och omvandlar lätt 5-oxo-ETE tillbaka till 5( S )-HETE. Eftersom celler vanligtvis upprätthåller mycket höga nivåer av NADPH jämfört med deras NADP + -nivåer, har de i allmänhet liten eller ingen förmåga att omvandla 5( S )-HEE till 5-oxo-ETE, och när de konfronteras med 5-oxo-ETE metaboliseras det snabbt till 5( S )-HETE. Men celler som genomgår åldrande, senescens, apoptos , oxidativ stress eller andra tillstånd som höjer deras nivåer av reaktiva syrearter (t.ex. superoxidanjon , syreradikaler och peroxider ) antingen fysiologiskt (t.ex. mänskliga fagocyter som uppslukar bakterier) eller patologiskt (t.ex. oxidativt utmanade) B-lymfocyter ) använder NADP + , har låga NADPH/NADP + -förhållanden och omvandlar därför lätt 5( S )-HETE till 5-oxo-ETE. Sålunda kan många patologiska tillstånd som involverar oxidativ stress, såsom förekommer i snabbt växande cancerformer, vara viktiga promotorer för 5-oxo-ETE-ackumulering in vivo.
5-Oxo-ETE kan också göras från antingen 5( S )-HpETE (och möjligen 5( R )-HpEPE) genom verkan av cytokrom P450 (CYP)-enzymer såsom CYP1A1 , CYP1A2 , CYP1B1 och CYP2S1 . från 5( S )-HETE (och troligen 5( R )-HETE) genom den icke-enzymatiska attacken med hem eller olika andra dehydratiseringsmedel; Det kan också bildas genom omvandling av 5-( S )-HpETE eller 5( R )-HpETE till 5-oxo-ETE på grund av verkan av en musmakrofag 50-60 kilodalton cytosoliskt protein. Bidraget från de tre sistnämnda vägarna till den fysiologiska produktionen av 5-oxo-ETE har inte utvärderats helt.
En isomer av 5-oxo-ETE, 5-oxo-(7E , 9E , 11Z , 14Z )-eikosatetraensyra, bildas icke-enzymatiskt som en biprodukt av hydrolyser av 5-lipooxgenasmetaboliten, Leukotriene A4 . Denna biprodukt skiljer sig från 5-oxo-ETE inte bara i positionen och geometrin för dess dubbla gränser utan också i dess aktivitet: den stimulerar mänskliga neutrofiler tydligen genom att verka på en eller flera LTB4-receptorer snarare än OXER1.
Vävnadskällor
Cellulär produktion
Humana neutrofiler , monocyter , eosinofiler , B-lymfocyter , dendritiska celler , blodplättar , luftvägsepitelceller och glatta muskelceller , vaskulära endotelceller och hudkeratinocyter har hittats och/eller föreslagits göra 5-oxo-ETE från endogent 5 eller exogent -HETE, särskilt under förhållanden med oxidativ stress; cellinjer härrörande från humana cancerformer såsom de från bröst, prostata, lungor, tjocktarm och olika typer av leukemi har likaså visat sig vara producenter av 5-oxo-ETE.
Transcellulär produktion
Celler av en typ kan frisätta 5( S )-HETE som de gör till närliggande celler av en andra typ som sedan oxiderar 5( S )-HETE till 5-oxo-ETE. Denna transcellulära produktion involverar vanligtvis den begränsade mängden celltyper som uttrycker aktivt 5-lipoxygenas, saknar HEDH-aktivitet på grund av deras höga nivåer av NADPH jämfört med NADP + -nivåer, och därför ackumulerar 5( S )-HETE, inte 5-oxo-ETE , vid stimulering. Denna 5( S )-ETE kan lämna dessa celler, gå in i olika celltyper som har 5-HEDH-aktivitet tillsammans med lägre NADPH- till NADP + -nivåer och därigenom omvandlas till 5-oxo-ETE. Transcellulär produktion av 5-oxo-eikosatetraenoater har visats in vitro med humana neutrofiler som de 5( S )-HETE-producerande cellerna och humana PC-3- prostatacancerceller, blodplättar och monocythärledda dendritiska celler som oxiderande celler. Det är teoretiskt att denna transcellulära metabolism sker in vivo och tillhandahåller en mekanism för att kontrollera 5-oxo-ETE-produktionen genom att tillåta den att inträffa eller förstärkas på platser där 5-lipoxygenas-innehållande celler samlas med celltyper som har 5-HEDH och gynnsam NADPH /NADP + förhållanden; Sådana platser, är det teorier, kan inkludera de som involverar allergi, inflammation, oxidativ stress och snabbt växande cancerformer.
Ämnesomsättning
Som indikeras i föregående avsnitt omvandlas 5-oxo-ETE lätt till 5( S )-HETE av 5-HEDH i celler som innehåller mycket låga NADPH/NADP + -förhållanden. Humana neutrofiler , en viktig modellcell för att undersöka 5-oxo-ETE-produktion, tar upp 5-oxo-ETE och reducerar den till 5( S )-HETE; de bildar också avsevärda mängder av 5( S ),20-dihydroxi-ETE och små mängder av 5-oxo,20-hydroxi-ETE troligen genom inverkan av ω-hydroxylas cytokrom P450 -enzymet, CYP453A på 5( S )-HETE och 5-oxo-ETE, respektive. Cellerna inkorporerar också 5( S )-HETE-produkten av 5-oxo-ETE men lite eller ingen 5-oxo-ETE själv som en ester i olika fosfolipid- och glycerolipidpooler ; Isolerade neutrofila plasmamembran , som saknar märkbar 5-HEDH-aktivitet, förestrar emellertid 5-oxo-ETE i dessa lipidpooler.
Flera andra vägar kan metabolisera 5-oxo-ETE. Först använder mänskliga eosinofiler Arachidonate 15-lipoxygenas -1 (eller möjligen Arachidonate 15-lipoxygenas-2 för att metabolisera 5-oxo-ETE till 5-oxo-15-( S )-hydroperoxi-ETE som snabbt reduceras till 5-oxo- 15( S )-hydroxi-ETE; 5-oxo-15( S )-hydroxyl-ETE är ungefär en tredjedel så potent som 5-oxo-ETE i stimulerande celler. För det andra använder mänskliga blodplättar 12-lipoxygenas för att metabolisera 5- oxo-ETE till 5-oxo-12( S )-hydroperxy-eicosatetraenoat som snabbt omvandlas till 5-oxo-12( S )-hydroxi-eikosatetraenoat (5-oxo-12) S )-hydroxi-ETE); 5-oxo-12( S )-hydroxyl-ETE är en svag antagonist till 5-oxo-ETE. För det tredje använder musmakrofager a) ett cytokrom P450- enzym för att metabolisera 5-oxo-ETE till 5-oxo-18-hydroxi-ETE (5-oxo-18-HETE) som antingen angrips av ett 5-keto-reduktas (ev. 5-HEDH) för att bilda 5,18-dihydroxi-eikosatetraensyra (5,18-diHETE) eller genom ett Δ6-reduktas för att bilda 5-oxo-18-hydroxi-eikosatriensyra (5-oxo-18-HETrE) som är reducerades sedan med ett 5-keto-reduktas (möjligen 5-HEDH) till 5,18-dihydroxi-eikosatetraensyra (5,18-diHETrE); b) ett cytokrom P450-enzym omvandlar 5-oxo-ETE till 5-oxo-19-hydroxi-eikosatetraensyra (5-oxo-19-HETE) som sedan antingen reduceras med ett keto-reduktas (eventuellt 5-HEDH) till 5, 19-dihydroxi-eikosatetraensyra (5,19-diHETE) eller genom ett A6-reduktas till 5-oxo-19-hydroxi-eikosatriensyra (5-oxo-19-HETrE); eller c) leukotrien C4-syntas för att metabolisera 5-oxo-ETE till 5-oxo-7-glutationyl-8,11,14-eikosatriensyra (FOG7). FOG7 simulerar celler med en annan mekanism än 5-oxo-ETE; den biologiska aktiviteten för andra mus-härledda metaboliter har inte rapporterats.
Handlingsmekanism
OXER1-receptorn
Studier på humana neutrofiler upptäckte först ett lokaliserat plasmamembranställe som reversibelt band 5-oxo-ETE och hade egenskaperna hos en Gi alfa-subenhetskopplad G -proteinkopplad receptor baserat på förmågan hos 5-oxo-ETE att aktivera denna klass av membran G-proteiner genom en pertussis toxin- känslig mekanism. Därefter klonades denna receptor av flera grupper som kallade den oxoeikosanoidreceptorn 1 (OXER1), OXE, OXE-R, hGPCR48, HGPCR48 eller R527 (dess gen kallas OXE1 eller OXER1 ), och fann den kopplad till och aktiverade G-proteinkomplex som består av Gi alfa-subenheten (Gαi) och G beta-gamma-komplex (Gβγ). När bunden av 5-oxo-ETE triggar OXER1 detta G-proteinkomplex att dissociera i dess Gai- och Gβγ-komponenter; dissocierad Gβγ är ansvarig för att aktivera många av signalvägarna som leder till de cellulära funktionella svaren framkallade av 5-oxo-ETE. Dessa signalvägar inkluderar de som framkallar ökningar av kalciumjonnivåer såväl som andra som aktiverar MAPK/ERK , p38 mitogenaktiverade proteinkinaser , cytosoliskt fosfolipas A2 , PI3K / Akt , proteinkinas C beta (PKCβ) och/eller (PKCε) . De flesta handlingar av 5-oxo-ETE verkar förmedlade av OXER1; några av dess cellstimulerande effekter verkar dock vara OXER1-oberoende, vilket indikeras i följande avsnitt. Andra föreningar kan också stimulera celler genom OXER1. Många av dessa föreningar skiljer sig något från 5-oxo-ETE i struktur genom att ersätta en atom med en atom av ett annat grundämne, genom förlust av en eller flera atomer och/eller genom närvaron av en funktionell grupp som inte finns i 5-oxo-ETE. Dessa föreningar kallas 5-oxo-ETE-analoger eller medlemmar av 5-oxo-ETE-familjen av agonister. 5-HETE och 5-hydroxi-15(S)-hydroxieikosatetraensyra är exempel på sådana analoger. 5-Oxo-ETE och många av dess analoger produceras av mänskliga celler, andra däggdjursceller såsom de från katter och opossums och celler från flera fiskarter. Baserat på närvaron av dess mRNA antas OXER1-receptorn vara starkt uttryckt i humana blodeosinofiler , neutrofiler, mjälte, lunga, lever och njure och vid lägre nivåer i humana basofiler, monocyter, lungmakrofager och olika humana cancercellinjer och en cellinje härledd från den mänskliga binjurebarken ; cellerna hos möss och råttor verkar dock sakna en tydlig OXER1.
Andra GPCR-receptorer
Mus-MA-10-celler svarar på 5-oxo-ETE men saknar OXER1. Det har föreslagits att dessa cellers svar på 5-oxo-ETE medieras av en ortolog till OXER1, musniacinreceptor 1 , Niacr1, som är en G-proteinkopplad receptor för niacin , eller alternativt av en eller flera av mushydroxikarboxylsyra (HCA)-familjen av de G-proteinkopplade receptorerna, HCA1 ( GPR81 ), HCA2 ( GPR109A ) och HCA3 ( GPR109B ), som är G-proteinkopplade receptorer för fettsyror.
PPARy
5-Oxo-ETE och 5-oxo-15( S )-hydroxi-ETE men inte 5-hydroximedlemmar av 5-HETE-familjen såsom 5-( S )-HETE aktiverar peroxisomproliferatoraktiverad receptorgamma (PPARy). Denna aktivering fortsätter inte genom OXER1; snarare involverar det direkt bindning av oxo-analogen till PPARy med 5-oxo-15-( S )-hydroxi-ETE som är mer potent än 5-oxo-ETE när det gäller att binda och aktivera PPARy. Aktiveringen av OXER1-receptorn och PPARy av oxo-analogerna kan ha motsatta effekter på cellfunktionen. Till exempel stimulerar 5-oxo-ETE-bunden OXER1 medan 5-oxo-ETE-bunden PPARy hämmar proliferationen av olika typer av humana cancercellinjer; detta resulterar i att 5-oxo-ETE och 5-oxo-15-( S )-HETE har betydligt mindre styrka än förväntat när det gäller att stimulera dessa cancerceller att proliferera i förhållande till styrkan hos 5-( S )-HETE, ett förhållande som inte är nära nog efter styrkan hos dessa tre föreningar för att aktivera OXER1.
Andra mekanismer
5-Oxo-ETE avslappnar förkontrakterade humana bronkier genom en mekanism som inte verkar involvera OXER1 men som annars är odefinierad.
Målceller
Inflammatoriska celler
5-Oxo-ETE är en potent in vitro-stimulator och/eller förstärkare av kemotaxi (dvs. riktad migration) och, beroende på celltyp, olika andra reaktioner såsom degranulering (dvs frisättning av granulbundna enzymer), oxidativ metabolism (dvs. generering av reaktiva syrearter ), och produktion av mediatorer såsom olika arakidonsyrametaboliter och blodplättsaktiverande faktor i humana eosinofiler, basofiler , neutrofiler och monocyter . Vidare orsakar injektionen av 5-oxo-ETE i huden på människor lokal ackumulering av cirkulerande blodkroppar, särskilt eosinofiler men också i mindre utsträckning neutrofiler och monocyt - härledda makrofager . Aktiviteten av 5-oxo-ETE på de två celltyper som är kända för att vara involverade i allergibaserad inflammation, eosinofiler och basofiler, tyder på att det kan vara involverat i att främja allergiska reaktioner, möjligen genom att genom kemotaxi attrahera dessa celler till begynnande platser för allergi och /eller genom att stimulera dessa celler att frigöra granulbundna enzymer, reaktiva syrearter eller andra promotorer för allergiska reaktioner. 5-Oxo-ETEs aktivitet på mänskliga celler involverade i icke-allergiska inflammatoriska sjukdomar, nämligen neutrofiler och monocyter, såväl som dess förmåga att attrahera dessa celltyper till huden på människor tyder på att 5-oxo-ETE också kan vara involverad i den breda kategorin av icke-allergiska inflammatoriska sjukdomar inklusive de som involverar värdförsvar mot patogener.
Lungluftvägs glatta muskelceller
5-Oxo-ETE drar ihop glatt muskulatur och organodlade bronker isolerade från marsvin men slappnar av bronker isolerade från mänsklig lunga; avslappningen av mänskliga bronkier orsakad av 5-oxo-ETE kanske inte involverar dess OXER1. Dessa resultat tyder på att 5-oxo-ETE inte är direkt involverad i bronkokonstriktionen) som förekommer vid eosinofilbaserade allergiska astmareaktioner hos människor.
Cancerceller
5-Oxo-ETE (eller annan 5-HETE-familjemedlem) stimulerar tillväxten och/eller överlevnaden av mänskliga cellinjer som härrör från cancer i prostata, bröst, lungor, äggstockar, tjocktarm och bukspottkörtel. Dessa prekliniska studier tyder på att 5-oxo- ETE (eller annan 5-HETE familjemedlem) kan bidra till den citerade cancerutvecklingen hos människor.
Steroidogena celler
5-oxo-ETE stimulerar humana H295R binjurebarkceller att öka transkriptionen av steroidogent akut regulatoriskt proteinbudbärar-RNA och producera aldosteron och progesteron genom en uppenbar OXER1-beroende väg.
Andra celltyper
5-Oxo-ETE inducerar en isotonisk volymreduktion i tarmkrypt epitelceller från marsvin.
Interaktion med andra stimuli
5-Oxo-ETE och en annan potentiell mediator av mänskliga allergiska reaktioner, trombocytaktiverande faktor , verkar i synergi för att stimulera mänskliga eosinofiler och neutrofiler: de kombinerade medlen framkallar svar som är större än den enkla summan av deras individuella handlingar och gör det vid relativt sett låg. 5-Oxo-ETE ökar också kraftigt styrkan hos komplementkomponent 5a , LTB4 och FMLP för att stimulera mänskliga eosinofiler att degranulera och dess degranulerande aktivitet ökar kraftigt genom att förbehandla mänskliga eosinofiler med granulocyt-makrofagkolonistimulerande faktor eller de senare humana neutrofilerna. cytokin eller med granulocytkolonistimulerande faktor , tumörnekrosfaktor α , eller olika nukleotider inklusive ATP . Förbehandling av eosinofiler med interleukin 5 (en nyckelmediator i eosinofilaktivering) ökar också deras in vitro kemotaktiska svar på 5-oxo-ETE. 5-Oxo-ETE verkar också i synergi med två kemokiner , CCL2 och CCL8 , för att stimulera monocytkemotaxi. Interaktionerna mellan 5-oxo-ETE och dessa förmedlare av allergi (t.ex. trombocytaktiverande faktor, interleukin 5) i eosinofiler tyder vidare på att det spelar en roll vid allergiska sjukdomar medan dess interaktioner med mediatorer av inflammatoriska reaktioner (t.ex. tumörnekrosfaktor α, de kolonistimulerande faktorerna och de två CCL-kemokinerna) i neutrofiler och monocyter tyder vidare på att det spelar en roll i inflammatoriska svar och värdförsvarsmekanismer.
Klinisk signifikans
I stort sett alla studier på 5-oxo-ETEs aktiviteter och målceller, liknande de på andra medlemmar av 5( S )-HETE-familjen av agonister, klassificeras bäst som prekliniska utvecklingsstudier : de har ännu inte fastställts vara viktig i mänsklig patofysiologi. Översättningsstudier behövs för att ta reda på om de prekliniska studierna som involverar 5-Oxo-ETE och andra 5( S )-HETE-familjemedlemmar i allergiska sjukdomar, inflammatoriska sjukdomar, cancer, steroidproduktion, benremodellering, förlossning och andra patofysiologiska händelser, enligt beskrivningen här och på 5-HETE- sidan, är relevanta för människor och därför av klinisk betydelse.
Potentiell inblandning i allergi
Den kliniska betydelsen av 5-oxo-ETE har mest studerats som en möjlig mediator av eosinofilbaserade allergiska reaktioner. När det administreras som en intradermal injektion orsakar det infiltration av eosinofiler på injektionsstället hos apor. Hos människor inducerar det infiltration av eosinofiler som åtföljs av betydande nivåer av neutrofil- och makrofaginfiltrationer. Dessa 5-oxo-ETE-injektioner orsakade ett signifikant större eosinofilinfiltrat hos astmatiker jämfört med friska människor. Studier på rhesusapor som var sensibiliserade för ett allergen visade att den intradermala injektionen av det ursprungliga allergenet orsakade en lokal ansamling av eosinofiler; denna infiltration blockerades med ~50 % hos djur som förbehandlats med en oralt intagen OXER1-receptorantagonist. Samma receptorantagonist blockerade likaså infiltrationen av eosinofiler i lungan hos rhesusapor som sensibiliserades för och sedan utmanades med det ursprungliga allergenet. Ökade nivåer av 5-oxo-ETE har upptäckts i kondensatet i utandningsluften hos människor som utvecklade ett astmaliknande bronkokonstriktionssvar på inandning av husdammskvalsterallergen : nivåerna av dessa ökningar var högre hos individer som utvecklade en mer allvarlig sen astmatisk respons . På liknande sätt har ökade nivåer av 5-oxo-ETE upptäckts i den bronkoalveolära sköljvätskan efter inandning av husdammskvalsterallergen till husdammskvalstersensibiliserade möss. Slutligen producerar epitelcellerna som erhålls från näspolyper hos människor 5-oxo-ETE och, när de appliceras på kulturer av näspolypvävnad, stimulerar 5-oxo-ETE produktionen av eosinofilt katjoniskt protein , ett protein associerat med eosinofilbaserad inflammation och astma. Dessa resultat indikerar att: 1) 5-oxo-ETE orsakar hudeosinofilbaserade allergiliknande reaktioner; 2) dess handlingar, åtminstone hos apor, involverar stimulering av OXER1; 3) 5-oxo-ETE (eller en liknande verkande 5-oxo-ETE-analog) kan bidra till allergiska reaktioner på mänsklig hud (t.ex. atopisk dermatit ), lunga (t.ex. astma) och nasala (t.ex. allergisk rinit ); och 4) OXER1-antagonister kan vara användbara vid behandling av dessa hud-, lung- och, möjligen, nasala reaktioner hos människor.
