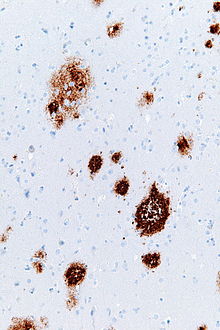
Amyloidplack
Amyloida plack (även känd som neuritiska plack , amyloid beta plack eller senila plack ) är extracellulära avlagringar av amyloid beta (Aβ) protein huvudsakligen i den grå substansen i hjärnan. Degenerativa neuronala element och ett överflöd av mikroglia och astrocyter kan associeras med amyloidplack. Vissa plack uppstår i hjärnan som ett resultat av åldrande , men ett stort antal plack och neurofibrillära trassel är karakteristiska egenskaper för Alzheimers sjukdom . Onormala neuriter i amyloidplack är slingrande, ofta svullna axoner och dendriter . Neuriterna innehåller en mängd olika organeller och cellrester, och många av dem inkluderar karakteristiska parade spiralformade filament , den ultrastrukturella komponenten i neurofibrillära trassel. Placken är mycket varierande i form och storlek; i vävnadssnitt immunfärgade för Ap omfattar de en log-normal storleksfördelningskurva med en genomsnittlig plackarea på 400-450 kvadratmikrometer ( µm² ). De minsta placken (mindre än 200 µm²), som ofta består av diffusa avlagringar av Aβ, är särskilt många. Plackens skenbara storlek påverkas av vilken typ av fläck som används för att detektera dem och av det plan genom vilket de sektioneras för analys under mikroskop. Plack bildas när Aβ felveckas och aggregeras till oligomerer och längre polymerer , varav de senare är karakteristiska för amyloid . Felveckad och aggregerad Ap tros vara neurotoxisk , speciellt i dess oligomera tillstånd.
Historia
1892 beskrev Paul Blocq och Gheorghe Marinescu första gången förekomsten av plack i grå substans. De kallade placken "knölar av neuroglial skleros". År 1898 rapporterade Emil Redlich plack hos tre patienter, varav två hade kliniskt verifierad demens . Redlich använde termen "miliär skleros" för att beskriva plack eftersom han tyckte att de liknade hirsfrön, och han var den första som hänvisade till lesionerna som "plack". I början av 1900-talet Oskar Fischer deras likhet med actinomyces 'Drusen' (geodliknande lesioner), vilket ledde till att han kallade den degenerativa processen 'drusige Nekrose'. Alois Alzheimer krediteras ofta för att först koppla plack till demens i en presentation från 1906 (publicerad 1907), men denna korta rapport fokuserade främst på neurofibrillära trassel, och plack nämndes bara kort. Alzheimers första materiella beskrivning av plack dök upp 1911. Däremot publicerade Oskar Fischer en serie omfattande undersökningar av plack och demens 1907, 1910 och 1912. 1911 föreslog Max Bielschowsky plackavlagringarnas amyloida natur. Detta bekräftades senare av Paul Divry, som visade att plack som är färgade med färgämnet Kongorött visar den optiska egenskapen dubbelbrytning , som är karakteristisk för amyloider i allmänhet. 1911 Teofil Simchowicz termen "senila plack" för att beteckna deras frekventa förekomst i hjärnan hos äldre individer. 1968 bekräftade en kvantitativ analys av Gary Blessed, Bernard Tomlinson och Martin Roth sambandet mellan senila plack och demens . Henryk Wisniewski och Robert Terry myntade termen "neuritiska plack" 1973 för att beteckna plack som inkluderar onormala neuronala processer (neuriter). Ett viktigt framsteg under 1984 och 1985 var identifieringen av Aβ som det protein som bildar plackens kärnor. Denna upptäckt ledde till genereringen av nya verktyg för att studera plack, särskilt antikroppar mot Aβ, och presenterade ett molekylärt mål för utvecklingen av potentiella terapier för Alzheimers sjukdom. Kunskapen om aminosyrasekvensen för Aβ gjorde det också möjligt för forskare att upptäcka genetiska mutationer som orsakar autosomal dominant Alzheimers sjukdom, som alla ökar sannolikheten för att Aβ kommer att aggregeras i hjärnan.
Generering av amyloid beta
Amyloid beta (Aβ) är ett litet protein, oftast 40 eller 42 aminosyror långt, som frisätts från ett längre moderprotein som kallas Aβ-prekursorproteinet ( APP ). APP produceras av många typer av celler i kroppen, men det är särskilt rikligt i neuroner . Det är ett enkelpassage transmembranprotein som passerar en gång genom cellulära membran . Aβ-segmentet av APP är delvis inom membranet och delvis utanför membranet. För att frigöra Aβ spjälkas APP sekventiellt av två enzymer : för det första av betasekretas (eller β-amyloidklyvningsenzym (BACE)) utanför membranet, och för det andra av gammasekretas (γ-sekretas), ett enzymkomplex i membranet . De sekventiella verkan av dessa sekretaser resulterar i Aβ-proteinfragment som frisätts i det extracellulära utrymmet. Utsöndringen av Aβ ökar av synapsernas aktivitet . Förutom Ap-peptider som är 40 eller 42 aminosyror långa genereras även flera mindre rikliga Ap-fragment. Aβ kan modifieras kemiskt på olika sätt, och proteinets längd och kemiska modifieringar kan påverka både dess tendens att aggregera och dess toxicitet.
Identifiering

Amyloidplack är synliga med ljusmikroskopet med användning av en mängd olika färgningstekniker, inklusive silverfläckar , kongorött , tioflavin , kresylviolett , PAS-reaktion och självlysande konjugerade oligotiofener (LCO). Dessa metoder färgar ofta olika komponenter av placken, och de varierar i sin känslighet. Plack kan också visualiseras immunhistokemiskt med antikroppar riktade mot Aβ eller andra komponenter i lesionerna. Immunhistokemiska fläckar är särskilt användbara eftersom de är både känsliga och specifika för antigener som är associerade med plack.
Sammansättning
Ap-avlagringarna som innefattar amyloidplack varierar i storlek och utseende. Under ljusmikroskopet sträcker de sig från små, trasiga ansamlingar som är några mikrometer i diameter till mycket större täta eller diffusa massor. Så kallade 'klassiska plack' består av en kompakt Aβ-amyloidkärna som är omgiven av en korona av något mindre tätt packad Aβ. Klassiska plack inkluderar också onormala, svullna neuronala processer ( neuriter ) som härrör från många olika typer av neuroner, tillsammans med aktiverade astrocyter och mikroglia . Onormala neuriter och aktiverade gliaceller är inte typiska för de flesta diffusa plack, och det har föreslagits att diffusa avlagringar är ett tidigt stadium i utvecklingen av plack.
Anatomisk fördelning
Dietmar Thal och hans kollegor har föreslagit en sekvens av stadier av plackbildning i hjärnan hos Alzheimerpatienter. I fas 1 uppträder plack i neocortex ; i fas 2 uppträder de i allocortex , hippocampusbildning och amygdala ; i fas 3 påverkas basalganglierna och diencephalon ; i fas 4 uppträder plack i mellanhjärnan och medulla oblongata ; och i fas 5 uppträder de i pons och lillhjärnan . Sålunda, i slutstadiet av Alzheimers sjukdom, kan plack hittas i de flesta delar av hjärnan. De är ovanliga i ryggmärgen .
Bildning och spridning
Den normala funktionen av Aβ är inte säker, men plack uppstår när proteinet felveckas och börjar ackumuleras i hjärnan genom en process av molekylär mallbildning ('sådd'). Mathias Jucker och Lary Walker har liknat denna process vid bildandet och spridningen av prioner vid sjukdomar som kallas spongiforma encefalopatier eller prionsjukdomar . Enligt prionparadigmet viks vissa proteiner fel till former som är rika på sekundär struktur av beta-ark . I detta tillstånd får de andra proteiner av samma typ att anta samma onormala beta-arkrika struktur. De felveckade proteinerna fastnar vid varandra och staplas så småningom ihop för att bilda oligomerer som smälter samman för att göra amyloidfibrillerna som är typiska för mogna plack.
Delaktighet i sjukdom
Rikliga Aβ-plack, tillsammans med neurofibrillära trassel som består av aggregerat tau-protein , är de två lesioner som krävs för den neuropatologiska diagnosen av Alzheimers sjukdom. Även om antalet neurofibrillära tovor korrelerar starkare med graden av demens än antalet plack, indikerar genetiska och patologiska fynd att Ap spelar en central roll i risken, uppkomsten och utvecklingen av Alzheimers sjukdom. Av särskild betydelse är de längre (42 aminosyror) arterna av Aβ som kallas Aβ42. Förhöjda nivåer av Aβ, såväl som en ökning av förhållandet mellan Aβ42 och 40-aminosyraformen (Aβ40), är viktiga tidiga händelser i patogenesen av Alzheimers sjukdom.
Tills nyligen krävde diagnosen Alzheimers sjukdom en mikroskopisk analys av plack och trassel i hjärnvävnad, vanligtvis vid obduktion. Emellertid kan Aβ-plack (tillsammans med cerebral Aβ-amyloidangiopati ) nu detekteras i hjärnan hos levande försökspersoner. Detta görs genom att bereda radioaktivt märkta medel som binder selektivt till Aβ-avlagringar i hjärnan efter att ha infunderats i blodomloppet. Liganderna korsar blod-hjärnbarriären och fäster vid aggregerad Aβ, och deras retention i hjärnan bedöms med positronemissionstomografi ( PET). Dessutom kan förekomsten av plack och trassel uppskattas genom att mäta mängderna av Aβ- och tau-proteinerna i cerebrospinalvätskan .
Förekomst
Sannolikheten att ha plack i hjärnan ökar med stigande ålder. Från 60 års ålder (10 %) till 80 års ålder (60 %) ökar andelen personer med senila plack linjärt. Kvinnor är något mer benägna att ha plack än män. Både plack och Alzheimers sjukdom är också vanligare hos åldrande personer med trisomi -21 ( Downs syndrom ) . Detta tros bero på överskottsproduktion av Aβ eftersom APP -genen finns på kromosom 21, som existerar som tre kopior vid Downs syndrom.
Amyloidplack förekommer naturligt i de åldrande hjärnorna hos icke-mänskliga arter, allt från fåglar till människoapor. Hos icke-mänskliga primater, som är de närmaste biologiska släktingarna till människor, har plack hittats hos alla undersökta arter hittills. Neurofibrillära tovor är dock sällsynta, och ingen icke-mänsklig art har visats ha demens tillsammans med den fullständiga neuropatologin av Alzheimers sjukdom.
Forskning
Forskning med mänskliga prover och experimentella modeller av Alzheimers sjukdom har riktats mot att förstå de biokemiska , cytologiska och inflammatoriska egenskaperna hos plack, bestämma hur plack uppstår och förökar sig i hjärnan, identifiera genetiska och miljömässiga riskfaktorer, upptäcka metoder för att upptäcka dem i hjärnan. levande hjärna och utveckla terapeutiska strategier för att förebygga eller ta bort dem. Amyloidplackbildning kan vara kopplad till blödning från hjärnans mikrokärl .
Forskning om bildning och spridning av amyloidplack har påskyndats genom utvecklingen av genetiskt modifierade musmodeller. Många kandidatbehandlingar som minskar Aβ-nivåer och antalet plack i hjärnan har identifierats med hjälp av transgena gnagarmodeller. Dessa strategier inkluderar immunterapeutiska tillvägagångssätt och hämmare av sekretaserna som frisätter Ap från APP.
Tidigare hämning av Aβ-aggregation och plackbildning kan behövas för att bromsa eller förhindra tauopati och Alzheimers sjukdom. Annan forskning är inriktad på att förstå inflammationen i samband med plack och identifiera miljömässiga, fysiologiska eller genetiska riskfaktorer för plackbildning vid Alzheimers sjukdom.
Se även
Vidare läsning
- Jellinger KA (2005). "Neurodegenerative Erkrankungen (ZNS) - Eine aktuelle Übersicht" (PDF) . Journal für Neurologie, Neurochirurgie und Psychiatrie . 6 (1): 9–18.
- Cruz L, Urbanc B, Buldyrev SV, et al. (juli 1997). "Aggregation och disaggregering av senila plack vid Alzheimers sjukdom" . Proceedings of the National Academy of Sciences of the United States of America . 94 (14): 7612–6. Bibcode : 1997PNAS...94.7612C . doi : 10.1073/pnas.94.14.7612 . PMC 23870 . PMID 9207140 .