Koboltoxid nanopartikel
 |
| Del av en serie artiklar om |
| nanomaterial |
|---|
| Kolnanorör |
| Fullerener |
| Andra nanopartiklar |
| Nanostrukturerade material |
Inom forskning om material och elektriska batterier avser nanopartiklar av koboltoxid vanligtvis partiklar av kobolt(II,III)oxid Co
3 O
4 av nanometerstorlek, med olika former och kristallstrukturer.
Koboltoxidnanopartiklar har potentiella tillämpningar i litiumjonbatterier och elektroniska gassensorer .
Ansökningar
Litium jon batteri
Katoderna hos litiumjonbatterier är ofta gjorda av litiumoxider av kobolt , nickel eller mangan, som lätt och reversibelt kan införliva litiumjoner i sin molekylära struktur. Nanomaterial av koboltoxid, såsom nanorör , erbjuder högt förhållande mellan yta och volym och korta väglängder för transport av litiumkatjoner , vilket leder till snabbladdningsmöjligheter. Emellertid kan kapacitet, coulombisk effektivitet och cykellivslängd bli lidande på grund av överdriven bildning av SEI. Nanotrådarna kan innehålla andra ämnen, till exempel difenylalanin .
Koboltoxidpartiklar kan förankras på substrat som grafen för att förbättra anodens dimensionella stabilitet och för att förhindra partikelaggregation under litiumladdnings- och urladdningsprocesser.
Gassensor
Ihåliga nanosfärer av koboltoxid har undersökts som material för gassensorelektroder , för detektering av toluen, aceton och andra organiska ångor.
Koboltoxidnanopartiklar förankrade på enkelväggiga kolnanorör har undersökts för att känna av kväveoxider NO
x och väte . Denna applikation drar fördel av reaktiviteten mellan gasen och oxiden, såväl som den elektriska förbindelsen med substratet (båda är halvledare av p-typ) . Kväveoxider reagerar med oxiden som elektronacceptorer , vilket minskar elektrodens motstånd; medan väte fungerar som en elektrondonator , vilket ökar motståndet.
Medicin
Koboltoxidnanopartiklar har observerats att lätt komma in i celler , en egenskap som kan tänkas leda till tillämpningar inom hypertermisk behandling, genterapi och läkemedelsleverans. Deras toxicitet är dock ett hinder som måste övervinnas.
Syntes
Hydrotermisk
Koboltoxid erhålls ofta genom hydrotermisk syntes i en autoklav.
Enpots hydrotermisk syntes av ihåliga sfärer av metalloxid börjar med kolhydrater och metallsalter lösta i vatten vid 100-200 °C. Reaktionen producerar kolsfärer, med metalljoner integrerade i det hydrofoba skalet. Kolkärnorna avlägsnas genom kalcinering och lämnar ihåliga metalloxidsfärer. Ytarea och tjocklek på skalet kan manipuleras genom att variera koncentrationen av kolhydrat till metallsalt, såväl som temperatur, tryck och pH hos reaktionsmediet, och katjonerna i utgångssalterna. Sluttiden för proceduren varierar från timmar till dagar.
En nackdel med detta tillvägagångssätt är dess mindre utbyte jämfört med andra metoder.
Termisk nedbrytning
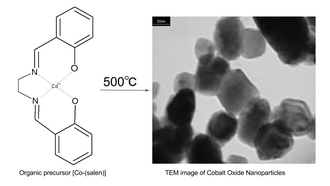
En annan väg till syntesen av nanopartiklar av koboltoxid är termisk nedbrytning av metallorganiska föreningar. Till exempel upphettning av metallsalenkomplexet bis(salicylaldehyd)etylendiiminkobolt(II) ("Co-salen") i luft till 500 °C. Prekursorn Co-salen kan erhållas genom att reagera kobolt(II)acetattetrahydrat i propanol vid 50°C under kväveatmosfär med salenliganden (bis(salicylaldehyd)etylendiimin).
Från förankrade prekursorer
Koboltoxid/grafenkomposit syntetiseras genom att först bilda kobolt(II)hydroxid Co(OH)
2 på grafenarket från ett kobolt(II)salt och ammoniumhydroxid NH
4 OH , som sedan värms upp till 450 °C i två timmar för att ge oxiden.
Säkerhet
Liksom de flesta koboltföreningar är nanopartiklar av koboltoxid giftiga för människor och även för vattenlevande organismer.