Fast lipid nanopartikel

 |
| Del av en serie artiklar om |
| nanomaterial |
|---|
| Kolnanorör |
| Fullerener |
| Andra nanopartiklar |
| Nanostrukturerade material |
Lipidnanopartiklar (LNP) är nanopartiklar som består av lipider . De är ett nytt farmaceutiskt läkemedelsleveranssystem (och en del av nanopartikelläkemedelsleverans ) och en ny farmaceutisk formulering . LNP som läkemedelsleveransfordon godkändes först 2018 för siRNA -läkemedlet Onpattro . LNP:er blev mer allmänt kända i slutet av 2020, eftersom vissa COVID-19-vacciner som använder RNA-vaccinteknologi belägger de ömtåliga mRNA- strängarna med PEGylerade lipidnanopartiklar som deras leveransmedium (inklusive både Moderna och Pfizer–BioNTech COVID-19-vaccinerna) .
Egenskaper
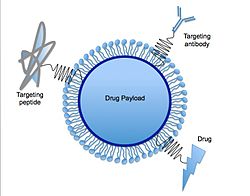
En lipidnanopartikel är vanligtvis sfärisk med en medeldiameter på mellan 10 och 1000 nanometer . Fasta lipidnanopartiklar har en fast lipidkärnmatris som kan solubilisera lipofila molekyler . Lipidkärnan stabiliseras av ytaktiva ämnen (emulgeringsmedel). Det emulgermedel som används beror på administreringsvägar och är mer begränsat för parenterala administreringar. Termen lipid används här i en vidare mening och inkluderar triglycerider (t.ex. tristearin ), diglycerider (t.ex. glycerolbahenat), monoglycerider (t.ex. glycerolmonostearat ), fettsyror (t.ex. stearinsyra ), steroider (t.ex. kolesterol ) och vaxer (t.ex. cetylpalmitat ). Alla klasser av emulgeringsmedel (med avseende på laddning och molekylvikt) har använts för att stabilisera lipiddispersionen. Det har visat sig att kombinationen av emulgeringsmedel kan förhindra partikelagglomerering mer effektivt.
En SLN är i allmänhet sfärisk till formen och består av en fast lipidkärna stabiliserad av ett ytaktivt ämne. Kärnlipiderna kan vara fettsyror, acylglyceroler, växer och blandningar av dessa ytaktiva ämnen. Biologiska membranlipider såsom fosfolipider , sfingomyeliner , gallsalter ( natriumtaurocholat ) och steroler (kolesterol) används som stabilisatorer. Biologiska lipider med minimal bärarcytotoxicitet och lipidens fasta tillstånd tillåter bättre kontrollerad läkemedelsfrisättning på grund av ökad massöverföringsresistens. Shah et al. i sin bok Lipid Nanoparticles: Production, Characterization and Stability diskutera dessa i detalj. [ citat behövs ]
LNP: er som används i mRNA-vacciner för SARS-CoV-2 (viruset som orsakar COVID-19 ) är gjorda av fyra typer av lipider: en joniserbar katjonisk lipid (vars positiva laddning binder till negativt laddat mRNA), en PEGylerad lipid (för stabilitet) , en fosfolipid (för struktur) och kolesterol (för struktur). På grund av immunsystemets snabba clearance av den positivt laddade lipiden utvecklades neutrala joniserbara aminolipider. En ny squaramidlipid (det vill säga delvis aromatiska fyrledade ringar, som kan delta i pi-pi-interaktioner) har varit en favoriserad del av det tillförselsystem som till exempel används av Moderna.
Syntes
Olika formuleringsprocedurer inkluderar homogenisering med hög skjuvning och ultraljud, lösningsmedelsemulgering/avdunstning eller mikroemulsion. Att erhålla storleksfördelningar i intervallet 30-180 nm är möjligt med hjälp av ultraljud till bekostnad av lång ultraljudstid. Lösningsmedel-emulgering är lämplig för framställning av små, homogent stora lipid-nanopartiklar dispersioner med fördelen att undvika värme.
Ansökningar
Utveckling av fasta lipidnanopartiklar är ett av de framväxande områdena inom lipidnanoteknologi (för en recension om lipidnanoteknologi, se ) med flera potentiella tillämpningar inom läkemedelsleverans, klinisk medicin och forskning , såväl som inom andra discipliner. På grund av deras unika storleksberoende egenskaper erbjuder lipidnanopartiklar möjligheten att utveckla nya terapier. Möjligheten att införliva läkemedel i nanobärare erbjuder en ny prototyp inom läkemedelsleverans som kan vara mycket lovande för att uppnå förbättringen av biotillgängligheten tillsammans med kontrollerad och platsspecifik läkemedelsleverans. SLN anses också vara väl tolererade i allmänhet, på grund av deras sammansättning från fysiologiskt likartade lipider. [ citat behövs ]
De konventionella tillvägagångssätten såsom användning av genomträngningsförstärkare, ytmodifiering, prodrugsyntes, komplexbildning och kolloidala lipidbärarbaserade strategier har utvecklats för leverans av läkemedel till tarmlymfat. Dessutom har polymera nanopartiklar, självemulgerande leveranssystem, liposomer , mikroemulsioner , micellära lösningar och nyligen fasta lipidnanopartiklar (SLN) utnyttjats som troliga möjligheter som bärare för oral intestinal lymfatisk leverans.
Drogleverans
Fasta lipidnanopartiklar kan fungera som grunden för orala och parenterala läkemedelsleveranssystem . SLN: er kombinerar fördelarna med lipidemulsion och polymera nanopartikelsystem samtidigt som de övervinner de tidsmässiga och in vivo stabilitetsproblemen som besvärar de konventionella såväl som polymera nanopartiklar tillvägagångssätten för läkemedelsleverans. Det har föreslagits att SLN:er kombinerar många fördelar jämfört med andra kolloidala bärare, dvs inkorporering av lipofila och hydrofila läkemedel är genomförbart, ingen biotoxicitet hos bäraren, undvikande av organiska lösningsmedel, möjlighet till kontrollerad läkemedelsfrisättning och läkemedelsinriktning, ökad läkemedelsstabilitet och inga problem med hänsyn till storskalig produktion. En nyligen genomförd studie har visat användningen av fasta lipidnanopartiklar som en plattform för oral tillförsel av näringsämnet järn , genom att införliva den hydrofila molekylen järnsulfat (FeSO 4 ) i en lipidmatris som består av stearinsyra . Karvedilol -laddade fasta lipidnanopartiklar framställdes med användning av varmhomogeniseringsteknik för oral leverans med användning av compritol och poloxamer 188 som lipid respektive ytaktivt ämne. Ett annat exempel på läkemedelstillförsel med användning av SLN skulle vara oral fast SLN suspenderad i destillerat vatten, som syntetiserades för att fånga in läkemedel i SLN-strukturen. Vid matsmältningsbesvär utsätts SLN för mag- och tarmsyror som löser upp SLN och släpper ut läkemedlen i systemet.
Många nanostrukturerade system har använts för okulär läkemedelstillförsel och gett några lovande resultat. SLN har betraktats som ett potentiellt läkemedelsbärarsystem sedan 1990-talet. SLN visar inte biotoxicitet eftersom de är framställda från fysiologiska lipider. SLN: er är särskilt användbara vid okulär läkemedelstillförsel eftersom de kan förbättra hornhinneabsorptionen av läkemedel och förbättra den okulära biotillgängligheten av både hydrofila och lipofila läkemedel. Fasta lipidnanopartiklar har en annan fördel att tillåta autoklavsterilisering , ett nödvändigt steg mot formulering av okulära preparat.
Fördelarna med SLN inkluderar användningen av fysiologiska lipider (vilket minskar risken för akut och kronisk toxicitet), undvikande av organiska lösningsmedel, ett potentiellt brett användningsspektrum ( dermalt , per os , intravenöst ) och högtryckshomogenisering som en etablerad produktionsmetod . Dessutom hävdades förbättrad biotillgänglighet , skydd av känsliga läkemedelsmolekyler från den yttre miljön vatten, ljus) och till och med kontrollerade frisättningsegenskaper genom inkorporering av dåligt vattenlösliga läkemedel i den fasta lipidmatrisen. Dessutom kan SLN bära både lipofila och hydrofila läkemedel och är mer överkomliga jämfört med polymera/tensidbaserade bärare.
Nukleinsyror
Ett betydande hinder för att använda LNPs som en leveransvehikel för nukleinsyror är att i naturen bär lipider och nukleinsyror båda en negativ elektrisk laddning - vilket betyder att de inte lätt blandas med varandra. Medan han arbetade på Syntex i mitten av 1980-talet, var Philip Felgner banbrytande för användningen av artificiellt skapade katjoniska lipider (positivt laddade lipider) för att binda lipider till nukleinsyror för att transfektera de senare till celler. Men i slutet av 1990-talet var det känt från in vitro -experiment att denna användning av katjoniska lipider hade oönskade biverkningar på cellmembranen .
Under slutet av 1990- och 2000-talet utvecklade Pieter Cullis vid University of British Columbia joniserbara katjoniska lipider som är "positivt laddade vid ett surt pH men neutrala i blodet." Cullis ledde också utvecklingen av en teknik som involverar noggranna justeringar av pH under processen att blanda ingredienser för att skapa LNPs som säkert kan passera genom cellmembranen hos levande organismer. Från och med 2021 är den nuvarande förståelsen för LNP formulerade med sådana joniserbara katjoniska lipider att de kommer in i celler genom receptormedierad endocytos och hamnar inuti endosomer . Surheten inuti endosomerna gör att LNP:s joniserbara katjoniska lipider får en positiv laddning, och detta tros tillåta LNP:er att fly från endosomerna och frigöra deras RNA-nyttolaster.
Från 2005 till början av 2010-talet undersöktes LNP som ett läkemedelsleveranssystem för små störande RNA ( siRNA) läkemedel. 2009 var Cullis med och grundade ett företag som heter Acuitas Therapeutics för att kommersialisera sin LNP-forskning; Acuitas arbetade med att utveckla LNP för Alnylam Pharmaceuticals siRNA-läkemedel. 2018 godkände FDA Alnylams siRNA-läkemedel Onpattro ( patisiran ), det första läkemedlet som använde LNP som läkemedelsleveranssystem.
Vid den tidpunkten tittade siRNA-läkemedelsutvecklare som Alnylam redan på andra alternativ för framtida läkemedel som kemiska konjugatsystem, men under 2010-talet blev den tidigare forskningen om att använda LNP:er för siRNA en grund för ny forskning om att använda LNP:er för mRNA. Lipider avsedda för korta siRNA-strängar fungerade inte bra för mycket längre mRNA-strängar, vilket ledde till omfattande forskning under mitten av 2010-talet för att skapa nya joniserbara katjoniska lipider lämpliga för mRNA. I slutet av 2020 använder flera mRNA-vacciner för SARS-CoV-2 LNP:er som sitt läkemedelsleveranssystem, inklusive både Moderna COVID-19-vaccinet och Pfizer–BioNTech COVID-19-vaccinerna. Moderna använder sin egen proprietära joniserbara katjoniska lipid som kallas SM-102 , medan Pfizer och BioNTech licensierade en joniserbar katjonisk lipid som heter ALC-0315 från Acuitas.
Lymfatisk absorptionsmekanism
Belysning av intestinal lymfatisk absorptionsmekanism från fasta lipidnanopartiklar med användning av Caco-2- cellinje som in vitro-modell utvecklades. Flera forskare har visat förbättringen av oral biotillgänglighet av dåligt vattenlösliga läkemedel när de är inkapslade i fasta lipidnanopartiklar . Denna ökade biotillgänglighet uppnås via lymfatisk leverans. För att belysa absorptionsmekanismen, från fasta lipidnanopartiklar, kan humant utskuret Caco-2- cellmonolager vara alternativ vävnad för utveckling av en in vitro-modell som ska användas som ett screeningsverktyg innan djurstudier genomförs. Resultaten som erhölls i denna modell antydde att den huvudsakliga absorptionsmekanismen för karvedilolladdade fasta lipidnanopartiklar kunde vara endocytos och, mer specifikt, clathrin-medierad endocytos .
Se även
- Nanomedicin , det allmänna området
- Micell , lipidkärna
- Liposom , lipidbilagerskal, en tidigare form med vissa begränsningar
- Lipoplex , ett komplex av plasmid eller linjärt DNA och lipider
- Riktad läkemedelstillförsel
- mRNA-1273 , från Moderna , använder LNP
- BNT162b2 , från BioNTech / Pfizer , använder LNP
Vidare läsning
- Müller, Rainer H.; Mäder, Karsten; Gohla, Sven (3 juli 2000). "Fastiga lipidnanopartiklar (SLN) för kontrollerad läkemedelsleverans – en översyn av det senaste inom tekniken". European Journal of Pharmaceutics and Biopharmaceutics . 50 (1): 161–177. doi : 10.1016/S0939-6411(00)00087-4 . PMID 10840199 .
- Shah, Mansi K.; Madan, Parshotam; Lin, Senshang (juni 2014). "Förberedelse, in vitro-utvärdering och statistisk optimering av karvedilol-laddade fasta lipidnanopartiklar för lymfatisk absorption via oral administrering". Läkemedelsutveckling och teknologi . 19 (4): 475–485. doi : 10.3109/10837450.2013.795169 . PMID 23697916 . S2CID 42174732 .
- Shah, Mansi K.; Madan, Parshotam; Lin, Senshang (3 oktober 2015). "Belysning av intestinal absorptionsmekanism för karvedilol-laddade fasta lipidnanopartiklar med hjälp av Caco-2-cellinje som en in vitro-modell". Läkemedelsutveckling och teknologi . 20 (7): 877–885. doi : 10.3109/10837450.2014.938857 . PMID 25069593 . S2CID 40506806 .
externa länkar
- Fast Lipid Nanopartikel , ScienceDirect (2017)