Kobolt(II)fluorid
|
|
|
|
| Namn | |
|---|---|
|
IUPAC-namn
Kobolt(II)fluorid
|
|
| Andra namn koboltdifluorid
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChemSpider | |
| ECHA InfoCard | 100.030.044 |
| EG-nummer |
|
|
PubChem CID
|
|
| RTECS-nummer |
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| Co F 2 | |
| Molar massa | 96,93 g/mol |
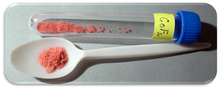
| Utseende | Rött kristallint fast ämne |
| Densitet |
4,46 g/cm 3 (vattenfri) 2,22 g/cm 3 (tetrahydrat) |
| Smältpunkt | 1 217 °C (2 223 °F; 1 490 K) |
| Kokpunkt | 1 400 °C (2 550 °F; 1 670 K) |
| 1,4 g/100 ml (25 °C) | |
| Löslighet | löslig i HF olöslig i alkohol , eter , bensen |
| +9490,0·10 -6 cm3 / mol | |
| Strukturera | |
|
tetragonal (a,fri) ortorhombisk (tetrahydrat) |
|
| Faror | |
| NFPA 704 (branddiamant) | |
| Dödlig dos eller koncentration (LD, LC): | |
|
LD 50 ( mediandos )
|
oral (råtta): 150 mg/kg |
| Besläktade föreningar | |
|
Andra anjoner
|
kobolt(II)oxid , kobolt(II)klorid |
|
Andra katjoner
|
järn(II)fluorid , nickel(II)fluorid |
|
Besläktade föreningar
|
kobolttrifluorid |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
Kobolt(II)fluorid är en kemisk förening med formeln (CoF 2 ). Det är en rosa kristallin fast förening som är antiferromagnetisk vid låga temperaturer (T N =37,7 K) Formeln ges för både den röda tetragonala kristallen, (CoF 2 ), och den tetrahydratröda ortogonala kristallen, (CoF 2 ·4H 2 O ). CoF 2 används i syrekänsliga fält, nämligen metallproduktion. I låga koncentrationer har den folkhälsoanvändningar. CoF 2 är svårlösligt i vatten. Föreningen kan lösas i varm mineralsyra och sönderdelas i kokande vatten. Ändå är hydratet vattenlösligt , speciellt dihydrat-CoF2-2H2O- och trihydrat-CoF2-3H2O- formerna av föreningen. Hydratet kommer också att sönderdelas med värme.
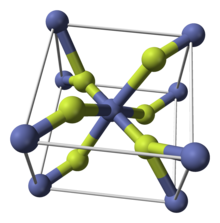
Liksom vissa andra metalldifluorider kristalliseras CoF 2 i rutilstrukturen , som har oktaedriska Co-centra och plana fluorider.
Förberedelse
Kobolt(II)fluorid kan framställas av vattenfri kobolt(II)klorid eller kobolt(II)oxid i en ström av vätefluorid :
- CoCl2 → 2HF → CoF2 + 2HCl
- CoO + 2HF CoF2 + H2O +
Det produceras i reaktionen av kobolt (III) fluorid med vatten.
Tetrahydratet kobolt(II)fluorid bildas genom att lösa kobolt(II ) i fluorvätesyra. Den vattenfria fluoriden kan extraheras från denna genom dehydrering . Annan syntes kan ske vid högre temperaturer. Det har visats att vid 500 °C fluor att kombineras med kobolt och producera en blandning av CoF 2 och CoF 3 .
Används
Kobolt(II)fluorid kan användas som katalysator för att legera metaller. Den används också för optisk deponering, varav den förbättrar den optiska kvaliteten avsevärt. Kobolt(II)fluorid finns i de flesta volymer i en sammansättning med ultrahög renhet. Kompositioner med hög renhet förbättrar optiska egenskaper och dess användbarhet som standard.
Analys
För att analysera denna förening kan kobolt(II)fluorid lösas i salpetersyra. Lösningen späds sedan med vatten tills lämplig koncentration för AA- eller ICP- spektrofotometri för kobolten. En liten mängd salt kan lösas i kallt vatten och analyseras för fluoridjoner med en fluoridjonselektiv elektrod eller jonkromatografi .
Kemiska egenskaper
CoF2 är en svag Lewis - syra . Kobolt(II)-komplex är vanligtvis oktaedriska eller tetraedriska. Som en 19-elektronsart är det ett bra reduktionsmedel, ganska oxiderbart till en 18-elektronförening. Kobolt(II)fluorid kan reduceras med väte vid 300 °C.
- ^ Pradyot Patnaik (2002), Handbook of Inorganic Chemicals , McGraw-Hill Professional, ISBN 978-0-07-049439-8
- ^ Pashkevich, DS; Radchenko SM; Mukhortov, DA, "Artikeltitel Heat Exchange between Cobalt(II) Fluoride Powder and the Wall of Rotating Cylinder" ( PDF) , Russian Journal of Applied Chemistry , Consultants Bureau, ISSN 1070-4272 , arkiverad från originalet (PDF) 2004 -09-29 , hämtad 2007-03-07
- ^ Ashcroft/Mermin: Fasta tillståndets fysik (Tab. 33.2)
- ^ Stout, JW; Reed, Stanley A. (1954). "Kristallstrukturen av MnF 2 , FeF 2 , CoF 2 , NiF 2 och ZnF 2 ". J. Am. Chem. Soc . 76 (21): 5279–5281. doi : 10.1021/ja01650a005 .
- ^ JC Bailar (1973), Comprehensive Inorganic Chemistry , Pergoamon
externa länkar
- Nationell föroreningsinventering - Kobolt faktablad
- Nationell föroreningsinventering - Faktablad om fluor och föreningar
- [1]

