H5N1 genetisk struktur
 |
H5N1 genetisk struktur är den molekylära strukturen av H5N1 -virusets RNA .
H5N1 är en subtyp av influensa A-virus . Experter tror att det kan mutera till en form som lätt överförs från person till person. Om en sådan mutation inträffar kan den förbli en H5N1-subtyp eller kan skifta subtyper som H2N2 gjorde när den utvecklades till Hong Kong Flu- stammen av H3N2 .
H5N1 har muterats genom antigen drift till dussintals högpatogena varianter, men alla tillhör för närvarande genotyp Z av aviär influensavirus H5N1. Genotyp Z uppstod genom omsortiment 2002 från tidigare högpatogena genotyper av H5N1 som först dök upp i Kina 1996 hos fåglar och i Hong Kong 1997 hos människor . "H5N1-virus från mänskliga infektioner och de närbesläktade fågelvirus som isolerades 2004 och 2005 tillhör en enda genotyp, ofta kallad genotyp Z."
Denna infektion av människor sammanföll med en epizootisk (en epidemi hos icke-människor) av H5N1-influensa i Hongkongs fjäderfäpopulation. Detta panzootiska utbrott (en sjukdom som drabbar djur av många arter, särskilt över ett brett område) stoppades genom att hela tamfjäderfäpopulationen inom territoriet dödades. Namnet H5N1 hänvisar till undertyperna av ytantigener som finns på viruset : hemagglutinin typ 5 och neuraminidas typ 1.
Genotyp Z av H5N1 är nu den dominerande genotypen av H5N1. Genotyp Z är endemisk hos fåglar i Sydostasien och representerar ett långsiktigt pandemihot.
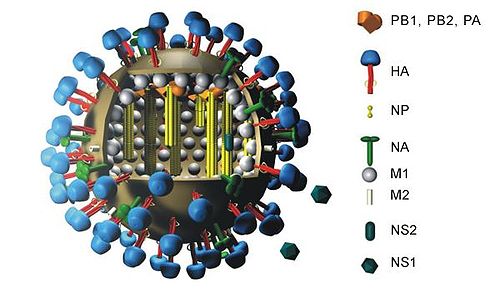
Influensa A-virus har 11 gener på åtta separata RNA- molekyler Orthomyxovirus :
- PB2 ( polymeras basic 2)
- PB1 (polymeras basic 1)
- PB1-F2 (alternativ öppen läsram nära 5'-änden av PB1-genen)
- PA (syrat polymeras)
- HA ( hemagglutinin )
- NP ( nukleoprotein )
- NA ( neuraminidas )
- M1 och M2 (matris)
- NS1 (icke-strukturell)
- NEP/NS2 (nukleär export av vRNPs)
Två av de viktigaste RNA-molekylerna är HA och PB1. HA skapar ett ytantigen som är särskilt viktigt för transmissibilitet . PB1 skapar en viral polymerasmolekyl som är särskilt viktig vid virulens .
HA RNA - molekylen innehåller HA-genen, som kodar för hemagglutinin , som är ett antigent glykoprotein som finns på ytan av influensavirusen och som ansvarar för att viruset binds till cellen som infekteras. Hemagglutinin bildar spikar på ytan av influensavirus som fungerar för att fästa virus till celler . Denna bindning krävs för effektiv överföring av influensavirusgener till celler, en process som kan blockeras av antikroppar som binder till hemagglutininproteinerna.
En genetisk faktor för att skilja mellan humana influensavirus och fågelinfluensavirus är att fågelinfluensa HA binder alfa 2-3 sialinsyrareceptorer medan human influensa HA binder alfa 2-6 sialinsyrareceptorer. Svininfluensavirus har förmågan att binda båda typerna av sialinsyrareceptorer. Människor har receptorer av fågeltyp vid mycket låg densitet och kycklingar har receptorer av humantyp vid mycket låg densitet. Vissa isolat tagna från H5N1-infekterade människor har observerats ha HA-mutationer vid positionerna 182, 192, 223, 226 eller 228 och dessa mutationer har visat sig påverka den selektiva bindningen av viruset till de tidigare nämnda sialinsyrafågel- och/ eller humana cellytreceptorer. Dessa är de typer av mutationer som kan förändra ett fågelinfluensavirus till ett influensapandemivirus .
En virulensstudie från 2008 som parade i ett laboratorium ett fågelinfluensa -H5N1- virus som cirkulerade i Thailand 2004 och ett humant influensa - H3N2 -virus som återfanns i Wyoming 2003 producerade 63 virus som representerade olika potentiella kombinationer av gener för humant och fågelinfluensa A-virus . En av fem var dödlig för möss vid låga doser. Det virus som bäst matchade H5N1 för virulens var ett med hemagglutinin (HA), neuraminidas (NA) och PB1 aviär influensavirus RNA-molekyler med sina gener kombinerade med de återstående fem RNA-molekylerna (PB2, PA, NP, M, och NS) med sina gener från det mänskliga influensaviruset. Både virusen från pandemin 1957 och pandemin 1968 bar på en PB1-gen av fågelinfluensavirus. Författarna föreslår att upptagning av en fågelinfluensavirus PB1-gen kan vara ett kritiskt steg i ett potentiellt influensapandemivirus som uppstår genom omsortiment ."
PB1 kodar för PB1-proteinet och PB1-F2-proteinet. PB1-proteinet är en kritisk komponent i det virala polymeraset . PB1-F2-proteinet kodas av en alternativ öppen läsram av PB1 RNA-segmentet och "interagerar med 2 komponenter i porkomplexet för mitokondriernas permeabilitetsövergång, ANT3 och VDCA1, [sensibiliserar] celler för apoptos. [... ] PB1- F2 bidrar sannolikt till viral patogenicitet och kan ha en viktig roll för att bestämma svårighetsgraden av pandemisk influensa." Detta upptäcktes av Chen et al. och redovisas i Nature . "Efter att ha jämfört virus från H5N1-utbrottet i Hongkong 1997, hittades en aminosyraförändring (N66S) i PB1-F2-sekvensen vid position 66 som korrelerade med patogenicitet. Samma aminosyraförändring (N66S) hittades också i PB1- F2-protein från 1918 års pandemi A/Brevig Mission/18-virus."
Terminologi
Orthomyxovirusfamiljen består av 7 släkten :
- Alfainfluensavirus
- Betainfluensavirus
- Gammainfluensavirus
- Deltainfluensavirus
- Isavirus
- Quaranjavirus
- Thogotovirus
"RNA-virusen" inkluderar de "negativa sens ssRNA-virusen" som inkluderar familjen "Orthomyxoviridae" som innehåller fem släkten, klassificerade genom variationer i nukleoprotein (NP och M) antigener. En av dessa är släktet "Influensavirus A" som består av en enda art som kallas " Influensa A-virus" ; en av dess undertyper är H5N1 .
H5N1 (liksom andra fågelinfluensavirus) har stammar som kallas "högpatogena" (HP) och "lågpatogena" (LP). Fågelinfluensavirus som orsakar HPAI är mycket virulenta och dödligheten i infekterade flockar närmar sig ofta 100 %. LPAI-virus är i allmänhet av lägre virulens, men dessa virus kan fungera som stamfader till HPAI-virus. Den nuvarande stammen av H5N1 som är ansvarig för dödsfall av tamfåglar i Asien är en HPAI-stam; andra stammar av H5N1 som förekommer på andra håll i världen är mindre virulenta och klassificeras därför som LPAI-stammar. Alla HPAI-stammar som hittills identifierats har involverat H5- och H7-subtyper. Distinktionen gäller patogenicitet hos fjäderfä, inte människor. Normalt är ett högpatogent fågelvirus inte högpatogent för varken människor eller icke-fjäderfäfåglar. Denna nuvarande stam av H5N1 är ovanlig eftersom den är dödlig för så många arter.
Både "influensa" (som betyder influensa) och "A" (som betyder art typ A) kan användas som adjektiv för substantivet "virus" vilket resulterar i substantivfrasen "influensa A-virus"; som när det skrivs med versal är egennamnet Influensa A-virus som är namnet på arten som substantivfrasen också syftar på.
Sammanhang
- Virus
Ett virus är en typ av mikroskopisk parasit som infekterar celler i biologiska organismer.
- Orthomyxoviridae
Orthomyxoviridae är en familj av RNA-virus som infekterar ryggradsdjur. Det inkluderar de virus som orsakar influensa . Virus av denna familj innehåller 7 till 8 segment av linjärt negativt sens enkelsträngat RNA .
- Influensavirus
"Influensavirus" hänvisar till en undergrupp av Orthomyxoviridae som skapar influensa . Denna taxonomiska kategori är inte baserad på fylogenetik .
- Influensa A-virus
Influensa A-virus har 10 gener på åtta separata RNA-molekyler, som av ovan nämnda skäl heter PB2, PB1, PA, HA, NP, NA, M och NS. HA, NA och M anger strukturen av proteiner som är mest medicinskt relevanta som mål för antivirala läkemedel och antikroppar . (En elfte nyligen upptäckt gen som kallas PB1-F2 skapar ibland ett protein men saknas i vissa influensavirusisolat.) Denna segmentering av influensegenomet underlättar genetisk rekombination genom segmentomsortering hos värdar som är infekterade med två olika influensavirus samtidigt . Influensa A-virus är den enda arten i influensavirus A- släktet i familjen Orthomyxoviridae och är enkelsträngade, segmenterade RNA-virus med negativ känsla .
"Influensavirusets RNA-polymeras är ett multifunktionellt komplex som består av de tre virala proteinerna PB1, PB2 och PA, som tillsammans med det virala nukleoproteinet NP bildar det minsta komplementet som krävs för viral mRNA-syntes och replikering."
Ytkodande gensegment
- Ytantigenkodande gensegment (RNA-molekyl): (HA, NA)
- HA kodar för hemagglutinin , som är ett antigent glykoprotein som finns på ytan av influensavirus och som är ansvarigt för att binda viruset till cellen som infekteras. Hemagglutinin bildar spikar på ytan av influensavirus som fungerar för att fästa virus till celler . Denna bindning krävs för effektiv överföring av influensavirusgener till celler, en process som kan blockeras av antikroppar som binder till hemagglutininproteinerna. En genetisk faktor för att skilja mellan humana influensavirus och fågelinfluensavirus är att "aviär influensa HA binder alfa 2-3 sialinsyrareceptorer medan human influensa HA binder alfa 2-6 sialinsyrareceptorer. Svininfluensavirus har förmågan att binda båda typerna av sialinsyrareceptorer." En mutation som hittades i Turkiet 2006 "inkluderar en substitution i ett prov av en aminosyra vid position 223 i hemoagglutininreceptorproteinet . Detta protein gör att influensaviruset kan binda till receptorerna på ytan av dess värdceller. Denna mutation har varit observerades två gånger tidigare - hos en far och son i Hong Kong 2003, och i ett dödsfall i Vietnam förra året. Det ökar virusets förmåga att binda till mänskliga receptorer och minskar dess affinitet för fjäderfäreceptorer, vilket gör stammar med denna mutation bättre anpassad för att infektera människor." [ enligt vem? ] En annan mutation i samma prov vid position 153 har ännu okända effekter. "Aminosyrarester vid positionerna 226 och 228 i receptorbindningsfickan av HA verkar bestämma bindningsaffiniteten till cellytreceptorer och påverka den selektiva bindningen av viruset till fågel (sialinsyra -2,3-NeuAcGal) eller människa (sialinsyra) acid -2,6-NeuAcGal) cellytereceptorer. De mänskliga isolaten A/HK/212/03 och A/HK/213/03 behåller signaturen som är associerad med bindning av fågelreceptorer, men de har en unik aminosyrasubstitution (Ser227Ile) i receptorbindningsfickan som inte fanns ens i det närbesläktade A/Gs/HK/739.2/02 (genotyp Z+) viruset." Ny forskning avslöjar att människor har receptorer av fågeltyp vid mycket låga tätheter och kycklingar har humantypreceptorer vid mycket låga tätheter. Forskare "fann att mutationerna på två ställen i genen, identifierade som 182 och 192, tillåter viruset att binda till både fågel- och mänskliga receptorer." Se forskningsartiklar Host Range Restriction and Pathogenicity in the Context of Influenza Pandemic (Centers for Disease Control and Prevention, 2006) (av Gabriele Neumann och Yoshihiro Kawaoka) och Structure and Receptor Specificity of the Hemagglutinin from an H5N1 Influenza Virus the American Association Advancement of Science, 2006) (av James Stevens, Ola Blixt, Terrence M. Tumpey, Jeffery K. Taubenberger, James C. Paulson , Ian A. Wilson) för ytterligare detaljer.
- NA kodar för neuraminidas som är ett antigent glykoproteinenzym som finns på ytan av influensavirus . Det hjälper till att frigöra avkommavirus från infekterade celler. Influensaläkemedel Tamiflu och Relenza verkar genom att hämma vissa stammar av neuraminidas . De utvecklades baserat på N2 och N9. "I N1-formen av proteinet inverteras ett litet segment som kallas 150-loopen, vilket skapar en ihålig ficka som inte finns i N2- och N9-proteinerna. [...] När forskarna tittade på hur befintliga läkemedel interagerar med N1-proteinet, fann de att, i närvaro av neuraminidashämmare, ändrade slingan sin konformation till en liknande den i N2- och N9-proteinerna."
Internt kodande gensegment
- Interna virala proteinkodande gensegment (RNA-molekyl): (M, NP, NS, PA, PB1, PB2)
Matriskodande gensegment
- M kodar för matrisproteinerna (M1 och M2) som tillsammans med de två ytproteinerna ( hemagglutinin och neuraminidas ) utgör virusets kapsid (skyddande päls). Den kodar genom att använda olika läsramar från samma RNA-segment.
- M1 är ett protein som binder till det virala RNA:t.
- M2 är ett protein som tar bort viruset och därigenom exponerar dess innehåll (de åtta RNA-segmenten) för värdcellens cytoplasma. M2- transmembranproteinet är en jonkanal som krävs för effektiv infektion. Aminosyrasubstitutionen (Ser31Asn) i M2 vissa H5N1-genotyper är associerad med amantadinresistens.
Nukleoproteinkodande gensegment.
- NP kodar för nukleoprotein .
- NS: NS kodar för två icke-strukturella proteiner (NS1 och NS2 - tidigare kallad NEP). "[D]en patogenicitet av influensavirus var relaterad till den icke-strukturella (NS) genen av H5N1/97-viruset".
- NS1: Icke-strukturell: kärna; effekter på cellulär RNA-transport, splitsning, translation. Anti-interferon protein. "NS1 av de högpatogena aviära H5N1-virusen som cirkulerar i fjäderfä och sjöfåglar i Sydostasien kan vara ansvarig för ett förstärkt proinflammatoriskt cytokinsvar (särskilt TNFa ) inducerat av dessa virus i mänskliga makrofager ". H5N1 NS1 kännetecknas av en enda aminosyraförändring vid position 92. Genom att ändra aminosyran från glutaminsyra till asparaginsyra kunde forskarna upphäva effekten av H5N1 NS1. [Denna] enstaka aminosyraförändring i NS1-genen ökade kraftigt patogeniciteten hos H5N1-influensaviruset."
- NEP: Det "nukleära exportproteinet (NEP, tidigare kallat NS2-proteinet) förmedlar exporten av vRNPs ".
Polymeraskodande gensegment
- PA kodar för PA-proteinet som är en kritisk komponent i det virala polymeraset .
- PB1 kodar för PB1-proteinet och PB1-F2-proteinet.
- PB1-proteinet är en kritisk komponent i det virala polymeraset .
- PB1-F2-proteinet kodas av en alternativ öppen läsram av PB1 RNA-segmentet och "interagerar med 2 komponenter i porkomplexet för mitokondriernas permeabilitetsövergång, ANT3 och VDCA1, [sensibiliserar] celler för apoptos. [... ] PB1- F2 bidrar sannolikt till viral patogenicitet och kan ha en viktig roll för att bestämma svårighetsgraden av pandemisk influensa." Detta upptäcktes av Chen et al. och redovisas i Nature . "Efter att ha jämfört virus från H5N1-utbrottet i Hongkong 1997, hittades en aminosyraförändring (N66S) i PB1-F2-sekvensen vid position 66 som korrelerade med patogenicitet. Samma aminosyraförändring (N66S) hittades också i PB1- F2-protein från 1918 års pandemi A/Brevig Mission/18-virus."
- PB2 kodar för PB2-proteinet som är en kritisk komponent i det virala polymeraset . Från och med 2005 hade 75 % av H5N1 humanvirusisolat från Vietnam en mutation bestående av lysin vid rest 627 i PB2-proteinet; som tros orsaka höga nivåer av virulens. Fram till H5N1 hade alla kända fågelinfluensavirus en Glu vid position 627, medan alla mänskliga influensavirus hade ett lysin . Från och med 2007, "Uppkomsten av 3 (eller fler) substammar från EMA [EMA= E urope, M iddle East, A frica] clade representerar flera nya möjligheter för aviär influensa (H5N1) att utvecklas till en mänsklig pandemisk stam. I motsats till stammar som cirkulerar i Sydostasien, härrör EMA-virus från en stamfader som har mutationen PB2 627K. Dessa virus förväntas ha förbättrade replikationsegenskaper hos däggdjur, och spridningen av EMA har faktiskt sammanfallit med det snabba uppkomsten av fall hos däggdjur – inklusive människor i Turkiet, Egypten, Irak och Djibouti, och katter i Tyskland, Österrike och Irak. Tyvärr verkar virus av EMA-typ vara lika virulenta som de uteslutande asiatiska stammarna: av 34 mänskliga infektioner utanför Asien till mitten av -2006, 15 har varit dödliga." Lys vid PB2–627 tros ge fågel-H5N1-virus fördelen av effektiv tillväxt i de övre och nedre luftvägarna hos däggdjur.
Mutation
Influensavirus har en relativt hög mutationshastighet som är karakteristisk för RNA-virus . Segmenteringen av influensegenomet underlättar genetisk rekombination genom segmentomsortering hos värdar som är infekterade med två olika influensavirus samtidigt. H5N1-virus kan sortera gener med andra stammar som saminfekterar en värdorganism, såsom en gris, fågel eller människa, och muterar till en form som lätt kan passera bland människor. Detta är en av många möjliga vägar till en pandemi.
Förmågan hos olika influensastammar att visa artselektivitet beror till stor del på variation i hemagglutiningenerna . Genetiska mutationer i hemagglutiningenen som orsakar enstaka aminosyrasubstitutioner kan väsentligt förändra förmågan hos virala hemagglutininproteiner att binda till receptorer på värdcellernas yta. Sådana mutationer i aviärt H5N1-virus kan förändra virusstammar från att vara ineffektiva när det gäller att infektera mänskliga celler till att vara lika effektiva för att orsaka mänskliga infektioner som vanligare typer av humana influensavirus. Detta betyder inte att en aminosyrasubstitution kan orsaka en pandemi, men det betyder att en aminosyrasubstitution kan orsaka att ett fågelinfluensavirus som inte är patogent hos människor blir patogent hos människor.
H3N2 (" svininfluensa ") är endemisk hos grisar i Kina och har upptäckts hos grisar i Vietnam, vilket ökar rädslan för uppkomsten av nya variantstammar. Den dominerande stammen av årligt influensavirus i januari 2006 var H3N2 , som nu är resistent mot de vanliga antivirala läkemedlen amantadine och rimantadine . Möjligheten att H5N1 och H3N2 utbyter gener genom omsortiment är ett stort problem. Om en omsortering i H5N1 inträffar kan den förbli en H5N1-subtyp, eller så kan den skifta undertyper, som H2N2 gjorde när den utvecklades till Hong Kong Flu-stammen av H3N2 .
Både H2N2- och H3N2 -pandemistammarna innehöll RNA-segment av fågelinfluensavirus . "Medan de pandemiska mänskliga influensavirusen 1957 (H2N2) och 1968 (H3N2) uppenbarligen uppstod genom omsortering mellan mänskliga och fågelvirus, verkar influensaviruset som orsakade "spanska sjukan" 1918 helt och hållet härröra från en fågelkälla".
I juli 2004 rapporterade forskare under ledning av H. Deng från Harbin Veterinary Research Institute , Harbin , Kina och professor Robert G. Webster vid St. Jude Children's Research Hospital , Memphis, Tennessee , resultat av experiment där möss hade exponerats för 21 isolat av bekräftade H5N1-stammar erhållna från ankor i Kina mellan 1999 och 2002. De fann "ett tydligt tidsmönster av progressivt ökande patogenicitet". Resultat som rapporterades av Dr. Webster i juli 2005 avslöjar ytterligare progression mot patogenicitet hos möss och längre virusutsöndring från ankor.
Asiatisk härstamning HPAI A(H5N1) är uppdelad i två antigena klader. "Clade 1 inkluderar isolat av människor och fåglar från Vietnam , Thailand och Kambodja och fågelisolat från Laos och Malaysia . Clade 2-virus identifierades först i fågelisolat från Kina , Indonesien , Japan och Sydkorea innan de spreds västerut till Mellanöstern , Europa och Afrika . Clade 2-virusen har varit primärt ansvariga för mänskliga H5N1-infektioner som har inträffat under slutet av 2005 och 2006, enligt WHO. Genetisk analys har identifierat sex subclades av clade 2, varav tre har en distinkt geografisk spridning och har varit inblandad i mänskliga infektioner: Karta
- Subclade 1, Indonesien
- Subclade 2, Europa, Mellanöstern och Afrika (kallad EMA)
- Subclade 3, Kina"
En studie från 2007 fokuserad på EMA-undergruppen har belyst EMA-mutationerna ytterligare. "De 36 nya isolaten som rapporteras här utökar avsevärt mängden hel-genomsekvensdata som är tillgängliga från nyligen genomförda isolat av fågelinfluensa (H5N1). Innan vårt projekt innehöll GenBank endast 5 andra kompletta genom från Europa för perioden 2004–2006, och den innehöll inga hela genom från Mellanöstern eller norra Afrika. Vår analys visade flera nya fynd. För det första faller alla prover från Europa, Mellanöstern och Afrika i en klad som skiljer sig från andra samtida asiatiska klader, som alla delar samma härkomst med ursprunglig stam från Hong Kong från 1997. Fylogenetiska träd byggda på vart och ett av de 8 segmenten visar en konsekvent bild av 3 härstamningar, som illustreras av HA-trädet som visas i figur 1. Två av kladdarna innehåller uteslutande vietnamesiska isolat, den mindre av dessa, med 5 isolat märker vi V1, den större kladden, med 9 isolat, är V2. De återstående 22 isolaten faller alla i en tredje, tydligt distinkt kladd, märkt EMA, som omfattar prover från Europa, Mellanöstern och Afrika. Träd för de andra 7 segmenten visar en liknande topologi, med kladerna V1, V2 och EMA tydligt separerade i varje fall. Analyser av alla tillgängliga kompletta influensa-(H5N1)-genom och av 589 HA-sekvenser placerade EMA-kladen till skillnad från de stora kladerna som cirkulerar i Folkrepubliken Kina, Indonesien och Sydostasien."
Se https://web.archive.org/web/20090709040039/http://who.int/csr/disease/avian_influenza/H5CompleteTree.pdf för ett genetiskt träd med 1 342 H5N1-virus baserat på deras HA-gen, som visar deras kladbeteckningar .
Se även
Vidare läsning
- Influensarapport 2006 Onlinebok.
- Ghedin E, Sengamalay NA, Shumway M, Zaborsky J, Feldblyum T, Subbu V, Spiro DJ (november 2005). "Storskalig sekvensering av mänsklig influensa avslöjar den dynamiska karaktären hos viral genomevolution" . Naturen . 437 (7062): 1162–1166. Bibcode : 2005Natur.437.1162G . doi : 10.1038/nature04239 . PMID 16208317 . presenterar en sammanfattning av vad som har upptäckts i Influenza Genome Sequencing Project .
- Länkar och beskrivningar till sammanfattningar och fullständiga texter Denna bibliografi över publikationer av fågelinfluensa har sammanställts genom ett samarbete mellan USGS National Wildlife Health Center och Wildlife Disease Information Node.
- Sök efter forskningspublikationer om H5N1: Entez PubMed
-
Beigel JH, Farrar J, Han AM, et al. ; Världshälsoorganisationens (WHO) skrivkommittés samråd om mänsklig influensa A/H5. (september 2005). "Aviär influensa A (H5N1) infektion hos människor". N. Engl. J. Med . 353 (13): 1374–85. doi : 10.1056/NEJMra052211 . hdl : 10722/45195 . PMID 16192482 .
{{ citera tidskrift }}: CS1 underhåll: flera namn: lista över författare ( länk ) - Evolutionär "Tree of Life" för H5N1:
- Här är det fylogenetiska trädet för hemagglutiningen-segmentet för influensavirus. Aminosyraförändringar i tre linjer (fågel, gris, människa) av influensavirus hemagglutininproteinsegment HA1.
- Här är trädet som visar utvecklingen genom omsortiment av H5N1 från 1999 till 2004 som skapade Z genotypen 2002.
- Här är trädet som visar evolution genom antigen drift sedan 2002 som skapade dussintals högpatogena varianter av Z genotypen av fågelinfluensavirus H5N1, av vilka några i allt högre grad anpassas till däggdjur.
- WHO (PDF) innehåller den senaste evolutionära "Livets träd" för H5N1- artikeln Antigena och genetiska egenskaper hos H5N1-virus och kandidat-H5N1-vaccinvirus utvecklade för potentiell användning som pre-pandemivaccin publicerad 18 augusti 2006
- Hiromoto Y, Yamazaki Y, Fukushima T, et al. (maj 2000). "Evolutionär karakterisering av de sex interna generna av H5N1 humant influensa A-virus" . J. Gen. Virol . 81 (Pt 5): 1293–303. doi : 10.1099/0022-1317-81-5-1293 . PMID 10769072 .
- Genomdatabas Sidan länkar till den fullständiga sekvensen av influensa A-virusets (A/Goose/Guangdong/1/96(H5N1))-genomet.
externa länkar
- Influensaforskningsdatabas – Databas över influensa genomiska sekvenser och relaterad information.