Fosforibulokinas
| phosphoribulokinase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 3D tecknad skildring av en phosphoribulokinase protomer från Methanospirillum hungatei
| |||||||||
| Identifiers | |||||||||
| EG nr. | 2.7.1.19 | ||||||||
| CAS-nr. | 9030-60-8 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA inträde | ||||||||
| ExPASy | NiceZyme-vy | ||||||||
| KEGG | KEGG inträde | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB- strukturer | RCSB PDB PDBe PDB summa | ||||||||
| Genontologi | AmiGO / QuickGO | ||||||||
| |||||||||
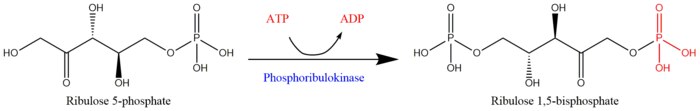
Fosforibulokinas (PRK) ( EC 2.7.1.19 ) är ett väsentligt fotosyntetiskt enzym som katalyserar den ATP -beroende fosforyleringen av ribulos 5-fosfat (RuP) till ribulos 1,5-bisfosfat (RuBP), båda mellanprodukterna i Calvin Cycle . Dess huvudsakliga funktion är att regenerera RuBP, som är det initiala substratet och CO 2 -acceptormolekylen i Calvin-cykeln. PRK tillhör familjen transferasenzymer , speciellt de som överför fosforinnehållande grupper ( fosfotransferaser ) till en alkoholgruppsacceptor. Tillsammans med ribulos 1,5-bisfosfatkarboxylas/oxygenas (RuBisCo) är fosforibulokinas unikt för Calvin-cykeln. Därför bestämmer PRK-aktivitet ofta metabolismen i organismer för vilka kolfixering är nyckeln till överlevnad. Mycket initialt arbete med PRK gjordes med spenatbladsextrakt på 1950-talet; efterföljande studier av PRK i andra fotosyntetiska prokaryota och eukaryota organismer har följt. Möjligheten att PRK kan existera erkändes först av Weissbach et al. år 1954; till exempel noterade gruppen att koldioxidfixering i råspenatextrakt förbättrades genom tillsats av ATP. Den första reningen av PRK genomfördes av Hurwitz och kollegor 1956.
ATP + Mg 2+ - D-ribulos 5-fosfat ADP + D-ribulos 1,5-bisfosfat
De två substraten för PRK är ATP och D-ribulos 5-fosfat, medan dess två produkter är ADP och D-ribulos 1,5-bisfosfat. PRK-aktivitet kräver närvaron av en tvåvärd metallkatjon såsom Mg2 + , såsom indikeras i reaktionen ovan.
Strukturera
Strukturen hos PRK är annorlunda i prokaryoter och eukaryoter. Prokaryota PRK existerar typiskt som oktamerer av 32 kDa subenheter , medan eukaryota PRK ofta är dimerer av 40 kDa subenheter. Strukturella bestämningar för eukaryot PRK har ännu inte utförts, men prokaryota PRK-strukturer är fortfarande användbara för att rationalisera regleringen och mekanismen för PRK. Från och med 2018 har endast två kristallstrukturer lösts för denna klass av enzymer i Rhodobacter sphaeroides och Methanospirillum hungatei , med respektive PDB- accessionskoder 1A7J och 5B3F .

Rhodobacter sphaeroides
I Rhodobacter sphaeroides existerar PRK (eller RsPRK) som en homooktomer med protomerer sammansatta av sjusträngade blandade β-sheets , sju α-helixar och ett extra par av antiparallella β-strängar . RsPRK-subenheten uppvisar en proteinveckning som är analog med veckningen av nukleotidmonofosfatkinaser (NMP) . Mutagenesstudier tyder på att antingen Asp 42 eller Asp 169 fungerar som den katalytiska basen som deprotonerar O1 hydroxylsyre på RuP för nukleofil attack av ATP, medan den andra fungerar som en ligand för en metallkatjon som Mg 2+ (läs mekanismen nedan för mer information ). Andra rester närvarande vid det aktiva stället för RsPRK inkluderar His 45, Arg 49, Arg 168 och Arg 173, som påstås vara involverade i RuP-bindning. (Se bild till höger).
Methanospirillum hungatei
I archaeal PRK av Methanospirillum hungatei existerar PRK (eller MhPRK) som en homodimer av två protomerer , var och en bestående av åtta-strängade blandade β-ark omgivna av α-helixar och β-strängar - liknande strukturen av bakteriell PRK från R. sphaeroides (se info. ruta ovan) . Även om deras kvartära strukturer skiljer sig åt och de har låg aminosyrasekvensidentitet , har MhPRK och RsPRK strukturellt liknande N-terminala domäner såväl som sekventiellt konserverade rester som His 55, Lys 151 och Arg 154.
Mekanism och aktivitet
PRK katalyserar fosforyleringen av RuP till RuBP. En katalytisk rest i enzymet (dvs. aspartat i RsPRK) deprotonerar O1-hydroxylsyren på RuP och aktiverar den för nukleofil attack av y-fosforylgruppen i ATP. När y-fosforylgruppen överförs från ATP till RuP, inverteras dess stereokemi . För att tillåta sådan inversion får den katalytiska mekanismen för PRK inte involvera en fosforylenzymmellanprodukt .
Vissa studier tyder på att båda substraten (ATP och RuP) binder samtidigt till PRK och bildar ett ternärt komplex . Andra föreslår att substrattillsatsen är sekventiell; den speciella ordningen med vilken substrat tillsätts är fortfarande omtvistad och kan faktiskt variera för olika organismer. Förutom att binda dess substrat, kräver PRK också ligering till tvåvärda metallkatjoner som Mg 2+ eller Mn 2+ för aktivitet; Hg 2+ har visats inaktivera enzymet.
Enzymspecificitet
PRK visar hög specificitet för ribulos-5-fosfat. Det verkar inte på något av följande substrat: D-xylulos 5-fosfat , fruktos 6-fosfat och sedoheptulos 7-fosfat . Men vid höga koncentrationer kan PRK ibland fosforylera ribos-5-fosfat , en förening uppströms RuBP-regenereringssteget i Calvin-cykeln. Dessutom har PRK isolerad från Alcaligenes eutrophus visat sig använda uridintrifosfat (UTP) och guanosintrifosfat (GTP) som alternativa substrat till ATP.
pH-effekter
Fosforyleringsreaktionen fortskrider med maximal hastighet vid pH 7,9, utan någon detekterbar aktivitet vid pH under 5,5 eller över 9,0.
förordning
Mekanismerna genom vilka prokaryota och eukaryota PRK regleras varierar . Prokaryota PRK är vanligtvis föremål för allosterisk reglering medan eukaryota PRK ofta regleras av reversibelt tiol / disulfidutbyte . Dessa skillnader beror sannolikt på strukturella skillnader i deras C-terminala domäner
Allosterisk reglering av prokaryotisk PRK
NADH är känt för att stimulera PRK-aktivitet, medan AMP och fosfoenolpyruvat (PEP) är kända för att hämma aktiviteten. AMP har visat sig vara involverad i kompetitiv hämning i Thiobacillus ferrooxidans PRK. Å andra sidan fungerar PEP som en icke-konkurrerande hämmare av PRK.
Reglering av eukaryot PRK
Eukaryot PRK regleras vanligtvis genom reversibel oxidation/reduktion av dess cysteinsulfhydrylgrupper , men studier tyder på att dess aktivitet kan regleras av andra proteiner eller metaboliter i kloroplasten . Av sådana metaboliter 6-fosfoglukonat visat sig vara den mest effektiva hämmaren av eukaryot PRK genom att konkurrera med RuP om enzymets aktiva plats. Detta fenomen kan uppstå från likheten i molekylstruktur mellan 6-fosfoglukonat och RuP.
Nyare arbete med reglering av eukaryot PRK har fokuserat på dess förmåga att bilda multienzymkomplex med andra Calvin-cykelenzymer såsom glyceraldehyd-3-fosfatdehydrogenas (G3PDH) eller RuBisCo. I Chlamydomonas reinhardtii existerar kloroplast PRK och G3PDH som ett bienzymkomplex av 2 molekyler av dimer PRK och 2 molekyler av tetramer G3PDH grundlig association av en Arg 64-rest, vilket potentiellt kan överföra information mellan de två enzymerna också.
Multienzymkomplex kommer sannolikt att ha mer invecklade regleringsmekanismer, och studier har redan undersökt sådana processer. Till exempel har det visats att PRK-glyceraldehyd-3-fosfatdehydrogenaskomplex i Scenedesmus obliquus endast dissocierar för att frigöra aktiverade former av dess ingående enzymer i närvaro av NADPH , ditiotreitol (DTT) och tioredoxin . Ett annat ämne av intresse har varit att jämföra de relativa nivåerna av PRK-aktivitet för när det är komplext till när det inte är det. För olika fotosyntetiska eukaryoter kan enzymaktiviteten hos komplexbunden PRK förstärkas i motsats till fri PRK, och vice versa.
Andra namn
Det systematiska namnet på denna enzymklass är ATP:D-ribulos-5-fosfat-1-fosfotransferas. Andra namn i vanlig användning inkluderar fosfopentokinas, ribulos-5-fosfatkinas, fosfopentokinas, fosforibulokinas (fosforylerande), 5-fosforibuloskinas, ribulosfosfatkinas, PKK, PRuK och PRK.