Ditiotreitol
|
|

|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
(2S , 3S ) -1,4-bis(sulfanyl)butan-2,3-diol |
|
| Andra namn (2S , 3S ) -1,4-dimerkaptobutan-2,3-diol D - treo -1,4-dimerkaptobutan-2,3-diol D - treo - 1,4-dimerkapto-2,3-butandiol 1 ,4-Dithio - D -threitol Clelands reagens Reductacryl |
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.020.427 |
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C4H10O2S2 _ _ _ _ _ _ _ | |
| Molar massa | 154,253 g/mol |
| Utseende | Vitt fast material |
| Smältpunkt | 42 till 43 °C (108 till 109 °F; 315 till 316 K) |
| Kokpunkt | 125 till 130 °C (257 till 266 °F; 398 till 403 K) vid 2 mmHg |
| Löslig | |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
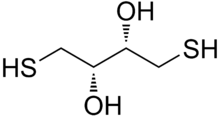
Dithiothreitol ( DTT ) är det vanliga namnet för ett småmolekylärt redoxreagens även känt som Clelands reagens , efter W. Wallace Cleland . DTT:s formel är C 4 H 10 O 2 S 2 och den kemiska strukturen av en av dess enantiomerer i dess reducerade form visas till höger; dess oxiderade form är en disulfidbunden 6-ledad ring (visas nedan). Reagenset används vanligtvis i sin racemiska form, eftersom båda enantiomererna är reaktiva. socker med fyra kolatomer , threose . DTT har en epimerisk ('syster') förening, ditioerytritol (DTE).
Reduktionsmedel
DTT är ett reduktionsmedel ; när den väl har oxiderats bildar den en stabil sexledad ring med en inre disulfidbindning . Den har en redoxpotential på -0,33 V vid pH 7. Reduktionen av en typisk disulfidbindning sker genom två på varandra följande tiol-disulfid-utbytesreaktioner och illustreras nedan. Reduktionen stannar vanligtvis inte vid de blandade disulfidtyperna eftersom den andra tiolen av DTT har en hög benägenhet att sluta ringen, bilda oxiderad DTT och lämna efter sig en reducerad disulfidbindning . Den reducerande kraften hos DTT är begränsad till pH-värden över 7, eftersom endast den negativt laddade tiolatformen -S - är reaktiv (den protonerade tiolformen -SH är inte); pKa för tiolgrupperna är 9,2 och 10,1 .

Ansökningar
DTT används som ett reducerande eller "avskyddande" medel för tiolerat DNA. De terminala svavelatomerna i tiolerat DNA har en tendens att bilda dimerer i lösning, speciellt i närvaro av syre. Dimerisering sänker avsevärt effektiviteten av efterföljande kopplingsreaktioner såsom DNA-immobilisering på guld i biosensorer. Vanligtvis blandas DTT med en DNA-lösning och tillåts reagera, och avlägsnas sedan genom filtrering (för den fasta katalysatorn) eller genom kromatografi (för flytande form). DTT-borttagningsproceduren kallas ofta "avsaltning". I allmänhet används DTT som ett skyddsmedel som förhindrar oxidation av tiolgrupper .
DTT används ofta för att reducera disulfidbindningarna i proteiner och, mer allmänt, för att förhindra att intramolekylära och intermolekylära disulfidbindningar bildas mellan cysteinrester i proteiner. Men även DTT kan inte reducera nedgrävda (otillgängliga lösningsmedel) disulfidbindningar, så reduktion av disulfidbindningar utförs ibland under denaturerande förhållanden (t.ex. vid höga temperaturer eller i närvaro av ett starkt denatureringsmedel som 6 M guanidiniumklorid , 8 M urea eller 1 % natriumdodecylsulfat ). DTT används ofta tillsammans med natriumdodecylsulfat i SDS-PAGE för att ytterligare denaturera proteiner genom att minska deras disulfidbindningar för att möjliggöra bättre separation av proteiner under elektrofores . På grund av förmågan att reducera disulfidbindningar kan DTT användas för att denaturera CD38 på röda blodkroppar. DTT kommer också att denaturera antigener i blodgruppssystemen Kell, Lutheran, Dombrock, Cromer, Cartwright, LW och Knops. Omvänt kan lösningsmedelsexponeringen för olika disulfidbindningar analyseras genom deras minskningshastighet i närvaro av DTT.
DTT kan också användas som oxidationsmedel . Dess främsta fördel är att det i praktiken inte finns några blandade disulfidarter, i motsats till andra medel som glutation . I mycket sällsynta fall kan en DTT- addukt bildas, dvs de två svavelatomerna i DTT kan bilda disulfidbindningar till olika svavelatomer; i sådana fall kan DTT inte cyklisera eftersom det inte har några sådana kvarvarande fria tioler.
Egenskaper
DTT är instabilt under omgivande atmosfäriska förhållanden eftersom det oxideras av syre; DTT bör förvaras och hanteras under inerta gaser för att förhindra oxidation. Ditiotreitols hållbarhet kan förlängas med kylning vid 2–8 °C. Oxidation ger ytterligare komplikationer eftersom oxiderad DTT uppvisar en stark absorbanstopp vid 280 nm. Eftersom tioler är mindre nukleofila än deras konjugerade baser, tiolater , blir DTT en mindre potent nukleofil när pH sjunker. ( 2S )-2-Amino-1,4-dimerkaptobutan (ditiobutylamin eller DTBA) är ett nytt ditiolreducerande medel som i viss mån övervinner denna begränsning av DTT. Tris(2-karboxietyl)fosfin ( TCEP ) är ett alternativt reduktionsmedel som är mer stabilt och effektivt vid lågt pH, men är skrymmande och minskar cystiner i vikta proteiner endast långsamt.
DTT:s halveringstid är 40 timmar vid pH 6,5 och 1,4 timmar vid pH 8,5 och 20 °C; dess halveringstid minskar ytterligare när temperaturen ökar. Närvaron av EDTA (etylendiamintetraättiksyra) för att kelatera tvåvärda metalljoner (Fe2 + , Cu2 + och andra) ökar avsevärt halveringstiden för DTT i lösning.
Se även
- 2-merkaptoetanol (BME)
- TCEP
externa länkar
-
 Media relaterade till Dithiothreitol på Wikimedia Commons
Media relaterade till Dithiothreitol på Wikimedia Commons