Discodermolid

|
|
| Namn | |
|---|---|
|
Föredraget IUPAC-namn
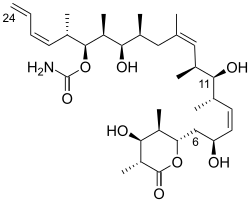
(3Z , 5S , 6S, 7S , 8R , 9S , 11Z , 13S , 14S,15S , 16Z , 18S ) -8,14,18 -trihydroxi-19- [ ( 2S , 3R ,4S , 5R ) -4-hydroxi-3,5-dimetyl-6-oxooxan-2-yl]-5,7,9,11,13,15-hexametylnonadeka-1,3 , 11,16-tetraen-6-ylkarbamat |
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ChEMBL | |
| ChemSpider | |
| KEGG | |
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| C33H55NO8 _ _ _ _ _ | |
| Molar massa | 593,79 g/mol |
| Smältpunkt | 112 till 113 °C (234 till 235 °F; 385 till 386 K) |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
(+)-Discodermolid är en naturlig polyketidprodukt som har visat sig stabilisera mikrotubuli . (+)-discodermolid isolerades av Gunasekera och hans medarbetare vid Harbour Branch Oceanographic Institute från djuphavssvampen Discodermia dissoluta 1990. ( +)-Discodermolid visade sig vara en potent hämmare av tumörcelltillväxt i flera MDR cancercellinjer. (+)-discodermolid uppvisar också några unika egenskaper, inklusive en linjär ryggradsstruktur, immunsuppressiva egenskaper både in vitro och in vivo, potent induktion av en accelererad senescensfenotyp och synergistisk antiproliferativ aktivitet i kombination med paklitaxel . Discodermolid erkändes som en av de mest potenta naturliga promotorerna för sammansättning av tubulin . Ett stort antal ansträngningar mot den totala syntesen av (+)-discodermolid styrdes av dess intressanta biologiska aktiviteter och extrema brist på naturliga källor (0,002 % vikt/vikt från frusen marin svamp). Den substanstillförsel som krävs för fullständiga kliniska prövningar kan inte tillgodoses genom skörd, isolering och rening. Från och med 2005 har försök till syntes eller halvsyntes genom jäsning visat sig misslyckade. Som ett resultat har all discodermolid som används i prekliniska studier och kliniska prövningar kommit från storskalig totalsyntes.
Historia
Discodermolide isolerades först 1990 från den karibiska marinsvampen Discodermia dissoluta av kemisten Dr. Sarath Gunasekera och biologen Dr. Ross Longley, forskare vid Harbor Branch Oceanographic Institution . Svampen innehöll 0,002 % discodermolid (7 mg/434 g svamp). Eftersom blandningen är ljuskänslig måste svampen skördas på ett minsta djup av 33 meter. Discodermolid visade sig initialt ha immunsuppressiva och svampdödande aktiviteter. [ citat behövs ]
Strukturera
(+)-discodermolid har en linjär polypropionatryggrad, avbruten av Z-olefinbindningar vid C(8,9) och C(13,14), en terminal Z-diensubstituent vid C(21–24), 13 stereogena centra ( inklusive fyra sekundära hydroxyler och sju metylsubstituenter), ett karbamat och en fullt substituerad D- lakton . Den relativa stereokemin bestämdes genom röntgenkristallografi . Den absoluta stereokemin av (+ ) -discodermolid rapporterades av Schreiber och hans medarbetare 1993. Discodermolid antar en U-formad konformation , där de inre (Z)-alkenerna fungerar som konformationella låsningar genom att minimera allylisk stam och synpentaninteraktioner längs ryggraden. D- laktonen hålls i en båtliknande konformation .
Biologiska aktiviteter
Immunsuppressiva egenskaper
Initial biologisk utvärdering av (+)-discodermolid av Longley-gruppen visade att den har immunsuppressiva egenskaper både in vitro och in vivo . Immunsuppressionssvaret observerades vid en relativt låg koncentration som (+)-discodermolid var icke-toxisk in vitro . I både humana perifera blodleukocyter och murina splenocyter visade sig (+)-discodermolid undertrycka den tvåvägsblandade lymfocytreaktionen . Dessutom undertrycktes mitogena svar från perifera blodleukocyter också av (+)-discodermoliden . Uppföljningsexperiment visade att (+)-discodermolid också har anti-proliferativa effekter i flera andra icke- lymfoida cellinjer . [ citat behövs ]
Antiproliferativa och antimitotiska egenskaper
(+)-Discodermolid är ett mycket potent antiproliferativt medel. (+)-Discodermolid-behandlade murina Do11.10T-hybridomceller kunde inte fortsätta normal cellcykling. I obehandlade kontroller hittades 68 % av cellerna i G1-fasen och 31 % i S-fasen och mindre än 1 % hittades i G2/M-fasen. Efter 3 timmars (+)-discodermolidbehandling återfanns emellertid 52 % vid G1-fasen, 40 % vid S-fasen och 58 % vid G2- och M-fasen. Detta resultat indikerade att (+)-discodermolid blockerar cellcykeln vid G2- och M-fas. Denna inhiberingseffekt visade sig också vara reversibel. Celler återupptar normal cykling inom 48 timmar efter avlägsnande av (+)-discodermolid från cellodlingsmediet. (+)-Discodermolid stoppar cellcykeln via bindning och stabilisering av mikrotubulinätverket . Hyperstabilisering av den mitotiska spindeln orsakar cellcykelstopp vid G2- och M-fas och leder så småningom till celldöd genom apoptos . Vid 10 µM koncentration kan (+)-discodermolid främja mikrotubulisammansättning utan mikrotubuli -associerade proteiner och GTP. Med mikrotubuli - associerat protein och GTP presenterat, kan 10µM (+)-discodermolid initiera tubulinpolymerisation vid 0 °C.
Potent inducerare av accelererad cellåldring
Discodermolid kan inducera senescensfenotypen . (+)-Discodermolid-behandlade Hela- , MDA-MB-231- , HCT-116- och A549 -celler uppvisade modererade till höga nivåer av p-galaktosidasaktivitet i alla fyra cellinjerna. β-galaktosidasaktiviteten är ett av kännetecknen för senescens . Andra vanliga egenskaper inkluderar ett upphörande av proliferation och ett ökat cytoplasmatiskt område. (+)-Discodermolid inducerade också uppreglering och aktivering i tre proteiner (p66Shc, Erk1 och Erk2).
Neuroskyddande medel
(+)-Discodermolid har också visat sig vara neuroprotektivt i senare Alzheimerforskning. Den mikrotubuli -stabiliserande egenskapen hos (+)-discodermolid användes för att återställa neuronfunktioner som har störts av den amyloidinducerade sekvestreringen. Tau-protein är känt för att stabilisera mikrotubulinätverket i friska neuroner . Det fungerade som "järnvägsspåret" på vilket aktin, tubulin , mitokondrier , neurotransmittorrelaterade enzymer och vesiklar som bär budbärarproteiner levereras. Närvaron av amyloid i cellen kan leda till tau-proteinaggregation och minskning av antalet mikrotubuli . I en transgen musmodell för human tauopati stabiliserar (+)-discodermolid mikrotubuli och återställer snabb axonal transport i celler, vilket kompenserar för funktionsförlusten orsakad av aggregering av tau-protein . De motoriska mössen uppvisade en fullständig återställande av normal rörelse med (+)-discodermolidbehandling.
Potent naturlig promotor för tubulinmontering
Discodermolid konkurrerar med paklitaxel om mikrotubulibindning , men med högre affinitet och är även effektivt i paklitaxel- och epotilonresistenta cancerceller. Discodermolid verkar också visa en anmärkningsvärt konsekvent 3D-molekylär konformation i fast tillstånd, i lösning och när det är bundet till tubulin ; molekyler med diskodermolids konformationsflexibilitet uppvisar vanligtvis mycket olika konformationer i olika miljöer.
Biosyntes
Många marina härledda polyketider som ofta finns i svampar kan inte odlas ur sin naturliga miljö. Att hitta generna som är ansvariga för biosyntesen av en svamphärledda polyketider är en svår uppgift att utföra på grund av svamparnas koloniala natur. Forskare kan ännu inte odla svamparna; därför har generna för biosyntesen av (+)-discodermolid ännu inte upptäckts.
Totala synteser
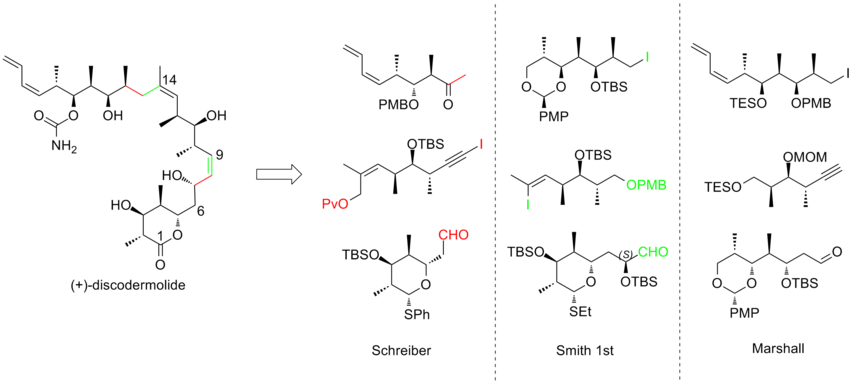
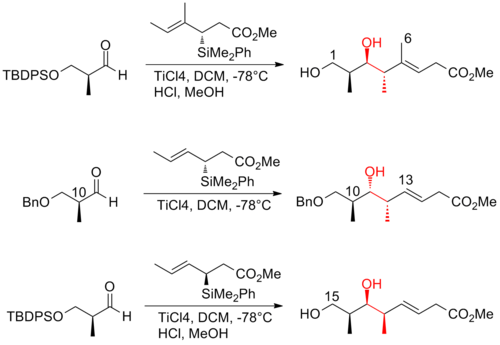
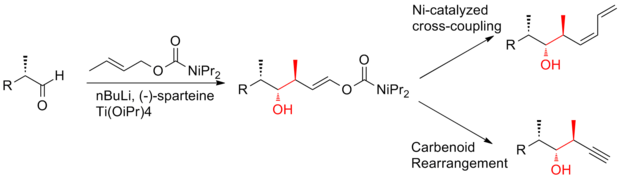
En intensiv ansträngning har gjorts mot den totala syntesen av (+)-discodermolid för att möta det växande intresset att studera dess kliniska profil. Mer än ett dussin synteser har publicerats av olika forskargrupper. Efter decenniums arbete har synteser av discodermolid blivit mer konvergenta och mer praktiska. Alla de totala syntestillvägagångssätten började med konstruktionen av tre stora fragment av ungefär ekvivalent komplexitet, som vart och ett innehåller metyl-hydroxyl-metyl- triaden av sammanhängande centra som matchar stereogeniciteten hos discodermolidmål. Här är tre exempel på retrosyntetiska analyser av (+)-discodermolid:
Total syntes av onaturlig antipod (-)-discodermolid
Schreiber-syntesen av (-)-discodermolid
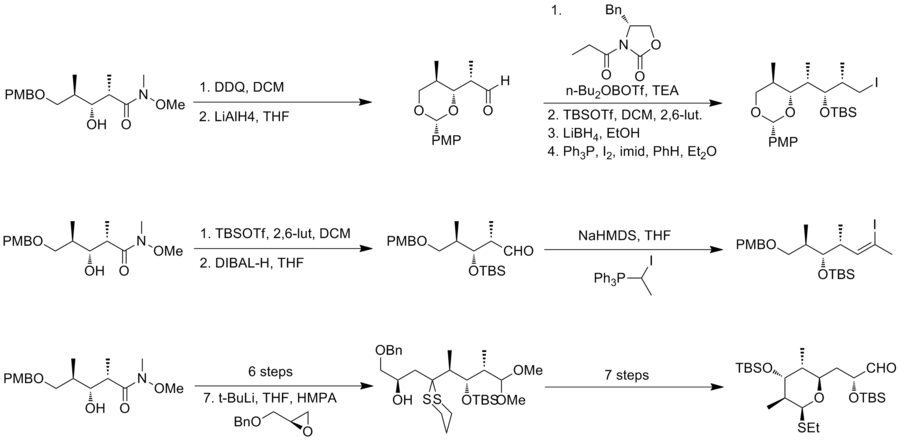
1993 rapporterade Schreiber och hans medarbetare den första totala syntesen av den onaturliga antipoden (-)-discodermolid och bestämde den absoluta stereokemin hos den naturliga produkten. Schreiber-teamet kände igen tre fragment av ungefär lika komplexitet som är åtskilda av olefiniska enheter i discodermolid. De två utgångsmaterialen, homoallyliska alkoholer, är båda lätt härledda från 3-hydroxi-2-metylpropionat.
Den trisubstituerade (Z)-alkenen av det första fragmentet genererades med användning av Still-Gennari-reagenset. Gilberts reagens användes sedan för att homologera det till en acetylen . Goekjian och Kishi-metoden användes sedan för att få det önskade fragmentet, jodoacetylen. Samma homoallylalkohol omvandlades till diol i fyra steg. Efter oxidation till ketoaldehyd homololerades den till diener genom en palladiumkatalyserad koppling med vinylzinkbromid för att generera det andra fragmentet. Den sexledade ringsubenheten transformerades från en acetal, som erhölls genom en intramolekylär 1,4-addition av en förmodad hemiacetalmellanprodukt .
Schreiber-teamet fann att NiCl 2 och CrCl 2 främjade tillsats av alkynyljodid till aldehyd effektivt. Reaktionen ger en 2:1-blandning av önskad produkt och dess isomer . Den oönskade isomeren kan emellertid återvinnas till den önskade epimeren i tre steg, inklusive Swern-oxidation och Coreys asymmetriska reduktion. Pd katalyserade partiell hydrering av alkynen för att etablera Z-konfigurationen vid C(8)–C(9). Pivaloyloxigruppen omvandlades sedan till en bromid för den slutliga kopplingen. En stereoselektiv enolatalkylering mellan den allyliska bromiden med litiumenolatet härrörande från det andra fragmentet gav en 3:1-blandning av isomerer och fullbordade ryggradssammansättningen av (-)-discodermolid . Under den slutliga omvandlingen gav NaBH4 - reduktionen av keton en separerbar 2,5:1-blandning av isomerer. Schreiber-syntesen av (-)-discodermolid har ett totalt utbyte av 3,2 % med en längsta linjär sekvens på 24 steg och 36 totala steg. 1996 publicerade Schreiber-gruppen den totala syntesen av naturligt discodermolid med liknande syntetisk strategi (4,3 % totalt utbyte, 36 steg, 24 steg längsta linjära sekvens.
Den första generationens Smith-syntes av (-)-discodermolid
1995 rapporterade Smith och hans medarbetare den andra totala syntesen av (-)-discodermolid. Smith anpassade den tredubbla konvergerande strategin för Schreiber-syntesen. I Smiths strategi delade alla tre fragmenten en gemensam prekursor , som var produkten av en högeffektiv femstegsomvandling på 50 g skala från 3-hydroxi-2-metylpropionat med 59 % utbyte. En Evans syn aldol-reaktion användes för att erhålla det önskade stereokemiska resultatet.
Syntesen av fragment A, alkyljodid, tillämpade Evans acyloxazolidinonmetod . Efter hydroxylskydd och reduktivt avlägsnande av det kirala hjälpmedlet , utfördes en jodering för att ge fragment A. Framställningen av fragment B började med TBS-skydd och DIBAL -reduktion. Den resulterande aldehyden kan omvandlas till önskad Z-trisubstituerad vinylhalogenid med 6:1 selektivitet. Nyckeldraget i syntesen av fragment C var tillsatsen av anjonen som härrör från ditian till bensylglycidyleter .
Palladium(0)-medierad korskoppling av vinyljodid med organozinkderivatet av alkyljodid gav produkt i 66 % utbyte. Efter en tvåstegsomvandling till motsvarande fosfoniumsalt , fortskred Wittig-förening av fosfoniumsalt med aldehyd, fragment C, med 76 % utbyte och god selektivitet. Det sista inslaget i denna syntes var den titanförmedlade installationen av dien . Smith-syntesen av (-)-discodermolid har ett totalt utbyte på 2,0 % med en längsta linjär sekvens på 29 steg och 42 totala steg.
Myles-syntesen av (-)-discodermolid
År 1997 har Myles och hans medarbetare beskrivit den totala syntesen av (-)-discodermolid med användning av keleringskontrollerad alkylering som nyckelkopplingen . Den titanmedierade hetero- Diels–Alder-reaktionen av aldehyd med Danishefsky-dienen producerade framgångsrikt det utmanande Z-trisubstituerade C(13)–C(14)-olefinen i allyljodidfragmentet. Stereogeniciteten i C(16)-C(21)-subenheten inducerades genom att använda Evans aldol-kemi. Det slutliga fragmentets stereogenicitet bestämdes genom en tennbefrämjad asymmetrisk allylering. Noterbart skulle det korrekta oxidationstillståndet vid C(1) för detta fragment minska antalet steg efter kopplingen av fragment. Myles-syntesen av (-)-discodermolid har ett totalt utbyte på 1,5 % med en längsta linjär sekvens på 25 steg och 44 totala steg.
Total syntes av naturlig antipod (+)-discodermolid
Marshall-syntesen av (+)-discodermolid
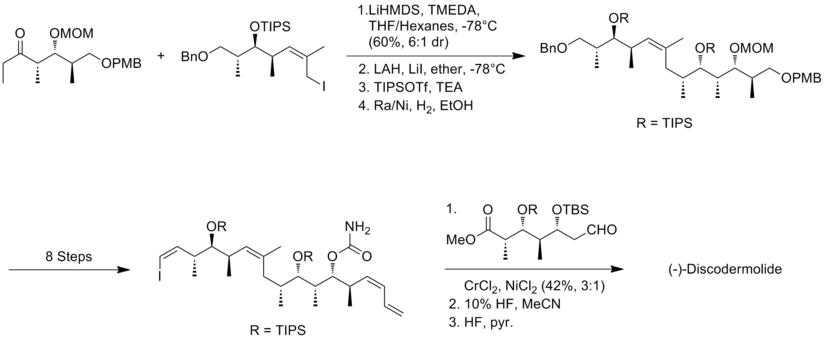
Marshall och hans medarbetare använde sin asymmetriska allenylmetall-homoaldol-taktik för att konstruera polypropionatramar av (+)-discodermolid. Det nya med Marshall-metoden är att de tre stereotriadsubenheterna sätts samman genom tillsats av icke- racemiska allenylmetallreagenser till (S)-3-silyloxi-2-metylpropanal för att generera både syn/syn och syn/anti-addukter. Den centrala egenskapen för syntesen av alkyljodidfragmentet var behandlingen av aldehyd till allenyltributylstannan i närvaro av BF3 -eterat för att få syn/syn-isomeren. Syn/anti-metyl-hydroxyl-metyl stereotriader erhölls genom reaktionen mellan aldehyd och homokiralt allenylzinkreagens.
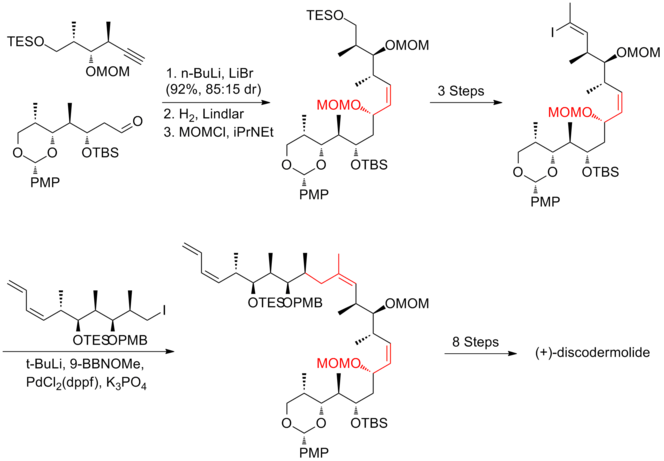
I Marshall-syntesen fortskred kopplingen mellan alkynfragmentet till aldehydfragmentet i 92% utbyte, med 85:15 diastereoselektivitet . Kondensationen av aldehyd med jodetylidentrifenylfosforan var det mest utmanande steget, som ger 40 % utbyte och en 85:15 oskiljbar blandning av (Z) och (E) isomerer. Den sista kopplingen utfördes via en Suzuki- förening av vinyljodid med boronatet som härrör från alkyljodid. Marshall-syntesen av (+)-discodermolid har ett totalt utbyte på 1,3 % med en längsta linjär sekvens på 30 steg och 48 totala steg.
Evans syntes av (+)-discodermolid
Evans och hans medarbetare har utvecklat en strategi som är starkt beroende av asymmetrisk aldolmetodik för produktion av polypropionatryggraden. De använde en Claisen-kondensationsreaktion för att konstruera den C(13)–C(14) trisubstituerade Z-olefinen. Evans syntes av (+)-discodermolid har ett totalt utbyte på 6,4 % med en längsta linjär sekvens på 31 steg och 49 totala steg.
Smiths gramskalasyntes av (+)-discodermolid
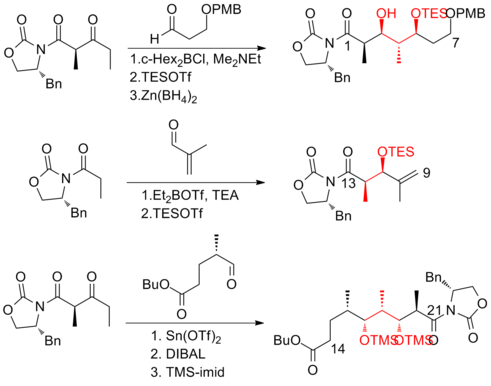
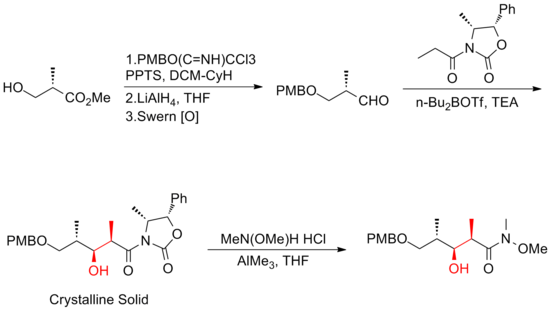
1999 rapporterade Smith och hans medarbetare den första syntesen i gramskala av (+)-discodermolid, som gör utvecklingen av (+)-discodermolid möjlig som ett potentiellt kemoterapeutiskt medel . Denna syntetiska väg licensierades till Novartis Pharmaceuticals . En av de stora förbättringarna var att ingen rening krävdes i de första fyra stegen av femstegssekvensen mot den gemensamma prekursorn eftersom intermediären, aldoladdukten, är en kristallin fast substans. En kelationskontrollerad Mukaiyama- aldol-reaktion användes för att ställa in stereogeniciteten vid C(5) för laktonfragmentet .
Två år senare publicerar Smith och hans medarbetare en tredje generationens syntes där den skrymmande TBS-eterskyddsgruppen vid C(11) av prekursorjodiden ersattes av en mindre steriskt belastande grupp, MOM. Denna modifiering gynnar bildningen av det önskade fosfoniumsaltet . Smiths tredje generations syntes av (+)-discodermolid har ett totalt utbyte på 6,0 % med en längsta linjär sekvens på 21 steg och 35 totala steg.
Fjärde generationens Smith-syntes av (+)-discodermolid
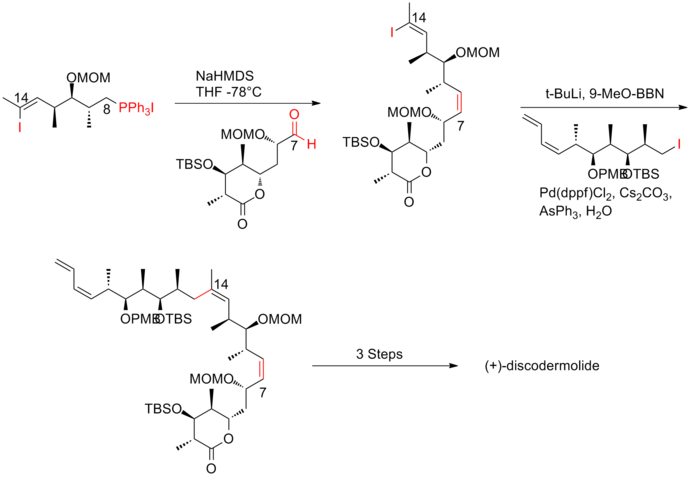
Nyckelfunktionen i den fjärde generationens tillvägagångssätt var användningen av dubbelriktat fragment, vinyljodid/fosfoniumsalt. fosfoniumsalt kan lätt erhållas eftersom den trisubstituerade vinyljodiden är mindre reaktiv än alkyljodid . En Wittig-reaktion med följt av Suzuki-koppling med alkyljodid gav effektivt ryggraden i (+)-discodermolid. Smiths fjärde generations syntes av (+)-discodermolid har ett totalt utbyte på 9,0 % med en längsta linjär sekvens på 17 steg och 36 totala steg.
Den första generationens Paterson-syntes av (+)-discodermolid
Paterson och hans medarbetare vid University of Cambridge har utvecklat en strategi som använder nya kelationskontrollerade och reagenskontrollerade aldolreaktioner med hög selektivitet för subenhetskopplingar. Ett annat särdrag i denna syntes var induktionen av C(8)-C(9)-olefin med cis-geometri via Still-Gennari Horner-Wadsworth-Emmons-reaktion . Patersons första generations syntes av (+)-discodermolid har ett totalt utbyte på 10,3 % med en längsta linjär sekvens på 23 steg och 42 totala steg.
Andra och tredje generationens Paterson syntes av (+)-discodermolid
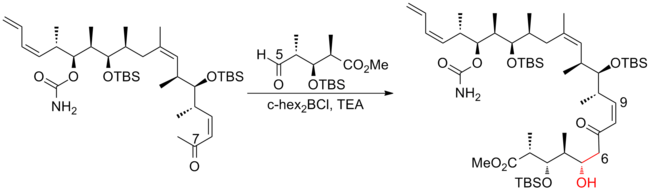
2003 rapporterade Paterson och medarbetare om en strategi som är starkt beroende av substrat-härledd stereokontroll. Istället för en reagenskontrollerad aldolreaktion i Patersons första generations syntes användes en dicyklohexylbor-medierad anti-aldol för att koppla ihop C(5)-C(6), vilket leder till en signifikant ökning av diastereoselektiviteten från 4:1 till 92 :8. Noterbart användes Still-Gennari-modifierad Horner-Wadsworth-Emmons-reaktion också för att konstruera den C(13)-C(14)-trisubstituerade olefinen i tidigt skede av denna syntes. Paterson andra generationens syntes av (+)-discodermolid har ett totalt utbyte på 7,8 % med en längsta linjär sekvens på 24 steg och 35 totala steg.
2004 avslöjade Paterson och hans medarbetare tredje generationens totalsyntes av (+)-discodermolid. Den stegvisa metoden som användes i tidigare generationer för att införliva C(1)-C(8)-subenheten ersattes av en Still-Gennari-olefinering i sent skede, vilket leder till en märkbar förbättring av konvergensen. Patersons tredje generations syntes av (+)-discodermolid har en total avkastning på 11,1 % (högst rapporterad hittills) med en längsta linjär sekvens på 21 steg och 37 totala steg.
Novartis 60-g total syntes av (+)-discodermolid
I början av 2004 har Novartis Pharmaceuticals avslöjat detaljerna i en 60g-skala syntes av (+)-discodermolid. Denna syntes använde Smiths gram-skala tillvägagångssätt och Paterson första generationens slutspel. Denna syntes gör det möjligt att utvärdera (+)-discodermolid som ett in vivo kemoterapeutiskt medel för vuxna patienter som uppvisar avancerade solida maligniteter i kliniska fas I-prövningar . Novartis syntes av (+)-discodermolid har ett totalt utbyte på 0,65 % med en längsta linjär sekvens på 26 steg och 33 totala steg.
Panek totalsyntes av (+)-discodermolid
2004 rapporterade Panek och hans medarbetare ett tillvägagångssätt som drar fördel av kiral krotylsilan-baserad CC-bindningskonstruktionsmetod för att erhålla den absoluta stereokemin av de tre subenheterna av (+)-discodermolid. En av nyckelfunktionerna i Patersons tillvägagångssätt är användningen av hydrozirkonations -korskopplingsmetodik för konstruktion av C13-C14 (Z)-olefin. Acetataldolreaktion med höga nivåer av 1,5-antistereoinduktion och palladiummedierad sp2-sp3 - korskopplingsreaktion används för att ansluta subenheter. Panek-syntesen av (+)-discodermolid har ett totalt utbyte på 2,1 % med en längsta linjär sekvens på 27 steg och 42 totala steg.
Ardissons totala syntes av (+)-discodermolid
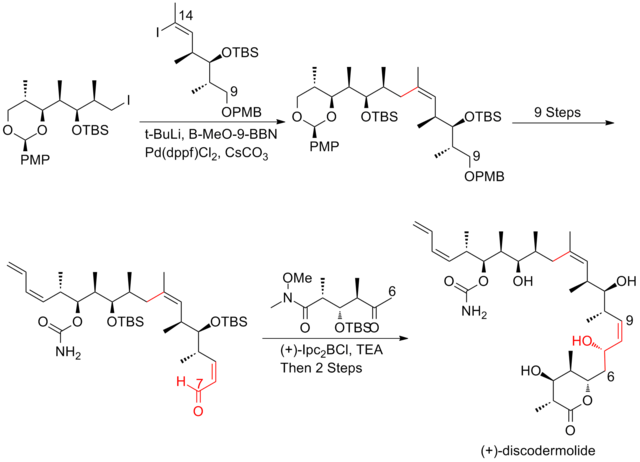
2008 rapporterade Ardisson och hans medarbetare en strategi som tillämpar en krotyltitaneringsreaktion upprepade gånger för att ge homoallyliska (Z)-O-en-karbamatalkoholer med utmärkt selektivitet. Denna krotyltitaneringsreaktion producerar inte bara effektivt syn-anti-metyl-hydroxi-metyltriaderna av (+)-discodermolid, utan ger också produkter som lätt kan omvandlas till terminal (Z) -dien . C13-C14 (Z)-olefinen installeras genom en mycket selektiv dyotrop omarrangering. Ardission-syntesen av (+)-discodermolid har ett totalt utbyte på 1,6 % med en längsta linjär sekvens på 21 steg.
Klinisk utveckling
Harbor Branch Oceanographic Institution licensierade (+)-discodermolide till Novartis , som påbörjade en klinisk fas 1-prövning 2004. Studien drog slutsatsen att läkemedlet resulterade i minimal toxicitet och representerar en ny verkningsmekanism. Amos B. Smiths forskargrupp har i samarbete med Kosan Biosciences ett pågående prekliniskt läkemedelsutvecklingsprogram.
Se även
externa länkar
- Kemikalie- och tekniknyheter: Uppskalad syntes av Discodermolide av Michael Freemantle
- Discodermolides kemi och biologi
- Betzer och Ardissons syntes av (+)-Discodermolid