Tymidinkinas i klinisk kemi
Tymidinkinas är ett enzym , ett fosfotransferas (ett kinas ): 2'-deoxitymidinkinas, ATP-tymidin 5'-fosfotransferas, EC 2.7.1.21 som katalyserar reaktionen:
Thd + ATP → TMP + ADP
där Thd är (deoxi)tymidin, ATP är adenosin 5'-trifosfat, TMP är (deoxi)tymidin 5'-fosfat och ADP är adenosin 5'-difosfat. Inom klinisk kemi har det föreslagits som en spridningsmarkör för prognos, verifiering av diagnos, kontroll av behandling (särskilt som en kompletterande diagnostik) och uppföljning av malign sjukdom. Det används främst i samband med hematologiska maligniteter men utvecklingen av känsligare analyser har stimulerat undersökningar för dess användning i relation till solida tumörer.
Historia
Inkorporeringen av tymidin i DNA påvisades omkring 1950. Något senare visades det att denna inkorporering föregicks av fosforylering och omkring 1960 renades och karakteriserades det ansvariga enzymet. Den potentiella användningen som en tumörmarkör föreslogs av Gronowitz et al.
Biokemi
Däggdjur har två isoenzymer som är kemiskt mycket olika, tymidinkinas 1 (TK1) och tymidinkinas 2 (TK2). Den förra hittades först i fostervävnad, den andra befanns vara rikligare i vuxen vävnad, och därför kallades de initialt fetala och vuxna tymidinkinaser. Snart visades det att TK1 endast finns närvarande i cytoplasman i väntan på celldelning (cellcykelberoende) medan närvaron av TK2, som finns i mitokondrierna, är cellcykeloberoende. TK1 syntetiseras av cellen under S-fasen av celldelning. Efter avslutad celldelning bryts TK1 ned intracellulärt, så att det inte går över i kroppsvätskor efter normal celldelning. TK-enzymet som föreslås som en tumörmarkör är den cytosoliska cellcykelberoende TK1. Det finns under celldelning i mycket högre koncentrationer än TK2 och det frisätts i mängder som helt dominerar tymidinkinasaktiviteten i blod och andra kroppsvätskor.
Förutom cellulära TKs har virusspecifika tymidinkinaser identifierats i Herpes simplex-virus, Varicella zoster-virus och Epstein-Barr-virus. De skiljer sig biokemiskt från tymidinkinas från däggdjursceller och hämmas av specifika inhibitorer som inte påverkar aktiviteten hos tymidinkinaser från däggdjur. Bestämning av viralt tymidinkinas har föreslagits för bekräftelse av diagnos och för kontroll av behandling av virusinfektioner.
Tymidin reagerar med ATP för att ge tymidinmonofosfat och ADP.
Fysiologiska sammanhang
Tymidinmonofosfat , produkten av reaktionen som katalyseras av tymidinkinas, fosforyleras i sin tur till tymidindifosfat av enzymet tymidylatkinas och vidare till tymidintrifosfat av enzymet nukleosid-difosfatkinas . Trifosfatet ingår i en DNA- molekyl, en reaktion som katalyseras av ett DNA-polymeras och en komplementär DNA- molekyl (eller en RNA- molekyl i fallet med omvänt transkriptas , ett enzym som finns i retrovirus ). Tymidinmonofosfat produceras av cellen i två olika reaktioner - antingen genom fosforylering av tymidin enligt beskrivningen ovan eller genom metylering av deoxiuridinmonofosfat, en produkt av andra metabola vägar som inte är relaterade till tymidin, av enzymet tymidylatsyntas (De novo syntes). Denna andra väg används av cellen under normala förhållanden, och det är tillräckligt för att tillföra tymidinmonofosfat för DNA-reparation. När en cell förbereder sig för att dela sig krävs en helt ny uppsättning av DNA, och kravet på byggstenar, inklusive tymidintrifosfat, ökar. Celler förbereder sig för celldelning genom att göra några av de enzymer som krävs under delningen. De finns normalt inte i cellerna och nedregleras och bryts ned efteråt. Sådana enzymer kallas räddningsenzymer. Tymidinkinas 1 är ett sådant räddningsenzym, medan tymidinkinas 2 inte är cellcykelberoende.
Tymidinkinas i serum
Bakgrund
Tymidinkinas är ett räddningsenzym som endast finns i väntan på celldelning. Enzymet frigörs inte från celler som genomgår normal delning där cellerna har en speciell mekanism för att bryta ned de proteiner som inte längre behövs efter att celldelningen är klar. Hos normala försökspersoner är mängden tymidinkinas i serum eller plasma därför mycket låg. Tumörceller frisätter enzym till cirkulationen, troligen i samband med att döda eller döende tumörceller störs. Tymidinkinasnivån i serum fungerar därför som ett mått på malign proliferation och, indirekt, som ett mått på tumörens aggressivitet. Formen av enzym som finns i cirkulationen motsvarar inte proteinet som kodas av genen: genen motsvarar ett protein med en molekylvikt runt 25 kD. Det är en dimer med en molekylvikt på cirka 50 kD, om den aktiveras av ATP en tetramer med en molekylvikt på cirka 100 kD. Huvudfraktionen av det aktiva enzymet i cirkulationen har en molekylvikt på 730 kD och är troligen bunden i ett komplex till andra proteiner.
Mått
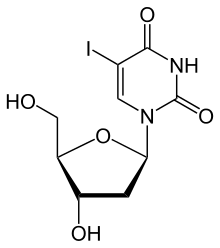
Tymidinkinas 1 (TK1)-nivåer i serum eller plasma kan mätas baserat på deras enzymatiska aktivitet eller i termer av massa med hjälp av immunanalyser. I enzymaktivitetsanalyser görs detta genom inkubation av ett serumprov med en substratanalog. Den äldsta kommersiellt tillgängliga tekniken använder jod-deoxiuridin ( idoxuridin ) där en metylgrupp i tymidin har ersatts med radioaktivt jod. Detta substrat accepteras väl av enzymet. Monofosfatet av joddeoxiuridin adsorberas på aluminiumoxid som är suspenderad i inkubationsmediet. Efter dekantering och tvättning ger radioaktiviteten hos aluminiumoxiden ett mått på mängden tymidinkinas i provet. Kit som använder denna princip är kommersiellt tillgängliga från företagen Immunotech/Beckman och DiaSorin.
En icke-radioaktiv analysmetod har utvecklats av företaget Dia-Sorin. I denna teknik fosforyleras 3'-azido-2',3'-deoxitymidin ( Zidovudine , AZT) först till AZT 5'-monofosfat (AZTMP) av TK1 i provet. AZTMP mäts i en immunanalys med anti-AZTMP-antikroppar och AZTMP-märkt peroxidas . Analysen körs i ett slutet system på laboratorieroboten från DiaSorin. DiviTum-analysen från Biovica International använder en annan tymidinanalog, bromodeoxiuridin , som substrat för enzymet. Reaktionsprodukten fosforyleras ytterligare till trifosfat och inkorporeras i DNA-strängar av polytymidin. Polytymidinen binder till strängar av polyadenin kopplade till botten av brunnarna i mikrotiterplattor. Där detekteras det med en ELISA -teknik: Brunnarna fylls med en lösning av en monoklonal antikropp mot brom-deoxiuridin. Den monoklonala antikroppen har bundits (konjugerats) till enzymet alkaliskt fosfatas . Efter att det obundna antikroppskonjugatet har tvättats bort, tillsätts en lösning av ett substrat till det alkaliska fosfataset, para-nitrofenylfosfat . Produkten av reaktionen, para-nitrofenol , är gul vid alkaliskt pH och kan mätas med fotometri . Denna metod har utvärderats mot den tidigare radioaktiva tekniken. Det är betydligt känsligare än de tidigare enzymatiska metoderna och kan därför vara mer lämpligt för användning med solida tumörer där lägre förhöjningar av TK1 finns i kroppsvätskor. Jämförelser av metoderna har publicerats. I studien av Nisman et al., medan Divitum på det hela taget var känsligare än Liaison-metoden, föreslog författarna att Liaison-metoden kan ha varit känsligare för de TK1-former som finns hos normala försökspersoner. En kontinuerlig och homogen fluorescerande metod baserad på härdningsteknik har nyligen publicerats. Denna teknik använder naturligt tymidin som substrat och kan även bestämma deoxycytidinkinas samtidigt med TK1.
Immunanalyser som möjliggör direkt bestämning av TK1-protein har nu utvecklats. Immunanalyser har fördelar jämfört med enzymaktivitetsmetoder genom att de kan mäta TK1-isoformer som är enzymatiskt inaktiva plus att de är opåverkade av serum-TK1-hämmare. Den specifika aktiviteten av serum TK1 skiljer sig mellan cancertyper och användning av en immunanalysmetod kan hjälpa till att jämföra TK1-nivåer mellan patienter och malignitetstyper. På grund av de grundläggande skillnaderna i analysmetoder kan resultat erhållna med TK1-aktivitetsanalyser och immunanalys skilja sig, t.ex. visade sig en ELISA baserad på antikroppar mot TK1 TK 210-epitopen vara dubbelt så känslig som en TK1-aktivitetsanalys för att skilja mellan friska kvinnor och patienter med bröstcancer
Två immunanalyser har utvecklats mot den exponerade '210'-epitopen som täcker den C-terminala aminosyrasekvensen 194-225, en direkt dot-blot-analys med kemiluminescensslutpunkt och en mikrotiter sandwich-ELISA. Dot-blot-analysen är en nitrocellulosamembranbaserad analys med ett kemiluminescent substrat som använder en primär kyckling-IgY-antikropp och en sekundär märkt anti-IgY-antikropp. I korthet sätts provet på ett nitrocellulosamembran där proteinerna i provet binder. Efter blockering inkuberas membranet med en primär anti-TK1-antikropp som binder till TK1 på membranet. Efter tvätt tillsätts en biotinylerad andra antikropp riktad mot IgY-antikroppar följt av streptavidinmärkt HRP och ett kemiluminescerande substrat. En mikrotiter-ELISA baserad på monoklonala antikroppar riktade mot "210"-epitopen är tillgänglig från AroCell. AroCell TK 210 ELISA-systemet använder en förbehandlingsbuffert för att bryta upp TK1-komplexen med hög molekylvikt och exponera TK 210-epitopen. De behandlade proverna sätts till en mikrotiterplatta belagd med anti-TK 210 monoklonala antikroppar. Efter inkubering och tvättning tillsätts en andra anti-TK 210-antikropp märkt med biotin. Efter ytterligare tvätt framkallas färgen med streptavidinmärkt pepparrotsperoxidas med TMP som substrat.
En immunoaffinitetsanalys för mikrochipelektrofores för bestämning av serumkoncentration av tymidinkinas har beskrivits. Dess funktion demonstrerades med användning av rekombinant TK1. Det påstås vara snabbt och enkelt att utföra.
Serumtymidinkinas 1 vid olika maligniteter
Hematologiska maligniteter
De mest dramatiska ökningarna av serum TK1 ses vid hematologiska maligniteter . Ökningen av både TK1-aktivitet och koncentration är större vid hematologiska maligniteter jämfört med solida tumörer.
Non-Hodgkin lymfom
Den huvudsakliga användningen av serum-TK1-aktivitetsanalyser är vid non-Hodgkin-lymfom . Denna sjukdom har ett brett spektrum av aggressivitet, från långsamt växande indolent sjukdom som knappast kräver behandling till mycket aggressiva, snabbt växande former som bör behandlas omedelbart. Detta återspeglas i värdena för TK1-aktivitet i serum, som sträcker sig från nära det normala intervallet för långsamt växande tumörer till mycket höga nivåer för snabbt växande former.
Leukemier
Leukemier ger normalt inte stora diagnostiska svårigheter, eftersom den mikroskopiska analysen av cellerna i blodet vanligtvis ger entydiga resultat. TK1-analyser kan dock ge kompletterande information om aggressiviteten och risken för progression.
Myelom
Myelom utgör också ofta en diagnostisk utmaning. De maligna cellerna är ofta inte tillgängliga för mikroskopisk analys, och prognosen är ofta osäker. Därför kan information om prognosen vara väsentlig vid beslutet om behandlingen. Flera studier bekräftar det nära sambandet mellan prognos och tymidinkinasaktivitet vid myelom.
Myelodysplastiskt syndrom
Ett mycket intressant fall är myelodysplastiskt syndrom : vissa övergår snabbt till akut leukemi, medan andra förblir indolenta under mycket lång tid. Identifiering av de som tenderar att övergå till öppen leukemi är viktigt för behandlingen. Ett samband mellan prognosen och TK1-värdena i serum har visats vid myelodysplastiskt syndrom.
Fasta tumörer
Ökade serum-TK1-nivåer kan hittas hos patienter med solida tumörer. Ökningen av TK1-aktivitetsnivåer i serum hos patienter med solida tumörer är inte lika stora som de är för hematologiska maligniteter. De första metoderna för bestämning av TK1-aktivitet i serum hade en begränsad känslighet. När det gäller metoder som använder radioaktivitet var ett skäl att mängden radioaktivitet som tillåts enligt lag i normala radioimmunoanalyslaboratorier är strikt begränsad. Den experimentella metoden som först utvecklades av Gronowitz et al. använde mängder av radioisotop mycket högre än de som användes i kommersiella radioanalyser och därför var känsligheten tillräcklig för att upptäcka ökningar av serum-TK1 hos patienter med solida tumörer. Med kommersiella radioanalyser var detta svårt, och resultaten var inte särskilt övertygande. Senare gjorde mer känsliga, icke-radioaktiva tekniker det möjligt att mäta de lägre ökningarna från solida tumörer exakt. De lägre TK1-koncentrationerna och lägre TK1-specifik aktivitet som finns i solida tumörer kan göra TK1-immunanalyser mer lämpliga.
Lungcancer
Lungcancer är en av de vanligaste maligniteterna, både vad gäller incidens (cirka 15 % för både män och kvinnor i USA och i Europa) och efter dödlighet (25 % för kvinnor och 30 % för män). En viktig anledning till att dödligheten är högre än incidensen är att lungcancer oftast upptäcks och diagnostiseras i ett sent skede. Tidig upptäckt kan minska dödligheten. En annan anledning är att lungcancer, särskilt småcellig lungcancer, är mycket aggressiv med mycket låga femårsöverlevnadsgrader.
Det finns flera rapporter om användbarheten av TK1-aktivitetsmätningar i serum vid lungcancer. För diagnos kan kombination av TK1-immunanalys med andra biomarkörer vara särskilt värdefull medan fall i TK1-koncentration efter behandling kan ge prognostisk information.
Bröstcancer
Bröstcancer är den vanligaste cancerformen hos kvinnor efter incidens (cirka 25 % av cancerfallen i USA och Europa) och den näst största efter dödlighet (cirka 15 %). Orsaken till denna skillnad är framstegen under de senaste decennierna i behandlingen av bröstcancerfall och framför allt den medvetenhet hos allmänheten som har möjliggjort tidigare diagnos. En bidragande faktor är den utbredda användningen av mammografi för tidig upptäckt, självundersökning är en annan.
Många tumörmarkörer inklusive TK1 används för uppföljning och upptäckt av återfall hos bröstcancerpatienter. Immunanalyser kan vara känsligare än enzymaktivitetsanalyser för att detektera de TK1-former som finns i serum från patienter med bröstcancer. För diagnos kan kombination av TK1-analyser med andra biomarkörer, t.ex. CA 15-3, vara särskilt värdefull.
Prostatacancer
Bland män är prostatacancer den i särklass vanligaste cancerformen, och utgör cirka 25 % av den totala cancerincidensen bland män i USA och Europa. Dödligheten är mycket lägre än vad som kan förväntas av incidensen, cirka 10 % av den totala cancerdödligheten hos män i USA och Europa. En viktig orsak till den lägre dödligheten är att många prostatacancer växer långsamt så att patienterna inte dör av denna cancer utan av andra orelaterade orsaker.
Vid behandling av prostatacancer är det därför mycket viktigt att kunna skilja mellan långsamt och snabbt växande cancerformer. Tymidinkinas har föreslagits som ett komplement till PSA (prostataspecifikt antigen), den tumörmarkör som oftast används vid prostatacancer. Medan PSA anses ge en indikation på tumörmassan, indikerar tymidinkinasaktivitet graden av proliferation och markörerna kompletterar således varandra.
Andra solida tumörer
TK1-förhöjningar har också rapporterats i samband med många typer av solida tumörer inklusive njurcancer , blåscancer , magcancer , levercancer , neurologiska cancerformer, melanom , äggstockscancer, livmoderhalscancer och matstrupscancer.
Icke-maligna förhöjningar
Det finns flera icke-maligna orsaker till förhöjning av tymidinkinas i serum inklusive vitamin B12-brist, vilket leder till perniciösa anemivirusinfektioner (särskilt av virus från herpesgruppen ) och sårläkning efter trauma och operation.
Tymidinkinas hos husdjur
Det finns också rapporter om användning av tymidinkinas som en tumörmarkör hos husdjur, hos hästar, hos hundar hos katter och hos kor. Förhöjningar hos hundar med bakterieinfektioner har också rapporterats.
Tymidinkinas i vävnad
Tymidinkinas har bestämts i vävnadsprover efter extraktion av vävnaden och ett samband mellan resultaten och sjukdomsprogression har visats. Däremot har ingen standardmetod för extraktionen eller för analysen utvecklats och TK-bestämning i extrakt från celler och vävnader har inte validerats i relation till någon specifik klinisk fråga, se dock Arnér et al. Romain et al. och Alegre et al.
I de nedan refererade studierna är metoderna som används och hur resultaten redovisas så olika att jämförelser mellan olika studier inte är möjliga.
TK1-nivåerna i fostervävnad under utveckling är högre än motsvarande vävnader senare.
Vissa icke-maligna sjukdomar ger också upphov till dramatiska höjningar av TK-värden i celler och vävnad: i perifera lymfocyter under monocytos och i benmärg under perniciös anemi. Eftersom TK1 finns i celler under celldelning är det rimligt att anta att TK-aktiviteten i malign vävnad bör vara högre än i motsvarande normal vävnad. Detta bekräftas också i de flesta studier: en högre TK-aktivitet finns i neoplastisk än i normal vävnad, i hjärntumörer, i hematologiska maligniteter, i cancer och polyper i tjocktarmen, i bröstcancer, i lungcancer, i magcancer, i äggstockscancer cancer, vid mesoteliom, vid melanom, i sköldkörteltumörer vid leukemi och vid bröstcancer.
Terapi som påverkar cellproliferationshastigheten påverkar TK-värdena på motsvarande sätt. Även om de flesta studier inte visar detta, verkar det troligt att skillnader mellan prover från frisk vävnad och prover från tumörvävnad främst representerar förändringar i nivåerna av TK1, eftersom detta enzym är mycket starkare kopplat till cellproliferation än TK2.
En metod har utvecklats för specifik bestämning av TK2 i cellextrakt med användning av substratanalogen 5-Bromovinyl 2'-deoxiuridin.
Användningar av tymidinkinasbestämningar
Tumörmarkörer kan användas för följande ändamål:
- Screening antingen för specifika cancerformer eller generellt för malign tillväxt. Bred screening för alla eller de flesta typer av cancer föreslogs tidigt men har sedan dess visat sig inte vara ett realistiskt mål. Screening för specifika cancertyper eller lokaliseringar kräver en grad av specificitet och känslighet som för tumörmarkörer hittills endast har uppnåtts av PSA. Tymidinkinas når varken den kliniska känsligheten eller den kliniska specificiteten för att vara användbar för screeningsändamål, se dock Huang et al., Xiang et al. och Cao et al.
- Övervakning av canceröverlevande efter behandling, detektion av återkommande sjukdom är den vanligaste användningen av tumörmarkörer inklusive tymidinkinas, som används som standardmetod för att övervaka hematologiska störningar, särskilt lymfom, men som också studeras för att övervaka solida tumörer.
- Diagnos av specifika tumörtyper. De tumörtyper som är av intresse för tymidinkinas diagnostiseras med andra tekniker än mätning av tumörmarkörer.
- Bekräftelse av diagnos för att verifiera egenskaperna såsom storlek och aggressivitet hos en tumör och därigenom hjälpa till vid utvärderingen av ett lämpligt behandlingsschema har verifierats som en lämplig tillämpning av tymidinkinasbestämning för flera typer av tumörer. Tymidinkinas har bekräftats som ett värdefullt verktyg för att verifiera aggressiviteten hos både hematologiska tumörer (särskilt non-Hodgkins lymfom) och prostatakarcinom.
- Stadieindelning : tymidinkinas har föreslagits för inkludering i stadiekriterierna för non-Hodgkins lymfom
- Prognos : tymidinkinas har visats vara en viktig prognostisk parameter, särskilt vid hematologiska maligniteter (lymfom och leukemi).
- Verifiering av effekten av behandlingen är en viktig användning av tymidinkinas. Eftersom denna tumörmarkör reagerar på tumörens aktivitet snarare än på tumörmassan ger den en mycket tidig indikation på effekten av behandlingen.
- En följediagnostik används för att verifiera om behandlingen är lämplig för typen eller subtypen av tumör, särskilt inom personlig medicin . Den starka kopplingen av TK1-uttryck till cellcykeln ger ett speciellt skäl för att undersöka tymidinkinas som markör för effekt av hämmare till cyklinberoende kinaser . Dessa inhibitorföreningar utgör lovande nya cancerterapier. Cyklinberoende kinaser främjar övergång genom cellcykeln och cyklinberoende kinashämmare är avsedda att stoppa övergången till S-fasen av cellcykeln, där tymidinkinas syntetiseras. Serum-TK-aktivitet ingår därför nu som en biomarkör i kliniska prövningar av dessa inhibitorföreningar.
Se även
Vidare läsning
- O'Neill KL, Buckwalter M, Murray BK (2001). "Tymidinkinas: diagnostisk och prognostisk potential". Expert Rev. Mol. Diagn . 1 (4): 428–33. doi : 10.1586/14737159.1.4.428 . PMID 11901857 . S2CID 12790327 .
- Topolcan O, Holubec Jr L (2008). "Tymidinkinasens roll i cancersjukdomar". Expertutlåtande. Med. Diagn . 2 (2): 129–41. doi : 10.1517/17530059.2.2.129 . PMID 23485133 .
- Jagarlamudi KK, Shaw M (2018). "Tymidinkinas 1 som en tumörbiomarkör: tekniska framsteg erbjuder ny potential för en gammal biomarkör". Biomark. Med . 12 (9): 1035–48. doi : 10.2217/bmm-2018-0157 . PMID 30039979 .
externa länkar
- Tymidin+kinas vid US National Library of Medicine Medical Subject Headings (MeSH)