Titantetrabromid

|
|
|
|
| Namn | |
|---|---|
|
IUPAC-namn
Titan(IV)bromid
|
|
| Andra namn Titantetrabromid
|
|
| Identifierare | |
|
3D-modell ( JSmol )
|
|
| ECHA InfoCard | 100.029.259 |
| EG-nummer |
|
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Egenskaper | |
| TiBr 4 | |
| Molar massa | 367,483 g/mol |
| Utseende |
bruna kristaller hygroskopiska |
| Densitet | 3,25 g/cm 3 |
| Smältpunkt | 39 °C (102 °F; 312 K) |
| Kokpunkt | 230 °C (446 °F; 503 K) |
| hydrolyserar | |
| Löslighet i andra lösningsmedel | klorkolväten, bensen |
| Strukturera | |
| kubik, Pa3 , Z = 8 | |
| Tetraedrisk | |
| 0 D | |
| Faror | |
| Arbetsmiljö och hälsa (OHS/OSH): | |
|
Huvudsakliga faror
|
frätande |
| GHS- märkning : | |

|
|
| Fara | |
| H314 | |
| P260 , P264 , P280 , P301+P330+ P331 , P303+P361+P353 , P304+P340 , P305 +P351+P338 , P310 , P363 , P405 | |
| NFPA 704 (branddiamant) | |
| Flampunkt | Ej brandfarlig |
| Besläktade föreningar | |
|
Andra anjoner
|
Titan(IV)klorid Titan(IV)fluorid Titan(IV)jodid |
|
Besläktade föreningar
|
Titan(III)bromid |
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|
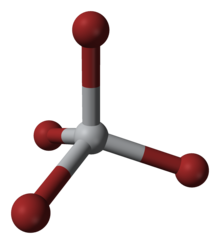
0 Titantetrabromid är den kemiska föreningen med formeln TiBr 4 . Det är den mest flyktiga övergångsmetallbromiden. Egenskaperna för TiBr 4 är ett genomsnitt av TiCl 4 och TiI 4 . Några nyckelegenskaper hos dessa fyrkoordinerade Ti(IV)-arter är deras höga Lewis-syra och deras höga löslighet i opolära organiska lösningsmedel. TiBr 4 är diamagnetisk, vilket återspeglar d- konfigurationen av metallcentrum.
Förberedelse och struktur
Detta fyra-koordinerade komplex antar en tetraedrisk geometri. Den kan framställas via flera metoder: (i) från grundämnena, (ii) via reaktionen av TiO2 med kol och brom (se Kroll-processen ), och (iii) genom behandling av TiCl4 med HBr .
Reaktioner
Titantetrabromid bildar addukter som TiBr 4 ( THF ) 2 och [TiBr 5 ] - . Med skrymmande donatorligander, såsom 2-metylpyridin (2-Mepy), bildas fem koordinerade addukter. TiBr 4 (2-MePy) är trigonal bipyramidal med pyridinen i ekvatorialplanet.
TiBr 4 har använts som en Lewis-syrakatalysator i organisk syntes .
Tetrabromiden och tetrakloriderna av titan reagerar och ger en statistisk blandning av de blandade tetrahaliderna, TiBr 4−x Cl x (x = 0-4). Mekanismen för denna omfördelningsreaktion är osäker. En föreslagen väg åberopar förmedlingen av dimerer .
Säkerhet
TiBr 4 hydrolyserar snabbt, potentiellt farligt, för att frigöra vätebromid , även känd som bromvätesyra.
