Romboid proteas
| Rhomboid | |||||||||
|---|---|---|---|---|---|---|---|---|---|
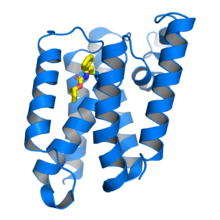
Escherichia coli rhomboid proteas GlpG i komplex med en betalaktaminhibitor (gul) bunden till den katalytiska serinresten . Från .
| |||||||||
| Identifierare | |||||||||
| Symbol | Romboid | ||||||||
| Pfam | PF01694 | ||||||||
| Pfam klan | CL0207 | ||||||||
| InterPro | IPR002610 | ||||||||
| MEROPS | S54 | ||||||||
| SCOP2 | 144092 / SCOPe / SUPFAM | ||||||||
| OPM superfamilj | 165 | ||||||||
| OPM-protein | 2ic8 | ||||||||
| |||||||||
De romboida proteaserna är en familj av enzymer som finns i nästan alla arter. De är proteaser : de skär polypeptidkedjan av andra proteiner. Denna proteolytiska klyvning är irreversibel i celler och en viktig typ av cellulär reglering. Även om proteaser är en av de tidigaste och bäst studerade klassen av enzymer, tillhör romboider en mycket mer nyligen upptäckt typ: intramembranproteaserna . Det som är unikt med intramembranproteaser är att deras aktiva ställen är begravda i lipiddubbelskiktet av cellmembran , och de klyver andra transmembranproteiner inom sina transmembrandomäner . Cirka 30 % av alla proteiner har transmembrana domäner och deras reglerade bearbetning har ofta stora biologiska konsekvenser. Följaktligen reglerar romboider många viktiga cellulära processer och kan vara involverade i ett brett spektrum av mänskliga sjukdomar.
Intramembranproteaser
Romboider är serinproteaser inom membranet . De andra typerna av intramembranproteaser är aspartyl- respektive metalloproteaser . Familjen preseniliner och signalpeptidpeptidasliknande , som är intramembrana aspartylproteaser, klyver substrat som inkluderar Notch- receptorn och amyloidprekursorproteinet , som är inblandat i Alzheimers sjukdom . Plats -2-proteasfamiljen , som är intramembranmetalloproteaser, reglerar bland annat kolesterolbiosyntes och stressresponser hos bakterier . De olika intramembranproteasfamiljerna är evolutionärt och mekanistiskt orelaterade, men det finns tydliga gemensamma funktionella teman som länkar dem. Romboider är kanske den bäst karaktäriserade klassen.
Historia
Romboider fick först sitt namn efter en mutation i fruktflugan Drosophila , upptäckt i en berömd genetisk screening som ledde till ett Nobelpris till Christiane Nüsslein-Volhard och Eric Wieschaus . På den skärmen hittade de ett antal mutanter med liknande fenotyper: "spetsiga" embryonala huvudskelett. De namngav dem var och en med ett namn med spetsiga tema – en var romboid. Först märktes detta eftersom en mutation störde utvecklingen, genetisk analys visade senare att denna grupp av gener var medlemmar i signalvägen för epidermal tillväxtfaktor (EGF) receptor, och att romboid behövdes för att generera signalen som aktiverar EGF-receptorn. Den molekylära funktionen hos rhomboid tog lite längre tid att reda ut men en kombination av genetik och molekylära tekniker ledde till upptäckten att Drosophila rhomboid och andra medlemmar av familjen var de första kända intramembranserinproteaserna.
Fungera
Romboider upptäcktes först som proteaser som reglerar EGF-receptorsignalering i Drosophila . Genom att frigöra den extracellulära domänen av tillväxtfaktorn Spitz, från dess transmembrana prekursor, triggar romboid signalering. Sedan dess har många andra viktiga biologiska funktioner föreslagits.
- Senare visade sig Drosophilas Rhomboid-1 reglera sömnen, genom en ny funktion av en redan upptäckt mekanism.
- Även om det är mindre väl etablerat än i Drosophila , finns det vissa bevis för att romboider kan delta i tillväxtfaktorsignalering hos däggdjur, inklusive människor. De har också varit inblandade i efrinsignalering , klyvningen av det antikoagulerande proteinet trombomodulin och sårläkning .
- Alla eukaryoter har en mitokondriell romboid. I jäst har detta visat sig kontrollera mitokondriell funktion och morfologi genom att reglera membranfusion via klyvningen av ett dynaminliknande GTPas som kallas Mgm1p, ortologen av humant OPA1 . I Drosophila reglerar den mitokondriella romboiden (Rhomboid-7) också mitokondriell membranfusion. Drosophila Opa1 och Rhomboid-7 verkar ha samma förhållande som i jäst. Även hos däggdjur är mitokondriell funktion störd i mutanter av PARL , den mitokondriella romboiden, men omfånget av funktioner är mer komplext. PARL reglerar ombyggnaden av mitokondriella cristae , är inblandad i celldöd och metabolism , och det finns allt fler bevis på en viktig roll i Parkinsons sjukdom ;
- Apicomplexan parasiter (inklusive Plasmodium , medlet som orsakar malaria , och Toxoplasma ) romboider används för att omplacera mellan bindning till en målcell och inträde, och de flesta mikronem -producerade adhesiner frisätts från mikronemen av romboider. Romboider har också varit inblandade i patogeniciteten hos andra parasiter. Specifikt i Toxoplasma hämmar vissa serpiner romboider.
- En romboid i den gramnegativa bakterien Providencia stuartii krävs för funktionen av TAT-maskineriet (twin-arginine protein translocation).
- Romboider kontrollerar EGF-receptorsignalering i Caenorhabditis elegans som i Drosophila .
Strukturera
Romboider var de första intramembranproteaserna för vilka en högupplöst kristallstruktur löstes. Dessa strukturer bekräftade förutsägelser att romboider har en kärna av sex transmembrandomäner och att det katalytiska stället beror på en serin- och histidinkatalytisk dyad. Strukturerna förklarade också hur en proteolytisk reaktion, som kräver vattenmolekyler, kan inträffa i den hydrofoba miljön i ett lipiddubbelskikt: ett av de centrala mysterierna med intramembranproteaser. Det aktiva stället för romboid proteas är i en hydrofil fördjupning, i princip tillgänglig för vatten från bulklösningen. Emellertid har det föreslagits att det kan finnas en hjälpmekanism för att underlätta åtkomst av vattenmolekyler till den katalytiska dyaden vid botten av det aktiva stället för att säkerställa katalytisk effektivitet.
Det aktiva stället för romboid proteas skyddas lateralt från lipiddubbelskiktet av dess sex konstituerande transmembranspiraler, vilket tyder på att substrattillgången till det romboida aktiva stället regleras. Ett område med osäkerhet har varit vägen för substrattillträde . Substrat föreslogs ursprungligen att komma in mellan transmembransegment (TMS) 1 och 3, men nuvarande bevis stöder starkt en alternativ åtkomstpunkt, mellan TMS 2 och 5. Denna uppfattning stöds också av det faktum att mutationer i TMS 5 endast har en marginell effekt på den termodynamiska stabiliteten hos romboid, till skillnad från andra regioner av molekylen. Helt nyligen bekräftar och utökar den första samkristallstrukturen av ett intramembranproteas - Escherichia colis version av det romboida proteaset GlpG - och en substrathärledd peptid bunden i det aktiva stället denna substrattillgångsmodell och ger implikationer för mekanismen. andra rhomboid-superfamiljproteiner. [ Citat behövs ] E. colis GlpG är ovanligt för sin låga enzym/ substratbindningsaffinitet . Detaljerna för hur ett substrat-TMS kan kännas igen av romboid är dock fortfarande oklara. Vissa författare föreslår att substratåtkomst innebär en stor lateral förskjutningsrörelse av TMS 5 för att öppna upp kärnan av romboid. Andra rapporter tyder istället på att stora laterala rörelser av TMS 5 inte krävs, och föreslår att ytan på TMS 2 och 5 snarare fungerar som en "intramembranexosit" som medierar igenkännandet av substrat-TMS. Den romboida ortologen i D. suzukii är Dsuz\DS10_00004507.
Enzymatisk specificitet
Romboider klyver inte alla transmembrandomäner. Faktum är att de är mycket specifika, med ett begränsat antal substrat. De flesta naturliga rhomboida substrat som är kända hittills är typ 1 enkel transmembrandomänproteiner, med sina aminoterminaler i det luminala/extracellulära utrymmet. Nyligen genomförda studier antydde dock att membranprotein av typ 2 (dvs. med motsatt topologi: aminoterminalen är cytoplasmatisk), eller till och med flerpassagemembranproteiner skulle kunna fungera som romboida substrat. Rumboiders specificitet ligger till grund för deras förmåga att kontrollera funktioner i ett brett spektrum av biologiska processer och i sin tur förstå vad som gör en viss transmembrandomän till ett romboid substrat kan kasta ljus över romboid funktion i olika sammanhang.
Inledande arbete indikerade att romboider känner igen instabilitet hos den transmembrana alfa-helixen vid platsen för klyvning som den huvudsakliga substratdeterminanten. På senare tid har det visat sig att romboida substrat definieras av två separerbara element: transmembrandomänen och ett primärt sekvensmotiv i eller omedelbart intill den. Detta igenkänningsmotiv styr var substratet klyvs, vilket kan förekomma antingen inom, eller strax utanför, transmembrandomänen, i juxtamembranområdet. I det förra fallet är helixdestabiliserande rester nedströms i substrat-TMS också nödvändiga för effektiv klyvning. En detaljerad enzymkinetikanalys har faktiskt visat att igenkänningsmotivets interaktioner med det romboida aktiva stället bestämmer k- caten för substratklyvning. Principerna för substrat-TMS-igenkänning av romboid är fortfarande dåligt förstådda, men många bevis visar att romboider (och kanske även andra intramembranproteaser ) på något sätt känner igen den strukturella flexibiliteten eller dynamiken hos transmembrandomänen hos deras substrat. Full förståelse av de involverade biofysikaliska och strukturella principerna kommer att kräva strukturell karakterisering av komplexet av romboid med det fulla transmembransubstratet. Som ett första steg mot detta mål förklarar en nyligen samkristallstruktur av enzymet i komplex med en substrathärledd peptid innehållande mekanismbaserad hämmare de observerade igenkänningsmotivsekvenspreferenserna i romboida substrat strukturellt och ger ett betydande framsteg i den nuvarande förståelse av rhomboid specificitet och mekanism av rhomboid-familjen proteiner.
I vissa gramnegativa bakterier, inklusive Shewanella och Vibrio , finns upp till tretton proteiner med GlyGly-CTERM, en C-terminal homologidomän som består av ett glycinrikt motiv, en mycket hydrofob transmembranhelix och ett kluster av basiska rester. Denna domän verkar vara igenkänningssekvensen för rhombosortas, en gren av rhomboid proteasfamiljen begränsad till bara de bakterier med GlyGly-CTERM-domänen.
Medicinsk betydelse
Mångfalden av biologiska funktioner som redan är kända för att bero på romboider återspeglas i bevis på att romboider spelar en roll i en mängd olika sjukdomar parasitinfektion . inklusive cancer , och diabetes [ citat behövs ] Det är dock viktigt att notera att det ännu inte finns något fall där en exakt medicinsk betydelse är helt validerad.
Inga läkemedel som modulerar romboidaktivitet har ännu rapporterats, även om en nyligen genomförd studie har identifierat små molekylära, mekanismbaserade hämmare som kan ge en grund för framtida läkemedelsutveckling.
Den romboidliknande familjen
Rhomboida proteaser verkar vara konserverade i alla eukaryoter och de allra flesta prokaryoter . Bioinformatisk analys visar att vissa medlemmar av romboidfamiljen saknar de aminosyrarester som är nödvändiga för proteolys, vilket antyder att de inte kan klyva substrat. Dessa "pseudoproteaser" inkluderar en underfamilj som har fått namnet iRhoms (även känd som RHBDF1 och RHBDF2 ). iRhoms kan främja den ER-associerade nedbrytningen (ERAD) av EGF- receptorligander i Drosophila , vilket ger en mekanism för att reglera EGF-receptoraktivitet i hjärnan. Detta innebär att den grundläggande cellulära kvalitetskontrollmekanismen utnyttjas av flercelliga organismer för att reglera signalering mellan celler. Hos möss är iRhoms viktiga handelsföreträdare som krävs för ER-exporten av ADAM17 /TACE och dess mognad. iRhoms krävs alltså för TNF-alfa- och EGF- receptorsignaleringen, vilket gör dem medicinskt mycket attraktiva.
Fylogenetisk analys indikerar att romboider i själva verket är medlemmar av en större romboidliknande superfamilj eller klan, som inkluderar derlinproteinerna, som också är involverade i ERAD.
Kinetoplastider har en ovanligt liten rhomboid familjrepertoar, i Trypanosoma brucei XP 001561764 och XP 001561544, och i T. cruzi XP 805971, XP 802860 och XP 821055.
Olika proteiner från rhomboidfamiljen är avgörande för Toxoplasma gondii virulens och motilitet , inklusive TgMIC2, TgMIC6, olika AMA1-varianter inklusive TgAMA1, TgROM1, TgROM4 och TgROM5.
Trypanosommitokondrier har TimRhom I och TimRhom II (två romboida familjemedlemmar med proteolytisk funktion inaktiverad) i sina presekvenstranslokaser. Svårigheten att hitta större likhet med antingen eukaryota eller bakteriella släktingar kan innebära att dessa kom som en del av den ursprungliga mitokondriella stamfadern. Romboid-släktingar kan vara membrantransportproteiner i ERAD- och SELMA-systemen.
iRhoms
iRhoms är romboidliknande proteiner, men är inte proteaser. Som med romboider upptäcktes de först i Drosophilae . I motsats till romboider hämmar iRhoms emellertid EGFr-signalering. Knockout-möss för iRhom2 har allvarliga immunförsvar.
Vidare läsning
externa länkar
- "Sammanfattning för familj S54 (Rhomboid familj)" . MEROPS .
- "EC 3.4.21.105" . Expasy . SIB Swiss Institute of Bioinformatics.