Faktor IX
| F9 | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identifierare | |||||||||||||||||||||||||||||||||||||||||||||||
| , F9 p22, FIX, HEMB, P19, PTC, THPH8, koagulationsfaktor IX, blodkoagulationsfaktor IX, julfaktor | |||||||||||||||||||||||||||||||||||||||||||||||
| Externa ID :n | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
Faktor IX (eller julfaktor ) ( EC 3.4.21.22 ) är en av serinproteaserna i koagulationssystemet ; det tillhör peptidasfamiljen S1. Brist på detta protein orsakar hemofili B. Det upptäcktes 1952 efter att en ung pojke vid namn Stephen Christmas befanns sakna denna exakta faktor, vilket ledde till hemofili .
Koagulationsfaktor IX finns på Världshälsoorganisationens lista över nödvändiga läkemedel .
Fysiologi

Faktor IX produceras som en zymogen , en inaktiv prekursor. Den bearbetas för att avlägsna signalpeptiden , glykosyleras och klyvs sedan av faktor XIa (av kontaktvägen) eller faktor VIIa (av vävnadsfaktorvägen) för att producera en tvåkedjig form, där kedjorna är sammanlänkade med en disulfidbrygga . När den aktiveras till faktor IXa , i närvaro av Ca2 + , membranfosfolipider och en faktor VIII-kofaktor, hydrolyserar den en arginin - isoleucinbindning i faktor X för att bilda faktor Xa.
Faktor IX hämmas av antitrombin .
Faktor IX-uttryck ökar med åldern hos människor och möss. I musmodeller har mutationer inom promotorregionen av faktor IX en åldersberoende fenotyp.
Domänarkitektur
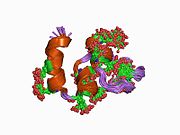
Faktorerna VII , IX och X spelar alla nyckelroller vid blodkoagulation och delar också en gemensam domänarkitektur. Faktor IX-proteinet är sammansatt av fyra proteindomäner : Gla-domänen , två tandemkopior av EGF-domänen och en C-terminal trypsinliknande peptidasdomän som utför den katalytiska klyvningen.
Den N-terminala EGF-domänen har visats vara åtminstone delvis ansvarig för bindning av vävnadsfaktor . Wilkinson et al . dra slutsatsen att resterna 88 till 109 av den andra EGF-domänen förmedlar bindning till blodplättar och sammansättning av det faktor X-aktiverande komplexet.
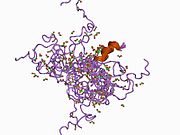
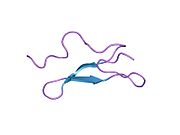
Strukturerna för alla fyra domänerna har lösts. En struktur av de två EGF-domänerna och den trypsinliknande domänen bestämdes för grisproteinet. Strukturen av Gla-domänen, som är ansvarig för Ca(II)-beroende fosfolipidbindning, bestämdes också med NMR .
Flera strukturer av "superaktiva" mutanter har lösts, vilket avslöjar karaktären av faktor IX-aktivering av andra proteiner i koaguleringskaskaden.
Genetik
Genen för faktor IX finns på X-kromosomen (Xq27.1-q27.2) och är därför X-länkad recessiv : mutationer i denna gen påverkar män mycket oftare än kvinnor. Minst 534 sjukdomsorsakande mutationer i denna gen har upptäckts. F9-genen klonades första gången 1982 av Kotoku Kurachi och Earl Davie .
Polly , ett transgent klonat Poll Dorset -får som bär genen för faktor IX, producerades av Dr Ian Wilmut vid Roslin Institute 1997.
Roll i sjukdom
Brist på faktor IX orsakar julsjuka ( blödarsjuka B) . Över 3000 varianter av faktor IX har beskrivits, som påverkar 73% av de 461 resterna; vissa orsakar inga symtom, men många leder till en betydande blödningsrubbning. Den ursprungliga julsjukdomsmutationen identifierades genom sekvensering av julens DNA, vilket avslöjade en mutation som ändrade ett cystein till ett serin. Rekombinant faktor IX används för att behandla julsjukan. Formuleringarna inkluderar:
- nonacog alfa (varumärke BeneFix)
- albutrepenonacog alfa (varumärke Idelvion)
- eftrenonacog alfa (varumärke Alprolix)
- nonacog beta pegol (varumärke Refixia)
Vissa sällsynta mutationer av faktor IX resulterar i förhöjd koaguleringsaktivitet och kan resultera i koaguleringssjukdomar, såsom djup ventrombos . Denna vinst av funktionsmutation gör proteinet hyperfunktionellt och är associerat med familjär tidig trombofili.
Faktor IX-brist behandlas genom injektion av renad faktor IX producerad genom kloning i olika djur- eller djurcellsvektorer. Tranexamsyra kan vara av värde hos patienter som genomgår operation som har ärftlig faktor IX-brist för att minska den perioperativa risken för blödning.
En lista över alla mutationer i faktor IX sammanställs och underhålls av EAHAD.
Koagulationsfaktor IX finns på Världshälsoorganisationens lista över nödvändiga läkemedel .
Vidare läsning
- Davie EW, Fujikawa K (1975). "Grundläggande mekanismer i blodkoagulation". Årlig översyn av biokemi . 44 : 799-829. doi : 10.1146/annurev.bi.44.070175.004055 . PMID 237463 .
- Sommer SS (juli 1992). "Bedöma det underliggande mönstret av mänskliga könscellsmutationer: lärdomar från faktor IX-genen". FASEB Journal . 6 (10): 2767–74. doi : 10.1096/fasebj.6.10.1634040 . PMID 1634040 . S2CID 15211597 .
- Lenting PJ, van Mourik JA, Mertens K (dec 1998). "Livscykeln för koagulationsfaktor VIII med tanke på dess struktur och funktion". Blod . 92 (11): 3983–96. doi : 10.1182/blod.V92.11.3983 . PMID 9834200 .
- Lowe GD (dec 2001). "Faktor IX och trombos" (PDF) . British Journal of Hematology . 115 (3): 507–13. doi : 10.1046/j.1365-2141.2001.03186.x . PMID 11736930 . S2CID 44650866 .
- O'Connell NM (juni 2003). "Faktor XI-brist - från molekylär genetik till klinisk hantering". Blodkoagulation och fibrinolys . 14 Suppl 1: S59-64. doi : 10.1097/00001721-200306001-00014 . PMID 14567539 .
- Du X (maj 2007). "Signalering och reglering av blodplättsglykoproteinet Ib-IX-V-komplex". Aktuell åsikt i hematologi . 14 (3): 262–9. doi : 10.1097/MOH.0b013e3280dce51a . PMID 17414217 . S2CID 39904506 .
externa länkar
- "Koagulationsfaktor IX (rekombinant), Fc-fusionsprotein" . Läkemedelsinformationsportal . US National Library of Medicine.
- "Eftrenonacog alfa" . Läkemedelsinformationsportal . US National Library of Medicine.
- "Nonacog alfa" . Läkemedelsinformationsportal . US National Library of Medicine.
- "Albutrepenonacog alfa" . Läkemedelsinformationsportal . US National Library of Medicine.
- "Nonacog beta pegol" . Läkemedelsinformationsportal . US National Library of Medicine.
- Översikt över all strukturell information tillgänglig i PDB för UniProt : P00740 (koagulationsfaktor IX) i PDBe-KB .
- GeneReviews/NCBI/NIH/UW-inlägg om hemofili B
- MEROPS onlinedatabas för peptidaser och deras hämmare : S01.214