Pyruvat, fosfatdikinas
| pyruvat, fosfatdikinas | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifierare | |||||||||
| EG nr. | 2.7.9.1 | ||||||||
| CAS-nr. | 9027-40-1 | ||||||||
| Databaser | |||||||||
| IntEnz | IntEnz-vy | ||||||||
| BRENDA | BRENDA inträde | ||||||||
| ExPASy | NiceZyme-vy | ||||||||
| KEGG | KEGG inträde | ||||||||
| MetaCyc | Metabolisk väg | ||||||||
| PRIAM | profil | ||||||||
| PDB- strukturer | RCSB PDB PDBe PDB summa | ||||||||
| Genontologi | AmiGO / QuickGO | ||||||||
| |||||||||
| Pyruvat, fosfatdikinas | |
|---|---|
 Pyruvatfosfatdikinasdimer, Clostridium symbiosum ()
| |
| Identifierare | |
| Symbol | PPDK |
| InterPro | IPR010121 |
| Se domäner nedan. | |
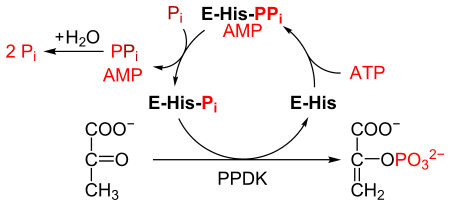
Pyruvat, fosfatdikinas eller PPDK ( EC 2.7.9.1 ) är ett enzym i familjen transferaser som katalyserar den kemiska reaktionen
- ATP + pyruvat + fosfat AMP + fosfoenolpyruvat + difosfat
Detta enzym har studerats främst i växter, men det har också studerats i vissa bakterier. Det är ett nyckelenzym i glukoneogenes och fotosyntes som är ansvarigt för att vända reaktionen som utförs av pyruvatkinas i Embden-Meyerhof-Parnas glykolys. Det ska inte förväxlas med pyruvat, vattendikinas .
Det tillhör familjen transferaser , för att vara specifik, de som överför fosforinnehållande grupper ( fosfotransferaser ) med parade acceptorer ( dikinaser ). Detta enzym deltar i pyruvatmetabolism och kolfixering .
Nomenklatur
Det systematiska namnet på denna enzymklass är ATP:pyruvat, fosfatfosfotransferas. Andra namn i vanlig användning inkluderar pyruvat, ortofosfatdikinas, pyruvatfosfatdikinas (fosforylerande), pyruvatfosfatdikinas, pyruvat-oorganiskt fosfatdikinas, pyruvatfosfatdikinas, pyruvat-fosfatdikinas, pyruvat-fosfat-dikinas, pyruvat-fosfat-dikinas pyruvic-fosfatligas, pyruvat Pi-dikinas och PPDK.
Reaktionsmekanism
PPDK katalyserar omvandlingen av pyruvat till fosfoenolpyruvat (PEP), förbrukar 1 molekyl ATP och producerar en molekyl AMP i processen. Mekanismen består av 3 reversibla reaktioner :
- Enzymet PPDK binder till ATP, för att producera AMP och en difosforylerad PPDK.
- Den difosforylerade PPDK binder till oorganiskt fosfat och producerar difosfat och (mono)fosforylerat PPDK.
- Fosforylerat PPDK binder till pyruvat, producerar fosfoenolpyruvat och regenererar PPDK.
Reaktionen liknar reaktionen som katalyseras av pyruvatkinas , som också omvandlar pyruvat till PEP. Emellertid katalyserar pyruvatkinas en irreversibel reaktion och förbrukar inte ATP. Däremot katalyserar PPDK en reversibel reaktion och förbrukar 1 molekyl ATP för varje omvandlad pyruvatmolekyl.
För närvarande är detaljerna för varje mekanistiskt steg okända
Strukturera
I sin aktiva form är PPDK en homotetramer med subenheter omkring 95 kDa
Det finns två olika reaktionscentra med cirka 45 Ångströms mellanrum, i vilka olika substrat binder. Nukleotidbindningsstället (ATP) är på N-terminalen , har 240 aminosyror och ett karakteristiskt ATP-grepp . Pyruvat/PEP-bindningsstället är på C-terminalen , har 340 aminosyror och en α/β-fasveck. Det finns också en central domän, som innehåller His 455, den primära rest som är ansvarig för katalys. His455 är fosforylacceptorn eller donatorresten. Enzymets struktur tyder på att His455-armen genomgår en vridningsrörelse för att skjuta en fosforylgrupp mellan de två reaktionscentra. Under denna svängning roterar den centrala domänen minst 92 grader och översätter 0,5 Ångström.
Studier av kristallstrukturer av PPDK visar att den centrala domänen är belägen i olika närhet till de två andra domänerna beroende på källan till enzymet. I majs är det närmare C-terminalen, medan det i Clostridium symbiosum är närmare N-terminalen.
Forskning har visat att PPDK-bindningsmekanismerna liknar den för D-Ala-D-Ala-ligas och pyruvatkinas . I synnerhet är PPDK mycket likt pyruvatkinas, som också katalyserar omvandlingen av pyruvat till fosfoenolpyruvat; men det gör det utan en fosforylerad enzymmellanprodukt. Även om deras aminosyrasekvenser är olika, bevaras rester som är nyckeln till katalys i båda enzymerna. Punktmutagenesexperiment har visat att katalytiska rester inkluderar Arg 561, Arg 617, Glu 745, Asn 768 och Cys 831 (numrering i förhållande till C, symbiosumproteinet , ).
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Biologisk funktion och evolution
PPDK används i C4-vägen för att förbättra effektiviteten av koldioxidfixering . I miljöer där det finns mycket ljus begränsas fotosynteshastigheten i växter av hastigheten för upptag av koldioxid (CO 2 ). Detta kan förbättras genom att använda en serie kemiska reaktioner för att transportera CO 2 från mesofyllceller (som är belägna på utsidan av ett blad) till att bunta höljeceller (som finns inuti cellerna). PPDK omvandlar pyruvat till PEP, som reagerar med CO 2 för att producera oxaloacetat . När CO 2 frigörs i buntmantelcellerna, regenereras pyruvat och cykeln fortsätter.
Även om reaktionen som katalyseras av PPDK är reversibel, gynnas PEP som produkt under biologiska förhållanden. Detta beror på det grundläggande pH-värdet i stroma , där reaktionen sker, samt höga koncentrationer av adenylatkinas och pyrofosfatas . Eftersom dessa två enzymer katalyserar exergoniska reaktioner som involverar AMP respektive disfosfat, driver de den PPDK-katalyserade reaktionen framåt. Eftersom PPDK förbrukar ATP är C4-vägen ogynnsam för växter i miljöer med liten tillgång till ljus, eftersom de inte kan producera stora mängder ATP.
PPDK är mycket rikligt förekommande i C4-blad, som utgör upp till 10% av det totala proteinet . Forskning har visat att enzymet är ungefär 96% identiskt i olika växtarter . Hybridiseringsexperiment visade att de genetiska skillnaderna korrelerar med i vilken utsträckning växterna utför C4-vägen - de ovanliga sekvenserna finns i växter som också uppvisar C3-egenskaper. PPDK finns också i små mängder i C3-växter. Evolutionshistoria antyder att det en gång hade en roll i glykolys som liknande pyruvatkinas och så småningom utvecklades till C4-vägen.
Förutom växter finns PPDK även i den parasitära ameoba Entamoeba histolytica () och bakterierna Clostridium symbiosum (; samt andra bakterier). I dessa två organismer fungerar PPDK på samma sätt som (och ibland istället för) pyruvatkinas, vilket katalyserar reaktionen i den ATP-producerande riktningen som en del av glykolysen. Inhibitorer för Entamoeba PPDK har föreslagits som amebicider mot denna organism.
förordning
Växt-PPDK regleras av pyruvat, fosfatdikinas regulatoriskt protein (PDRP). När nivåerna av ljus är höga, defosforylerar PDRP Thr 456 på PPDK med hjälp av AMP , vilket aktiverar enzymet. PDRP deaktiverar PPDK genom att fosforylera samma treoninrest med difosfat . PDRP är en unik regulator eftersom den katalyserar både aktivering och deaktivering av PPDK, genom två olika mekanismer.
Forskning på majs PPDK tyder på att introner , terminatorsekvenser och kanske andra förstärkarsekvenser samverkar för att öka nivån av funktionellt och stabilt mRNA . PPDK cDNA uttrycktes endast obetydligt i transgent ris , jämfört med intakt DNA som såg signifikant uttryck.
Strukturstudier
Från och med början av 2018 har 14 strukturer lösts för denna klass av enzymer, med PDB - accessionskoderna 1DIK , 1GGO , 1H6Z , 1JDE , 1KBL , 1KC7 , 1VBG , 1VBH , 2DIK , 5JVJ , 5JJVN , LU .
Vidare läsning
- Hatch MD, Slack CR (januari 1968). "Ett nytt enzym för omvandlingen av pyruvat och fosfopyruvat och dess roll i C4-dikarboxylsyravägen för fotosyntes" . The Biochemical Journal . 106 (1): 141–6. doi : 10.1042/bj1060141 . PMC 1198479 . PMID 4305612 .
- Reeves RE (juni 1968). "Ett nytt enzym med den glykolytiska funktionen av pyruvatkinas" . Journal of Biological Chemistry . 243 (11): 3202–4. doi : 10.1016/S0021-9258(18)93395-8 . PMID 4297474 .
- Reeves RE (november 1971). "Pyruvat, fosfatdikinas från Bacteroides symbiosus" . The Biochemical Journal . 125 (2): 531–9. doi : 10.1042/bj1250531 . PMC 1178089 . PMID 5144757 .
- Reeves RE, Menzies RA, Hsu DS (oktober 1968). "Pyruvat-fosfat-dikinasreaktionen. Fosfatets öde och jämvikten" . Journal of Biological Chemistry . 243 (20): 5486–91. doi : 10.1016/S0021-9258(18)91972-1 . PMID 4302788 .