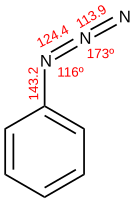Organisk azid
En organisk azid är en organisk förening som innehåller en –N3 funktionell azidgrupp ( ) . På grund av de faror som är förknippade med deras användning används få azider kommersiellt även om de uppvisar intressant reaktivitet för forskare. Lågmolekylära azider anses vara särskilt farliga och undviks . I forskningslaboratoriet är azider prekursorer till aminer . De är också populära för sitt deltagande i " klickreaktionen " och i Staudinger ligering . Dessa två reaktioner är i allmänhet ganska tillförlitliga och lånar sig till kombinatorisk kemi .
Historia
Fenylazid ("diazoamidobensol"), framställdes 1864 av Peter Griess genom reaktion mellan ammoniak och fenyldiazonium . På 1890-talet Theodor Curtius , som hade upptäckt hydrazoic acid ( HN 3 ), omarrangemanget av acylazider till isocyanater som senare kallades Curtius-omlagringen . Rolf Huisgen beskrev den eponyma 1,3-dipolära cykloadditionen .
Intresset för azider bland organiska kemister har varit relativt blygsamt på grund av den rapporterade instabiliteten hos dessa föreningar. Situationen har förändrats dramatiskt med upptäckten av Sharpless et al. av Cu-katalyserade (3+2)-cykloadditioner mellan organiska azider och terminala alkyner. Azido- och alkyngrupperna är " bioortogonala ", vilket betyder att de inte interagerar med levande system, och samtidigt genomgår de en imponerande snabb och selektiv koppling. Denna typ av formell 1,3-dipolär cykloaddition blev det mest kända exemplet på så kallad " klickkemi " (kanske den enda som en icke-specialist känner till), och området för organiska azider exploderade.
Förberedelse
Det finns otaliga metoder, som oftast använder förformade azidinnehållande reagens.
Alkylazider
Genom halogenidförskjutning
Som en pseudohalid ersätter azid i allmänhet många lämnande grupper, t.ex. Br − , I − , Ts O − , sulfonat och andra för att ge azidoföreningen. Azidkällan är oftast natriumazid ( NaN 3 ), även om litiumazid ( LiN 3 ) har påvisats.
Från alkoholer
Alifatiska alkoholer ger azider via en variant av Mitsunobu-reaktionen , med användning av hydrazoic acid . Hydraziner kan också bilda azider genom reaktion med natriumnitrit : Alkoholer kan omvandlas till azider i ett steg med 2-azido-1,3-dimetylimidazoliniumhexafluorfosfat (ADMP) eller under Mitsunobu-förhållanden med difenylfosforylazid (DPPA).
Från epoxider och aziridiner
Trimetylsilylazid ( CH3 ) 3SiN3 modifieringar kända och tributyltennazid alla ( CH3CH2CH2CH2 ) 3SnN3 . av reaktionen är också , inklusive har använts enantioselektiva Aminoazider är tillgängliga genom epoxid- respektive aziridinringklyvning.
Från aminer
Azo-överföringsföreningarna, trifluormetansulfonylazid och imidazol-1-sulfonylazid reagerar med aminer för att ge motsvarande azider. Diazoöverföring till aminer med användning av trifluormetansulfonylazid ( Tf N 3 ) och Tosylazid ( Ts N 3 ) har rapporterats.
Hydroazidering
Hydroazidering av alkener har visats
Arylazider
Arylazider kan framställas genom att det lämpliga diazoniumsaltet ersätts med natriumazid eller trimetylsilylazid . Nukleofil aromatisk substitution är också möjlig, även med klorider . Aniliner och aromatiska hydraziner genomgår diazotering , liksom alkylaminer och hydraziner .
- PhNHNH 2 + NaNO 2 → PhN 3 [ förtydligande behövs ]
Acylazider
Alkyl- eller arylacylklorider reagerar med natriumazid i vattenlösning för att ge acylazider , som ger isocyanater i Curtius-omlagringen .
Dutt–Wormall reaktion
En klassisk metod för syntes av azider är Dutt-Wormall-reaktionen där ett diazoniumsalt reagerar med en sulfonamid först till ett diazoaminosulfinat och sedan vid hydrolys aziden och en sulfinsyra .
Reaktioner
Organiska azider deltar i användbara organiska reaktioner . Det terminala kvävet är svagt nukleofilt. Generellt attackerar nukleofiler aziden vid det terminala kvävet N y , medan elektrofiler reagerar vid den inre atomen N α . Azider extruderar lätt diatomiskt kväve , en tendens som utnyttjas i många reaktioner som Staudinger-ligationen eller Curtius-omläggningen .
Azider kan reduceras till aminer genom hydrogenolys eller med en fosfin (t.ex. trifenylfosfin ) i Staudinger-reaktionen . Denna reaktion tillåter azider att fungera som skyddade -NH2- syntoner , vilket illustreras av syntesen av 1,1,1-tris(aminometyl)etan :
- 3H2 + CH3C ( CH2N3 ) 3 → CH3C ( CH2NH2 ) 3 + 3N2 _ _ _ _ _
I azid alkyn Huisgen cykloaddition , reagerar organiska azider som 1,3-dipoler , reagerar med alkyner för att ge substituerade 1,2,3-triazoler .
Vissa azidreaktioner visas i följande schema. Den mest kända är förmodligen reaktionen med fosfiner , som leder till iminofosforaner 22; dessa kan hydrolyseras till primära aminer 23 ( Staudinger-reaktionen ), reagera med karbonylföreningar för att ge iminer 24 (aza-Wittig-reaktionen), eller genomgå andra transformationer. Termisk nedbrytning av azider ger nitrener, som deltar i en mängd olika reaktioner; vinylazider 19 sönderdelas till 2H-aziriner 20. Alkylazider med låg kvävehalt (( n C + n O) / n N ≥ 3) är relativt stabila och sönderdelas endast över ca. 175°C.
Direkt fotokemisk nedbrytning av alkylazider leder nästan uteslutande till iminer (t.ex. 25 och 26). Det föreslås att azidgruppen befordras till det singlettexciterade tillståndet och sedan genomgår en samordnad omarrangemang utan förmedling av nitrener. Närvaron av triplettsensibilisatorer kan emellertid förändra reaktionsmekanismen och resultera i bildning av triplettnitrener. De sistnämnda observerades direkt med ESR-spektroskopi vid -269 ° C samt antogs i vissa fotolyser. Triplettmetylnitren är 31 kJ/mol mer stabil än sin singlettform, och är därför med största sannolikhet grundtillståndet.
(3+2)-cykloadditionen av azider till dubbel- eller trippelbindningar är en av de mest använda cykloadditionerna inom organisk kemi och ger triazoliner (t.ex. 17) respektive triazoler . Den okatalyserade reaktionen är en samordnad pericyklisk process , i vilken konfigurationen av alkenkomponenten överförs till triazolinprodukten. Woodward-Hoffmann valören är [π4s+π2s] och reaktionen är symmetritillåten. Enligt Sustmann är detta en cykloaddition av typ II, vilket innebär att de två HOMO:erna och de två LUMO:erna har jämförbara energier, och därmed kan både elektronbortdragande och elektrondonerande substituenter leda till en ökning av reaktionshastigheten. Reaktionen är i allmänhet fri från betydande lösningsmedelseffekter eftersom både reaktanterna och övergångstillståndet (TS) är opolära.
En annan vanlig azid är tosylazid här i reaktion med norbornadien i en kväveinsättningsreaktion:
Ansökningar
Vissa azider är värdefulla som bioortogonala kemiska reportrar , molekyler som kan "klickas" för att se den metaboliska vägen den har tagit i ett levande system.
Det antivirala läkemedlet zidovudin (AZT) innehåller en azidogrupp.
Säkerhet
Vissa organiska azider klassificeras som mycket explosiva och giftiga.
Ytterligare källor
- Patai, Saul, red. (1971-01-01). Azidogruppen (1971) . Chichester, Storbritannien: John Wiley & Sons, Ltd. sid. 626. doi : 10.1002/9780470771266 . ISBN 978-0-470-77126-6 .
- Scriven, Eric F. Azides and Nitrenes: Reactivity and Utility . Akademisk press. sid. 542. ISBN 9780124143074 .
- Padwa, Albert; Pearson, William H., red. (2002-04-05). Syntetiska tillämpningar av 1,3-dipolär cykladditionskemi mot heterocykler och naturprodukter: Padwa/dipolär cykladdition E-Bk . Kemi av heterocykliska föreningar: en serie monografier. New York, USA: John Wiley & Sons, Inc. doi : 10.1002/0471221902 . ISBN 978-0-471-38726-8 .
- Wolff, H. Org. Reagera. 1946, 3, 337–349.
- Boyer, JH; Canter, FC (1954-02-01). "Alkyl och arylazider" . Kemiska recensioner . 54 (1): 1–57. doi : 10.1021/cr60167a001 . ISSN 0009-2665 .
- Scriven, Eric FV; Turnbull, Kenneth (mars 1988). "Azider: deras beredning och syntetiska användningar" . Kemiska recensioner . 88 (2): 297–368. doi : 10.1021/cr00084a001 . ISSN 0009-2665 .
- Bräse, Stefan; Gil, Carmen; Knepper, Kerstin; Zimmermann, Viktor (2005-08-19). "Organiska Azider: En exploderande mångfald av en unik klass av föreningar" . Angewandte Chemie International Edition . 44 (33): 5188–5240. doi : 10.1002/anie.200400657 . ISSN 1433-7851 . PMID 16100733 .
![]() Den här artikeln innehåller text av Oleksandr Zhurakovskyi tillgänglig under licensen CC BY 2.5 .
Den här artikeln innehåller text av Oleksandr Zhurakovskyi tillgänglig under licensen CC BY 2.5 .
- ^ a b c S. Bräse; C. Gil; K. Knepper; V. Zimmermann (2005). "Organiska Azider: En exploderande mångfald av en unik klass av föreningar". Angewandte Chemie International Edition . 44 (33): 5188–5240. doi : 10.1002/anie.200400657 . PMID 16100733 .
- ^ Griess, John Peter; Hofmann, August Wilhelm Von (1864-01-01). "XX. Om en ny klass av föreningar där kväve ersätter väte" . Proceedings of the Royal Society of London . 13 : 375-384. doi : 10.1098/rspl.1863.0082 . S2CID 94746575 .
- ^ Griess, Peter (1866). "Ueber eine neue Klasse organischer Verbindungen, in denen Wasserstoff durch Stickstoff vertreten ist" . Annalen der Chemie und Pharmacie (på tyska). 137 (1): 39–91. doi : 10.1002/jlac.18661370105 .
- ^ Jay, R.; Curtius, Th. (januari 1894). "Zur Reduction des Diazoessigesters" . Berichte der Deutschen Chemischen Gesellschaft (på tyska). 27 (1): 775–778. doi : 10.1002/cber.189402701151 .
- ^ Huisgen, Rolf (oktober 1963). "1,3-dipolära cykelbelastningsförhållanden. Tidigare och framtida" . Angewandte Chemie International Edition på engelska . 2 (10): 565–598. doi : 10.1002/anie.196305651 . ISSN 0570-0833 .
- ^ Huisgen, R. (november 1963). "Kinetik och mekanism för 1,3-dipolr cykladditioner" . Angewandte Chemie International Edition på engelska . 2 (11): 633–645. doi : 10.1002/anie.196306331 . ISSN 0570-0833 .
-
^ a b
Organiska azider: synteser och tillämpningar . Stefan Bräse, Klaus Banert. Chichester, West Sussex, Storbritannien: John Wiley. 2010. ISBN 978-0-470-68252-4 . OCLC 587390490 .
{{ citera bok }}: CS1 underhåll: andra ( länk ) - ^ Demko, Zachary P.; Sharpless, K. Barry (november 2001). "Framställning av 5-substituerade 1H-tetrazoler från nitriler i vatten †" . The Journal of Organic Chemistry . 66 (24): 7945–7950. doi : 10.1021/jo010635w . ISSN 0022-3263 . PMID 11722189 .
- ^ Kolb, Hartmuth C.; Finn, MG; Sharpless, K. Barry (2001). "Klickkemi: olika kemiska funktioner från några bra reaktioner" . Angewandte Chemie International Edition . 40 (11): 2004–2021. doi : 10.1002/1521-3773(20010601)40:11<2004::AID-ANIE2004>3.0.CO;2-5 . ISSN 1521-3773 . PMID 11433435 .
- ^ Binder, Wolfgang; Kluger, Christian (2006-09-01). "Azid/Alkyn-"Klick"-reaktioner: Tillämpningar i materialvetenskap och organisk syntes" . Aktuell organisk kemi . 10 (14): 1791–1815. doi : 10.2174/138527206778249838 .
- ^ Rostovtsev, Vsevolod V.; Green, Luke G.; Fokin, Valery V.; Sharpless, K. Barry (2002). "En stegvis Huisgen Cycloaddition Process: Koppar(I)-katalyserad regioselektiv "ligering" av azider och terminala alkyner" . Angewandte Chemie International Edition . 41 (14): 2596–2599. doi : 10.1002/1521-3773(20020715)41:14<2596::AID-ANIE2596>3.0.CO;2-4 . ISSN 1521-3773 . PMID 12203546 .
- ^ Wagner, Gerald; Arion, Vladimir B.; Brecker, Lothar; Krantz, Carsten; Mieusset, Jean-Luc; Brinker, Udo H. (2009). "Kontrollerbar selektiv funktionalisering av en kavitand via fast tillståndsfotolys av en inkapslad fenylazid". Organiska bokstäver . 11 (14): 3056–3058. doi : 10.1021/ol901122h . PMID 19537769 .
- ^ Baran, Phil S.; Zografos, Alexandros L.; O'Malley, Daniel P. (mars 2004). "Kort total syntes av (±)-sceptrin" . Journal of the American Chemical Society . 126 (12): 3726–3727. doi : 10.1021/ja049648s . ISSN 0002-7863 . PMID 15038721 .
- ^ Shaffer, Karl J.; Taylor, Carol M. (2006-08-01). "β-glykosider av hydroxyprolin via en Umpolung Approach" . Organiska bokstäver . 8 (18): 3959–3962. doi : 10.1021/ol061424m . ISSN 1523-7060 . PMID 16928048 .
- ^ Righi, Giuliana; D'Achille, Claudia; Pescatore, Giovanna; Bonini, Carlo (september 2003). "Ny stereoselektiv syntes av de peptidiska aminopeptidashämmarna bestatin, febestin och probestin" . Tetraederbokstäver . 44 (37): 6999–7002. doi : 10.1016/S0040-4039(03)01799-4 .
- ^ RO Lindsay och CFH Allen (1942). "Fenylazid". Organiska synteser . 22 : 96. doi : 10.15227/orgsyn.022.0096 .
- ^ Kitamura, Mitsuru; Koga, Tatsuya; Yano, Masakazu; Okauchi, Tatsuo (juni 2012). "Direkt syntes av organiska azider från alkoholer med användning av 2-Azido-1,3-dimetylimidazoliniumhexafluorfosfat" . Synlett . 23 (9): 1335–1338. doi : 10.1055/s-0031-1290958 . ISSN 0936-5214 .
- ^ Lee, Sang-Hyeup; Yoon, Juyoung; Chung, Seung-Hwan; Lee, Yoon-Sik (mars 2001). "Effektiv asymmetrisk syntes av 2,3-diamino-3-fenylpropansyraderivat" . Tetraeder . 57 (11): 2139–2145. doi : 10.1016/S0040-4020(01)00090-4 .
- ^ Martinez, Luis E.; Leighton, James L.; Carsten, Douglas H.; Jacobsen, Eric N. (maj 1995). "Mycket enantioselektiv ringöppning av epoxider katalyserade av (salen)Cr(III)-komplex" . Journal of the American Chemical Society . 117 (21): 5897–5898. doi : 10.1021/ja00126a048 . ISSN 0002-7863 .
- ^ Sabitha, Gowravaram; Babu, R. Satheesh; Rajkumar, M.; Yadav, JS (februari 2002). "Cerium(III)klorid främjade mycket regioselektiv ringöppning av epoxider och aziridiner med användning av NaN 3 i acetonitril: en enkel syntes av 1,2-azidoalkoholer och 1,2-azidoaminer †" . Organiska bokstäver . 4 (3): 343–345. doi : 10.1021/ol016979q . ISSN 1523-7060 . PMID 11820875 .
- ^ Saito, Seiki; Bunya, Norio; Inaba, Masami; Moriwake, Toshio; Torii, Sigeru (januari 1985). "En enkel klyvning av oxiran med hydrazoesyra i dmf En ny väg till kirala β-hydroxi-α-aminosyror" . Tetraederbokstäver . 26 (43): 5309–5312. doi : 10.1016/S0040-4039(00)95024-X .
- ^ Titz, Alexander; Radic, Zorana; Schwardt, Oliver; Ernst, Beat (april 2006). "En säker och bekväm metod för framställning av triflylazid och dess användning i diazoöverföringsreaktioner till primära aminer" . Tetraederbokstäver . 47 (14): 2383–2385. doi : 10.1016/j.tetlet.2006.01.157 .
- ^ Waser, Jérôme; Gaspar, Boris; Nambu, Hisanori; Carreira, Erick M. (2006-09-01). "Hydraziner och azider via metallkatalyserad hydrohydrazinering och hydroazidering av olefiner" . Journal of the American Chemical Society . 128 (35): 11693–11712. doi : 10.1021/ja062355+ . ISSN 0002-7863 . PMID 16939295 .
- ^ CFH Allen; Alan Bell. "Undecyl isocyanat" . Organiska synteser . ; Collective Volume , vol. 3, sid. 846
- ^ Jon Munch-Petersen (1963). " m -Nitrobensazid" . Organiska synteser . ; Collective Volume , vol. 4, sid. 715
- ^ Pavitra Kumar Dutt; Hugh Robinson Whitehead och Arthur Wormall (1921). "CCXLI. - Verkan av diazosalter på aromatiska sulfonamider. Del I" . J. Chem. Soc., Trans. 119 : 2088–2094. doi : 10.1039/CT9211902088 .
- ^ Namnreaktioner: En samling av detaljerade reaktionsmekanismer av Jie Jack Li Publicerad 2003 Springer ISBN 3-540-40203-9
-
^ a b c d
Organiska azider: synteser och tillämpningar . Stefan Bräse, Klaus Banert. Chichester, West Sussex, Storbritannien: John Wiley. 2010. sid. 507. ISBN 978-0-470-68252-4 . OCLC 587390490 .
{{ citera bok }}: CS1 underhåll: andra ( länk ) - ^ Saul Patai, red. (1971). Azidogruppen . PATAIS kemi av funktionella grupper. doi : 10.1002/9780470771266 . ISBN 9780470771266 .
- ^ "Aminsyntes genom azidreduktion" .
- ^ Gololobov, Yuri G.; Kasukhin, Leonid F. (februari 1992). "De senaste framstegen i staudingerreaktionen" . Tetraeder . 48 (8): 1353–1406. doi : 10.1016/S0040-4020(01)92229-X .
- ^ Molina, Pedro; Vilaplana, Maria Jesús (1994). "Iminophosphoranes: Användbara byggstenar för beredning av kväveinnehållande heterocykler" . Syntes . 1994 (12): 1197–1218. doi : 10.1055/s-1994-25672 . ISSN 0039-7881 .
- ^ Fresneda, Pilar M.; Molina, Pedro (2004). "Tillämpning av iminofosforan-baserade metoder för syntes av naturliga produkter" . Synlett . 2004 (1): 1–17. doi : 10.1055/s-2003-43338 . ISSN 0936-5214 .
- ^ Palacios, Francisco; Alonso, Concepción; Aparicio, Domitila; Rubiales, Gloria; de los Santos, Jesús M. (januari 2007). "Aza-Wittig-reaktionen: ett effektivt verktyg för konstruktion av kol-kväve-dubbelbindningar" . Tetraeder . 63 (3): 523–575. doi : 10.1016/j.tet.2006.09.048 .
- ^ Álvares, Yolanda SP; Alves, M. José; Azoia, Nuno G.; Bickley, Jamie F.; Gilchrist, Thomas L. (2002). "Diastereoselektiv syntes av aziridiner från (1R)-10-(N,N-dialkylsulfamoyl)isobornyl-2H-azirin-3-karboxylater" . J. Chem. Soc., Perkin Trans. 1 (16): 1911–1919. doi : 10.1039/B202321K . ISSN 1472-7781 .
-
^
Kemin i azidogruppen . Saul Patai. London: Interscience Publishers. 1971. sid. 626. ISBN 978-0-470-77126-6 . OCLC 501315944 .
{{ citera bok }}: CS1 underhåll: andra ( länk ) - ^ Wasserman, E.; Smolinsky, G.; Yager, WA (augusti 1964). "Electron Spin Resonance of Alkyl Nitrenes" . Journal of the American Chemical Society . 86 (15): 3166–3167. doi : 10.1021/ja01069a049 . ISSN 0002-7863 .
- ^ Klima, Rodney F; Gudmundsdóttir, Anna D (mars 2004). "Intermolekylär triplettsensibiliserad fotolys av alkylazider" . Journal of Photochemistry and Photobiology A: Chemistry . 162 (2–3): 239–247. doi : 10.1016/S1010-6030(03)00368-X .
- ^ Travers, Michael J.; Cowles, Daniel C.; Clifford, Eileen P.; Ellison, G. Barney; Engelking, Paul C. (1999-09-22). "Fotoelektronspektroskopi av CH3N−jonen" . Journal of Chemical Physics . 111 (12): 5349–5360. Bibcode : 1999JChPh.111.5349T . doi : 10.1063/1.479795 . ISSN 0021-9606 .
-
^
Syntetiska tillämpningar av 1,3-dipolär cykloadditionskemi mot heterocykler och naturprodukter . Albert Padwa, William H. Pearson. Hoboken, NJ: Wiley. 2003. sid. 940. ISBN 0-471-28061-5 . OCLC 51312904 .
{{ citera bok }}: CS1 underhåll: andra ( länk ) - ^ Bräse, Stefan (oktober 2004). "Fördelarna med de multifunktionella triazenlänkarna i den effektiva solidfassyntesen av heterocykelbibliotek" . Redovisningar för kemisk forskning . 37 (10): 805–816. doi : 10.1021/ar0200145 . ISSN 0001-4842 . PMID 15491127 .
- ^ Tarabara, IN; Kas'yan, AO; Yarovoi, M. Yu.; Shishkina, SV; Shishkin, OV; Kas'yan, LI (juli 2004). "Reaktioner av bicyklo[2.2.1]hept-5-en-2,3-dikarboximider med aromatiska azider" . Russian Journal of Organic Chemistry . 40 (7): 992–998. doi : 10.1023/B:RUJO.0000045191.12939.47 . ISSN 1070-4280 . S2CID 97421265 .
- ^ Sustmann, Reiner (januari 1971). "En enkel modell för substituenteffekter i cykloadditionsreaktioner. I. 1,3-dipolära cykloadditioner" . Tetraederbokstäver . 12 (29): 2717–2720. doi : 10.1016/S0040-4039(01)96961-8 .
- ^ Sustmann, R. (1974-01-01). "Orbital energikontroll av cykloadditionsreaktivitet" . Ren och tillämpad kemi . 40 (4): 569–593. doi : 10.1351/pac197440040569 . ISSN 1365-3075 . S2CID 28715256 .
- ^ Huisgen, Rolf; Geittner, Jochen; Reissig, Hans-Ulrich (1978). "Lösningsmedelsberoende av cykloladdningshastigheter för fenyldiazometan och aktiveringsparametrar" . Heterocykler . 11 (1): 109. doi : 10.3987/S(N)-1978-01-0109 . ISSN 0385-5414 .
- ^ Damon D. Reed & Stephen C. Bergmeier (2007). "En enkel syntes av en polyhydroxylerad 2-azabicyklo[3.2.1]oktan". J. Org. Chem. 72 (3): 1024–6. doi : 10.1021/jo0619231 . PMID 17253828 .
- ^ Treitler, Daniel S.; Leung, Simon (2 september 2022). "Hur farligt är för farligt? Ett perspektiv på azidkemi" . The Journal of Organic Chemistry . 87 (17): 11293–11295. doi : 10.1021/acs.joc.2c01402 . ISSN 0022-3263 . PMID 36052475 . S2CID 252009657 . Hämtad 18 september 2022 .