MT-ATP8
| ATP8- | |||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| identifierare | |||||||||||||||||||||||||||||||||||||||||||||||
| , ATPase8, MTMT-ATP-syntas F0-underenhet 8 | |||||||||||||||||||||||||||||||||||||||||||||||
| externa ID:n | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||
| Identifierare av | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| ATP-syntasprotein 8 (metazoa). | |||||||||
| Symbol | ATP-synt_8 | ||||||||
| Pfam | PF00895 | ||||||||
| Pfam klan | CL0255 | ||||||||
| InterPro | IPR001421 | ||||||||
| |||||||||
| Plant ATP-syntas F0-underenhet 8 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifierare | |||||||||
| Symbol | YMF19 | ||||||||
| Pfam | PF02326 | ||||||||
| Pfam klan | CL0255 | ||||||||
| InterPro | IPR003319 | ||||||||
| |||||||||
| Svamp-ATP-syntasprotein 8 (A6L) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifierare | |||||||||
| Symbol | Fun_ATP-synt_8 | ||||||||
| Pfam | PF05933 | ||||||||
| Pfam klan | CL0255 | ||||||||
| InterPro | IPR009230 | ||||||||
| |||||||||
MT-ATP8 (eller ATP8 ) är en mitokondriell gen med det fullständiga namnet 'mitokondriellt kodad ATP-syntasmembransubenhet 8' som kodar för en underenhet av mitokondriell ATP-syntas, ATP -syntas F o underenhet 8 (eller underenhet A6L ). Denna subenhet tillhör Fo - komplexet av det stora, transmembrana ATP-syntaset av F-typ . Detta enzym, som också är känt som komplex V, är ansvarigt för det sista steget av oxidativ fosforylering i elektrontransportkedjan . Specifikt tillåter ett segment av ATP-syntas positivt laddade joner , kallade protoner , att flöda över ett specialiserat membran inuti mitokondrier. Ett annat segment av enzymet använder energin som skapas av detta protonflöde för att omvandla en molekyl som kallas adenosindifosfat (ADP) till ATP . Subenhet 8 skiljer sig i sekvens mellan metazoer , växter och svampar .
Strukturera
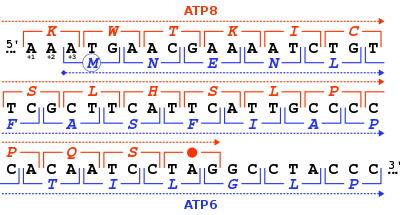
ATP-syntasproteinet 8 från människor och andra däggdjur kodas i mitokondriegenomet av MT -ATP8- genen . När det fullständiga mänskliga mitokondriella genomet först publicerades beskrevs MT-ATP8 -genen som den oidentifierade läsramen URF A6L . En ovanlig egenskap hos MT-ATP8 -genen är dess 46-nukleotidöverlappning med MT-ATP6- genen. Med avseende på läsramen (+1) för MT-ATP8 , börjar MT -ATP6- genen på läsramen +3.
MT-ATP8-proteinet väger 8 kDa och består av 68 aminosyror . Proteinet är en subenhet av F 1 F o ATPase, även känd som Complex V , som består av 14 nukleära och 2 mitokondriekodade subenheter. F-typ ATPaser består av två strukturella domäner, F 1 innehåller den extramembranösa katalytiska kärnan och F o som innehåller membranprotonkanalen, sammanlänkade av en central stjälk och en perifer stjälk. Som en A-subenhet finns MT-ATP8 i den icke-katalytiska, transmembrana F o- delen av komplexet, innefattande protonkanalen . Den katalytiska delen av mitokondriellt ATP-syntas består av 5 olika subenheter (alfa, beta, gamma, delta och epsilon) sammansatta med en stökiometri på 3 alfa, 3 beta och en enda representant för de andra 3. Protonkanalen består av tre huvudsubenheter (a, b, c). Denna gen kodar för delta-subenheten i den katalytiska kärnan. Alternativt har splitsade transkriptvarianter som kodar för samma isoform identifierats.
Fungera
MT-ATP8- genen kodar för en subenhet av mitokondriellt ATP-syntas , lokaliserat inom tylakoidmembranet och det inre mitokondriella membranet . Mitokondriell ATP-syntas katalyserar ATP-syntes, med hjälp av en elektrokemisk gradient av protoner över det inre membranet under oxidativ fosforylering . F o -regionen orsakar rotation av F 1 , som har en vattenlöslig komponent som hydrolyserar ATP och tillsammans skapar F 1 F o en väg för rörelse av protoner över membranet.
Denna proteinsubenhet verkar vara en integrerad komponent av statorskaftet i jästmitokondriella F-ATPaser . Statorskaftet är förankrat i membranet och verkar för att förhindra meningslös rotation av ATPase-subenheterna i förhållande till rotorn under kopplad ATP-syntes/hydrolys. Denna subenhet kan ha en analog funktion i Metazoa .
Nomenklatur
Enzymets nomenklatur har en lång historia . F 1 -fraktionen härleder sitt namn från termen "fraktion 1" och F o (skriven som en nedsänkt bokstav "o", inte "noll") härleder sitt namn från att vara bindningsfraktionen för oligomycin , en typ av naturligt härledd antibiotika som kan hämma Fo - enheten av ATP-syntas. F o -regionen av ATP-syntas är en protonpor som är inbäddad i mitokondriella membranet. Den består av tre huvudsubenheter A, B och C, och (i människor) sex ytterligare subenheter, d , e , f , g , MT-ATP6 (eller F6) och MT-ATP8 (eller A6L). 3D-strukturen av E. coli -homolog av denna underenhet modellerades baserat på elektronmikroskopidata (kedja M av ). Det bildar ett transmembrant 4-α-knippe.
Klinisk signifikans
Mutationer av MT-ATP8 och andra gener som påverkar oxidativ fosforylering i mitokondrierna har associerats med en mängd olika neurodegenerativa och kardiovaskulära störningar, inklusive brist på mitokondriekomplex V, Lebers ärftliga optiska neuropati (LHON), mitokondriell encefalomyopati med strokeliknande episoder ( MELAS ) , Leigh syndrom och NARP syndrom . De flesta av kroppens celler innehåller tusentals mitokondrier, var och en med en eller flera kopior av mitokondrie-DNA . Svårighetsgraden av vissa mitokondriella störningar är associerad med andelen mitokondrier i varje cell som har en speciell genetisk förändring. Personer med Leighs syndrom på grund av en MT-ATP6-genmutation tenderar att ha en mycket hög andel mitokondrier med mutationen (från mer än 90 procent till 95 procent). De mindre allvarliga egenskaperna hos NARP beror på en lägre andel mitokondrier med mutationen, vanligtvis 70 till 90 procent. Eftersom dessa två tillstånd beror på samma genetiska förändringar och kan förekomma i olika medlemmar av en enda familj, tror forskare att de kan representera ett spektrum av överlappande egenskaper istället för två distinkta syndrom.
Brist på mitokondriekomplex V uppvisar heterogena kliniska manifestationer inklusive neuropati , ataxi , hypertrofisk kardiomyopati . Hypertrofisk kardiomyopati kan uppträda med försumbar till extrem hypertrofi , minimal till omfattande fibros och myocytförändringar , frånvarande till allvarlig obstruktion i vänsterkammarutflödeskanalen, och distinkta septala konturer/morfologier med extremt varierande kliniskt förlopp.
Brist på mitokondriekomplex V är en brist (brist) eller förlust av funktion i komplex V i elektrontransportkedjan som kan orsaka en mängd olika tecken och symtom som påverkar många organ och system i kroppen, särskilt nervsystemet och hjärtat . Störningen kan vara livshotande i spädbarnsåldern eller tidig barndom. Drabbade individer kan ha ätproblem, långsam tillväxt, låg muskeltonus ( hypotoni ), extrem trötthet ( slöhet ) och utvecklingsförsening . De tenderar att utveckla förhöjda nivåer av mjölksyra i blodet ( laktacidos ), vilket kan orsaka illamående, kräkningar, svaghet och snabb andning. Höga nivåer av ammoniak i blodet ( hyperammonemi ) kan också förekomma hos drabbade individer, och i vissa fall resultera i onormal hjärnfunktion ( encefalopati ) och skador på andra organ. Ataxi , mikrocefali , utvecklingsförsening och intellektuell funktionsnedsättning har observerats hos patienter med en ramförskjutningsmutation i MT-ATP6. Detta orsakar en C-insättning vid position 8612 som resulterar i ett trunkerat protein endast 36 aminosyror långt, och två T > C enkelnukleotidpolymorfismer vid positionerna 8610 och 8614 som resulterar i en homopolymer cytosinsträckning .
Hypertrofisk kardiomyopati , ett vanligt kännetecken för mitokondriekomplex V-brist, kännetecknas av förtjockning ( hypertrofi ) av hjärtmuskeln som kan leda till hjärtsvikt . M.8528T>C-mutationen förekommer i den överlappande regionen av MT-ATP6- och MT-ATP8-generna och har beskrivits hos flera patienter med infantil kardiomyopati. Denna mutation ändrar initieringskodonet i MT-ATP6 till treonin såväl som en förändring från tryptofan till arginin vid position 55 i MT-ATP8. Individer med mitokondriellt komplex V-brist kan också ha ett karakteristiskt mönster av ansiktsdrag, inklusive en hög panna, böjda ögonbryn, yttre ögonvrån som pekar nedåt (nedåtlutande palpebrala sprickor), en framträdande näsrygg, lågt liggande öron, tunna läppar och en liten haka ( micrognathia) .
Infantil hypertrofisk kardiomyopati (CMHI) orsakas också av mutationer som påverkar distinkta genetiska loci , inklusive MT-ATP6 och MT-ATP8. En infantil form av hypertrofisk kardiomyopati , en hjärtsjukdom som kännetecknas av ventrikulär hypertrofi , som vanligtvis är asymmetrisk och ofta involverar interventrikulär septum . Symtomen inkluderar dyspné , synkope , kollaps, hjärtklappning och bröstsmärtor . De kan lätt provoceras av träning. Störningen har inter- och intrafamiliell variation som sträcker sig från benigna till maligna former med hög risk för hjärtsvikt och plötslig hjärtdöd .
Vidare läsning
- Torroni A, Achilli A, Macaulay V, Richards M, Bandelt HJ (juni 2006). "Skörda frukten av det mänskliga mtDNA-trädet". Trender inom genetik . 22 (6): 339–45. doi : 10.1016/j.tig.2006.04.001 . PMID 16678300 .
- Bodenteich A, Mitchell LG, Polymeropoulos MH, Merril CR (maj 1992). "Dinukleotidupprepning i den mänskliga mitokondriella D-slingan" . Human molekylär genetik . 1 (2): 140. doi : 10.1093/hmg/1.2.140-a . PMID 1301157 .
- Lu X, Walker T, MacManus JP, Seligy VL (juli 1992). "Differentiering av HT-29 humana kolonadenokarcinomceller korrelerar med ökat uttryck av mitokondriellt RNA: effekter av trehalos på celltillväxt och mognad". Cancerforskning . 52 (13): 3718–25. PMID 1377597 .
- Marzuki S, Noer AS, Lertrit P, Thyagarajan D, Kapsa R, Utthanaphol P, Byrne E (december 1991). "Normala varianter av humant mitokondrie-DNA och translationsprodukter: uppbyggnaden av en referensdatabas". Human Genetik . 88 (2): 139–45. doi : 10.1007/bf00206061 . PMID 1757091 . S2CID 28048453 .
- Moraes CT, Andreetta F, Bonilla E, Shanske S, DiMauro S, Schon EA (mars 1991). "Replikationskompetent humant mitokondriellt DNA som saknar den tunga strängspromotorregionen" . Molekylär och cellulär biologi . 11 (3): 1631–7. doi : 10.1128/MCB.11.3.1631 . PMC 369459 . PMID 1996112 .
- Attardi G, Chomyn A, Doolittle RF, Mariottini P, Ragan CI (1987). "Sju oidentifierade läsramar av humant mitokondrie-DNA kodar för subenheter av andningskedjan NADH-dehydrogenas". Cold Spring Harbor Symposia on Quantitative Biology . 51 Pt 1 (1): 103–14. doi : 10.1101/sqb.1986.051.01.013 . PMID 3472707 .
- Chomyn A, Cleeter MW, Ragan CI, Riley M, Doolittle RF, Attardi G (oktober 1986). "URF6, sista oidentifierade läsram av humant mtDNA, kodar för en NADH-dehydrogenassubenhet". Vetenskap . 234 (4776): 614–8. Bibcode : 1986Sci...234..614C . doi : 10.1126/science.3764430 . PMID 3764430 .
- Chomyn A, Mariottini P, Cleeter MW, Ragan CI, Matsuno-Yagi A, Hatefi Y, Doolittle RF, Attardi G (1985). "Sex oidentifierade läsramar av humant mitokondrie-DNA kodar för komponenter i NADH-dehydrogenaset i andningskedjan". Naturen . 314 (6012): 592–7. Bibcode : 1985Natur.314..592C . doi : 10.1038/314592a0 . PMID 3921850 . S2CID 32964006 .
- Anderson S, Bankier AT, Barrell BG, de Bruijn MH, Coulson AR, Drouin J, Eperon IC, Nierlich DP, Roe BA, Sanger F, Schreier PH, Smith AJ, Staden R, Young IG (april 1981). "Sekvens och organisation av det mänskliga mitokondriella genomet". Naturen . 290 (5806): 457–65. Bibcode : 1981Natur.290..457A . doi : 10.1038/290457a0 . PMID 7219534 . S2CID 4355527 .
- Montoya J, Ojala D, Attardi G (april 1981). "Särskiljande egenskaper hos de 5'-terminala sekvenserna av de mänskliga mitokondriella mRNA:erna". Naturen . 290 (5806): 465–70. Bibcode : 1981Natur.290..465M . doi : 10.1038/290465a0 . PMID 7219535 . S2CID 4358928 .
- Horai S, Hayasaka K, Kondo R, Tsugane K, Takahata N (januari 1995). "Nya afrikanska ursprung för moderna människor avslöjat av kompletta sekvenser av hominoid mitokondrie-DNA" . Proceedings of the National Academy of Sciences of the United States of America . 92 (2): 532–6. Bibcode : 1995PNAS...92..532H . doi : 10.1073/pnas.92.2.532 . PMC 42775 . PMID 7530363 .
- Rieder MJ, Taylor SL, Tobe VO, Nickerson DA (februari 1998). "Automatisk identifiering av DNA-variationer med hjälp av kvalitetsbaserad fluorescensre-sekvensering: analys av det mänskliga mitokondriella genomet" . Nukleinsyraforskning . 26 (4): 967–73. doi : 10.1093/nar/26.4.967 . PMC 147367 . PMID 9461455 .
- Andrews RM, Kubacka I, Chinnery PF, Lightowlers RN, Turnbull DM, Howell N (oktober 1999). "Omanalys och revidering av Cambridge-referenssekvensen för humant mitokondrie-DNA" . Naturgenetik . 23 (2): 147. doi : 10.1038/13779 . PMID 10508508 . S2CID 32212178 .
- Ingman M, Kaessmann H, Pääbo S, Gyllensten U (december 2000). "Mitokondriell genomvariation och ursprunget till moderna människor". Naturen . 408 (6813): 708–13. Bibcode : 2000Natur.408..708I . doi : 10.1038/35047064 . PMID 11130070 . S2CID 52850476 .
- Finnilä S, Lehtonen MS, Majamaa K (juni 2001). "Fylogenetiskt nätverk för europeiskt mtDNA" . American Journal of Human Genetics . 68 (6): 1475–84. doi : 10.1086/320591 . PMC 1226134 . PMID 11349229 .
- Maca-Meyer N, González AM, Larruga JM, Flores C, Cabrera VM (2003). "Större genomiska mitokondriella linjer avgränsar tidiga mänskliga expansioner" . BMC Genetics . 2 : 13. doi : 10.1186/1471-2156-2-13 . PMC 55343 . PMID 11553319 .
- Herrnstadt C, Elson JL, Fahy E, Preston G, Turnbull DM, Anderson C, Ghosh SS, Olefsky JM, Beal MF, Davis RE, Howell N (maj 2002). "Reducerad median-nätverksanalys av kompletta mitokondriella DNA-kodande regionsekvenser för de stora afrikanska, asiatiska och europeiska haplogrupperna" . American Journal of Human Genetics . 70 (5): 1152–71. doi : 10.1086/339933 . PMC 447592 . PMID 11938495 .
- Silva WA, Bonatto SL, Holanda AJ, Ribeiro-Dos-Santos AK, Paixão BM, Goldman GH, Abe-Sandes K, Rodriguez-Delfin L, Barbosa M, Paçó-Larson ML, Petzl-Erler ML, Valente V, Santos SE , Zago MA (juli 2002). "Mitokondriell genommångfald hos indianer stöder ett enda tidigt inträde av grundarpopulationer till Amerika" . American Journal of Human Genetics . 71 (1): 187–92. doi : 10.1086/341358 . PMC 384978 . PMID 12022039 .
- Mishmar D, Ruiz-Pesini E, Golik P, Macaulay V, Clark AG, Hosseini S, Brandon M, Easley K, Chen E, Brown MD, Sukernik RI, Olckers A, Wallace DC (januari 2003). "Naturligt urval formade regional mtDNA-variation hos människor" . Proceedings of the National Academy of Sciences of the United States of America . 100 (1): 171–6. Bibcode : 2003PNAS..100..171M . doi : 10.1073/pnas.0136972100 . PMC 140917 . PMID 12509511 .
- Ingman M, Gyllensten U (juli 2003). "Mitokondriell genomvariation och evolutionär historia för australiensiska och nya guineanska aboriginer" . Genomforskning . 13 (7): 1600–6. doi : 10.1101/gr.686603 . PMC 403733 . PMID 12840039 .
Denna artikel innehåller text från United States National Library of Medicine, som är allmän egendom .