Kinazolin
|
|||
|
|
|||
| Namn | |||
|---|---|---|---|
|
Föredraget IUPAC-namn
Kinazolin |
|||
| Andra namn 1,3-diazanaftalen
bensopyrimidin fenmiazin benso-1,3-diazin |
|||
| Identifierare | |||
|
3D-modell ( JSmol )
|
|||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.005.424 | ||
| EG-nummer |
|
||
|
PubChem CID
|
|||
| UNII | |||
|
CompTox Dashboard ( EPA )
|
|||
|
|||
|
|||
| Egenskaper | |||
| C8H6N2 _ _ _ _ _ | |||
| Molar massa | 130,150 g·mol -1 | ||
| Utseende | ljusgula kristaller | ||
| Densitet | 1,351 g/cm3 , fast | ||
| Smältpunkt | 48 °C (118 °F; 321 K) | ||
| Kokpunkt | 243 °C (469 °F; 516 K) | ||
| Löslig | |||
| Surhet (p K a ) | 3,51 | ||
| Strukturera | |||
| 2.2 D | |||
| Faror | |||
| Arbetsmiljö och hälsa (OHS/OSH): | |||
|
Huvudsakliga faror
|
Irriterande | ||
| GHS- märkning : | |||

|
|||
| Varning | |||
| H315 , H319 , H335 | |||
| P261 , P264 , P271 , P280 , P302+P352 , P304+P340 , P305+P351+P338 , P312 , P321 , P332 + P313 , P337 +P313 , P337 + P323 3P , P 30 , P 5 1 | |||
| Flampunkt | 106 °C (223 °F; 379 K) | ||
| Säkerhetsdatablad (SDS) | Externt MSDS | ||
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|||
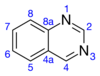
Kinazolin är en organisk förening med formeln C8H6N2 . _ Det är en aromatisk heterocykel med en bicyklisk struktur bestående av två sammansmälta sexledade aromatiska ringar, en bensenring och en pyrimidinring . Det är ett ljusgult kristallint fast ämne som är lösligt i vatten. Även känd som 1,3-diazanaftalen, fick kinazolin sitt namn från att vara ett azaderivat av kinolin . Även om moderkinazolinmolekylen sällan nämns av sig själv i teknisk litteratur, har substituerade derivat syntetiserats för medicinska ändamål såsom antimalariamedel och anticancermedel. Kinazolin är en plan molekyl. Det är isomeriskt med de andra diazanaftalenerna i bensodiazinundergruppen : cinnolin , kinoxalin och ftalazin . Över 200 biologiskt aktiva kinazolin- och kinolinalkaloider identifieras.
Syntes
Syntesen av kinazolin rapporterades första gången 1895 av August Bischler och Lang genom dekarboxylering av 2-karboxiderivatet (kinazolin-2-karboxylsyra). 1903 Siegmund Gabriel syntesen av moderkinazolin från o -nitrobensylamin, som reducerades med vätejodid och röd fosfor till 2- aminobensylamin . Den reducerade mellanprodukten kondenserar med myrsyra för att ge dihydrokinazolin, som oxiderades till kinazolin.
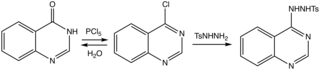
Metoder har setts över. En effektiv väg till moderheterocykeln fortsätter via 4-klorderivatet till tosylhydraziden, som avlägsnas med bas.
Reaktioner
Hydrering och additionsreaktioner
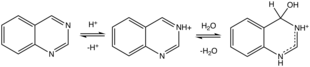
Kinazolinprotonater (och metylater) vid N3. Protonering inducerar hydrering. Många svagt sura substrat adderas över C=N3-bindningen, dessa inkluderar vätecyanid , natriumbisulfit och metylketoner.
Hydrolys
I varm lösning hydrolyserar kinazolin under sura och alkaliska förhållanden till 2-aminobensaldehyd (eller produkter av dess självkondensation) och myrsyra och ammoniak/ammonium.
Elektrofil och nukleofil substitution
Pyrimidinringen motstår elektrofil substitution , även om 4-positionen är mer reaktiv än 2-positionen. I jämförelse är bensenringen mer mottaglig för elektrofil substitution. Ringpositionsordningen för reaktivitet är 8 > 6 > 5 > 7. 2- och 4-haloderivat av kinazolin genomgår undanträngning av nukleofiler, såsom piperidin.
Biologisk och farmakologisk betydelse
Gefitinib
I maj 2003 godkände US Food and Drug Administration (FDA) kinazolin gefitinib . Läkemedlet, producerat av AstraZeneca , är en hämmare av proteinkinaset från epidermal tillväxtfaktorreceptor (EGFR). Det binder till ATP-bindningsstället för EGFR, vilket inaktiverar den anti-apoptotiska Ras-signaltransduktionskaskaden och förhindrar ytterligare tillväxt av cancerceller.
Lapatinib
I mars 2007 godkändes GlaxoSmithKlines läkemedel lapatinib av amerikanska FDA för att behandla bröstcancer i framskridet stadium eller metastaserad bröstcancer i kombination med Roches capecitabin . Lapatinib eliminerar tillväxten av bröstcancerstamceller som orsakar tumörtillväxt. Bindningen av lapatinib till ATP-bindningsstället i EGFR och human epidermal tillväxtfaktorreceptor 2 (HER2) proteinkinasdomäner hämmar signalmekanismaktivering (genom reversibel, kompetitiv hämning).
Erlotinib
I maj 2013 godkändes erlotinib , ett läkemedel tillverkat av Astellas , av amerikanska FDA för att behandla NSCLC-patienter med tumörer orsakade av mutationer av EGFR. Bindningen av erlotinib till ATP-bindningsställena för EGFR-receptorerna förhindrar EGFR från att producera fosfotyrosinrester (på grund av kompetitiv hämning), vilket gör receptorn oförmögen att generera signalkaskader för att främja celltillväxt.
Afatinib
I juli 2013 godkände amerikanska FDA afatinib , ett läkemedel utvecklat av Boehringer Ingelheim , som en irreversibel, kompetitiv hämmare av HER2- och EGFR-kinaser. Även om afatinib uppvisar en liknande mekanism som laptinib där det fungerar som en irreversibel HER2- och EGFR-hämmare, har afatinib också visat aktivitet mot tyrosinkinaser som har blivit resistenta mot gefinitib och erlotinib.
- Läkemedel som innehåller kinazolin
Gefitinib för behandling av icke-småcelligt lungkarcinom .
Lapatinib för behandling av avancerad eller metastaserad bröstcancer.
Erlotinib , ett antitumörmedel.
Afatinib för behandling av cancer som är resistenta mot gefinitib och erlotinib.