Heterogen guldkatalys
Heterogen guldkatalys hänvisar till katalysen av kemiska reaktioner av guld , vanligtvis uppburet på metalloxidsubstrat. Trots den välkända trögheten hos bulkguld, minskar diametern på understödda guldkluster till c. 2 till 5 nm resulterar i hög katalytisk aktivitet mot lågtemperatur kolmonoxid (CO) oxidation. Flera andra industriellt relevanta reaktioner observeras också såsom H 2 -aktivering, vattengasskifte och hydrering .
Den höga aktiviteten hos stödda guldkluster har föreslagits härröra från en kombination av strukturella förändringar, kvantstorlekseffekter och stödeffekter som preferentiellt ställer in den elektroniska strukturen hos guld så att optimal bindning av adsorbater under den katalytiska cykeln möjliggörs. Selektiviteten och aktiviteten hos guldnanopartiklar kan finjusteras genom att variera valet av stödmaterial, med t.ex. titandioxid (TiO 2 ), hematit (α-Fe 2 O 3 ), kobolt(II/III)oxid (Co 3 O 4 ) och nickel(II)oxid (NiO) som fungerar som de mest effektiva stödmaterialen för att underlätta katalysen av CO-förbränning. Förutom att möjliggöra en optimal spridning av nanoklustren, har stödmaterialen föreslagits för att främja katalys genom att ändra storleken, formen, spänningen och laddningstillståndet hos klustret. En exakt formkontroll av de deponerade guldklustren har visat sig vara viktig för att optimera den katalytiska aktiviteten, med halvsfäriska, få atomlager tjocka nanopartiklar som i allmänhet uppvisar de mest önskvärda katalytiska egenskaperna på grund av maximerat antal högenergikanter och hörnplatser.
Förslag till ansökningar
Tidigare har heterogena guldkatalysatorer funnit kommersiella tillämpningar för industriell produktion av polyvinylklorid (PVC), metylmetakrylat och katalysatorer . Traditionellt använder PVC-produktion kvicksilverkatalysatorer och leder till allvarliga miljöproblem. Kina står för 50 % av världens kvicksilverutsläpp och 60 % av Kinas kvicksilverutsläpp orsakas av PVC-produktion. Även om guldkatalysatorer är något dyra, påverkas den totala produktionskostnaden med endast ~1%. Därför anses katalys av grönt guld vara värdefullt. Prisfluktuationen på guld har senare lett till att verksamheten upphört på grund av deras användning i katalysatorer. Mycket nyligen har det skett en hel del utveckling inom guldkatalys för syntes av organiska molekyler inklusive CC-bindningen som bildar homokopplings- eller korskopplingsreaktioner och det har spekulerats i att några av dessa katalysatorer kan hitta tillämpningar inom olika områden.
CO-oxidation
Guld kan vara en mycket aktiv katalysator vid oxidation av kolmonoxid (CO), dvs reaktionen av CO med molekylärt syre för att producera koldioxid (CO 2 ). Understödda guldkluster , tunna filmer och nanopartiklar är en till två storleksordningar mer aktiva än atomärt spridda guldkatjoner eller ostödda metalliskt guld.
kan dispergeras atomärt på La2O3 . basiska metalloxidbärare såsom MgO och Monovalenta och trivalenta guldkatjoner har identifierats, de senare är mer aktiva men mindre stabila än de förra. Omsättningsfrekvensen (TOF) för CO-oxidation på dessa katjoniska guldkatalysatorer är i storleksordningen 0,01 s- 1 , vilket uppvisar den mycket höga aktiveringsenergin på 138 kJ/mol.
Understödda guldnanokluster med en diameter < 2 nm är aktiva för CO-oxidation med omsättningstal (TOF) i storleksordningen 0,1 s −1 . Det har observerats att kluster med 8 till 100 atomer är katalytiskt aktiva. Anledningen är att å ena sidan är åtta atomer det minimum som krävs för att bilda en stabil, diskret energibandstruktur , och å andra sidan minskar d-bandsdelningen i kluster med mer än 100 atomer, som liknar den elektroniska bulkstrukturen. Stödet har en betydande effekt på den elektroniska strukturen hos guldkluster. Metallhydroxidbärare såsom Be(OH) 2 , Mg(OH) 2 och La(OH) 3 , med guldkluster på < 1,5 nm i diameter utgör högaktiva katalysatorer för CO-oxidation vid 200 K (-73 °C). Med hjälp av tekniker som HR-TEM och EXAFS har det bevisats att aktiviteten hos dessa katalysatorer uteslutande beror på kluster med 13 atomer arrangerade i en ikosaederstruktur. Vidare bör metallbelastningen överstiga 10 viktprocent för att katalysatorerna ska vara aktiva.
Guldnanopartiklar i storleksintervallet 2 till 5 nm katalyserar CO-oxidation med en TOF på cirka 1 s −1 vid temperaturer under 273 K (0 °C). Den katalytiska aktiviteten hos nanopartiklar åstadkoms i frånvaro av fukt när underlaget är halvledande eller reducerbart , t.ex. TiO 2 , MnO 2 , Fe 2 O 3 , ZnO , ZrO 2 eller CeO 2 . Men när underlaget är isolerande eller icke-reducerbart, t.ex. Al 2 O 3 och SiO 2 , krävs en fukthalt > 5000 ppm för aktivitet vid rumstemperatur. När det gäller pulverkatalysatorer framställda med våta metoder ger yt-OH - grupperna på bäraren tillräcklig hjälp som samkatalysatorer, så att ingen ytterligare fukt behövs. Vid temperaturer över 333 K (60 °C) behövs inget vatten alls.
Den skenbara aktiveringsenergin för CO-oxidation på stödda guldpulverkatalysatorer framställda med våta metoder är 2-3 kJ/mol över 333 K (60 °C) och 26-34 kJ/mol under 333 K. Dessa energier är låga, jämfört med värden som visas av andra ädelmetallkatalysatorer (80-120 kJ/mol). Förändringen i aktiveringsenergin vid 333 K kan tillskrivas en förändring i reaktionsmekanismen. Denna förklaring har fått stöd experimentellt. Vid 400 K (127 °C) är reaktionshastigheten per yt-Au-atom inte beroende av partikeldiametern, men reaktionshastigheten per perimeter Au-atom är direkt proportionell mot partikeldiametern. Detta tyder på att mekanismen över 333 K äger rum på guldytorna. Däremot, vid 300 K (27 °C), är reaktionshastigheten per yt-Au-atom omvänt proportionell mot partikeldiametern, medan hastigheten per perimetergränsyta inte beror på partikelstorleken. Därför sker CO-oxidation på perimeterställena vid rumstemperatur. Ytterligare information om reaktionsmekanismen har avslöjats genom att studera reaktionshastighetens beroende av de reaktiva ämnenas partialtryck . Både vid 300 K och 400 K finns det ett första ordningens hastighetsberoende på CO-partialtryck upp till 4 Torr (533 Pa), över vilket reaktionen är nollordningen. Med avseende på O 2 är reaktionen nollordningen över 10 Torr (54,7 kPa) vid både 300 och 400 K. Ordningen med avseende på O 2 vid lägre partialtryck är 1 vid 300 K och 0,5 vid 400 K. Förskjutningen mot nollordning indikerar att katalysatorns aktiva ställen är mättade med arten i fråga. Därför har en Langmuir-Hinshelwood- mekanism föreslagits, där CO adsorberat på guldytor reagerar med O adsorberat vid kanterna av guldnanopartiklarna.
Behovet av att använda oxidstöd, och mer specifikt reducerbara stöd, beror på deras förmåga att aktivera dioxygen . Guldnanopartiklar stödda på inerta material som kol eller polymerer har visat sig vara inaktiva vid CO-oxidation. Det tidigare nämnda beroendet av vissa katalysatorer av vatten eller fukt hänför sig också till syreaktivering. Förmågan hos vissa reducerbara oxider, såsom MnO 2 , Co 3 O 4 , och NiO att aktivera syre under torra förhållanden (< 0,1 ppm H 2 O) kan tillskrivas bildandet av syredefekter under förbehandling.
Vattengasskifte
Vattengasskifte är den mest utbredda industriella processen för framställning av diväte , H 2 . Det involverar reaktionen av kolmonoxid och vatten ( syngas ) för att bilda väte och koldioxid som en biprodukt. I många katalytiska reaktionsscheman är en av de elementära reaktionerna oxidationen av CO med ett adsorberat syreämne. Guldkatalysatorer har föreslagits som ett alternativ för vattengasskifte vid låga temperaturer, dvs. < 523 K (250 °C). Denna teknik är avgörande för utvecklingen av fastoxidbränsleceller . Hematit har visat sig vara en lämplig katalysatorbärare för detta ändamål. Dessutom har en bimetallisk Au- Ru /Fe 2 O 3 katalysator visat sig vara mycket aktiv och stabil för lågtemperaturvattengasskift. Titaniumoxid och ceriumoxid har också använts som stöd för effektiva katalysatorer. Tyvärr är Au/ CeO 2 benägen att deaktiveras orsakad av ytbundna karbonat- eller formiat -arter.
Även om guldkatalysatorer är aktiva vid rumstemperatur till CO-oxidation, kräver de höga mängderna vatten som är involverade i vattengasskiften högre temperaturer. Vid sådana temperaturer reduceras guld helt till sin metalliska form. Aktiviteten hos t.ex. Au/CeO 2 har dock förstärkts genom CN − behandling, varvid metalliskt guld urlakas och lämnar efter sig mycket aktiva katjoner. Enligt DFT- beräkningar tillåts närvaron av sådana auktioner på katalysatorn av tomma, lokaliserade icke-bindande f-tillstånd i CeO 2 . Å andra sidan STEM- studier av Au/CeO 2 avslöjat nanopartiklar på 3 nm i diameter. Vattengasskifte har föreslagits att inträffa i gränssnittet mellan Au-nanopartiklar och det minskade CeO 2 -stödet.
Epoxidationer
Även om epoxidering av eten rutinmässigt uppnås i industrin med selektiviteter så höga som 90 % på Ag- katalysatorer, gav de flesta katalysatorer < 10 % selektivitet för propylenepoxidation. Med användning av en guldkatalysator uppburen på titansilikat-1 (TS-1) molekylsikt , erhölls utbyten av 350 g/h per gram guld vid 473 K (200 °C). Reaktionen ägde rum i gasfas. Vidare, med användning av mesoporösa titanosilikatbärare (Ti- MCM -41 och Ti- MCM -48), gav guldkatalysatorer > 90 % selektivitet vid ~ 7 % propenomvandling, 40 % H2- effektivitet och 433 K (160 °C). De aktiva arterna i dessa katalysatorer identifierades vara halvsfäriska guldnanokristaller med en diameter på mindre än 2 nm i intim kontakt med underlaget.
Alkenepoxidation har visats i frånvaro av H2- reduktionsmedel i vätskefasen. Till exempel, med användning av 1% Au/ grafit , erhölls ~80% selektiviteter av cis-cyklookten till cyklooktenoxid (analogt med cyklohexenoxid ) vid 7-8% omvandling, 353 K (80 °C) och 3 MPa O 2 in frånvaro av väte eller lösningsmedel. Andra vätskefas-selektiva oxidationer har uppnåtts med mättade kolväten. Till exempel cyklohexan omvandlats till cyklohexanon och cyklohexanol med en kombinerad selektivitet på ~100% på guldkatalysatorer. Produktselektiviteter kan avstämmas i vätskefasreaktioner genom närvaron eller frånvaron av lösningsmedel och genom beskaffenheten av det senare, dvs. vatten, polär eller opolär . Med guldkatalysatorer har katalysatorns bärare mindre inflytande på reaktioner i vätskefasen än på reaktioner i gasfas.
Selektiva hydreringar
Typiska hydreringskatalysatorer är baserade på metaller från 8- , 9- och 10 -grupperna, såsom Ni , Ru , Pd och Pt . Som jämförelse har guld en dålig katalytisk aktivitet för hydrering. Denna låga aktivitet orsakas av svårigheten med diväteaktivering på guld. Medan väte dissocierar på Pd och Pt utan en energibarriär , har dissociation på Au( 111 ) en energibarriär på ~1,3 eV , enligt DFT- beräkningar. Dessa beräkningar överensstämmer med experimentella studier, där vätedissociation inte observerades på guld ( 111 ) eller ( 110 ) terrasser, och inte heller på ( 331 ) steg. Ingen dissociation observerades på dessa ytor vare sig vid rumstemperatur eller vid 473 K (200 °C). Men hastigheten för väteaktivering ökar för Au nanopartiklar. Trots dess dåliga aktivitet har guld i nanostorlek immobiliserat i olika bärare visat sig ge en god selektivitet i hydreringsreaktioner.
En av de tidiga studierna (1966) av hydrering på uppburet, högdispergerat guld utfördes med 1-buten och cyklohexen i gasfas vid 383 K (110 °C). Reaktionshastigheten visade sig vara första ordningen med hänsyn till alkentrycket och andra ordningen med avseende på kemisorberat väte. I senare arbeten visades det att guldkatalyserad hydrering kan vara mycket känslig för Au-belastning (därav partikelstorlek) och för bärarens natur. SiO2 Till exempel skedde 1-pentenhydrering y- Al2O3 optimalt på 0,04 viktprocent Au/ , men inte alls på Au/ . Däremot visades hydreringen av 1,3-butadien till 1 -buten vara relativt okänslig för Au-partikelstorlek i en studie med en serie Au/ Al2O3 - katalysatorer framställda med olika metoder. Med alla testade katalysatorer var omvandlingen ~100% och selektiviteten <60%. Beträffande reaktionsmekanismer, i en studie av D2 propylenhydrering på Au/SiO2 , bestämdes reaktionshastigheter med användning av och H2 . Eftersom reaktionen med deuterium var avsevärt långsammare, föreslogs det att det hastighetsbestämmande steget vid alkenhydrering var klyvningen av HH-bindningen. Slutligen studerades etenhydrering på Au/ MgO vid atmosfärstryck och 353 K (80 °C) med EXAFS , XANES och IR-spektroskopi , vilket tyder på att den aktiva arten kan vara Au +3 och reaktionsintermediären , en etylguldart.
Guldkatalysatorer är särskilt selektiva vid hydrering av α,β-omättade aldehyder, dvs aldehyder som innehåller en C=C- dubbelbindning på kolet intill karbonylen . Guldkatalysatorer kan endast hydrera karbonylgruppen, så att aldehyden omvandlas till motsvarande alkohol , samtidigt som C=C-dubbelbindningen lämnas orörd. Vid hydreringen av ZrO2 krotonaldehyd till krotylalkohol uppnåddes 80 % selektivitet vid 5-10 % omvandling och 523 K (250 °C) på Au/ och Au/ ZnO . Selektiviteten ökade tillsammans med Au-partikelstorleken i intervallet ~2 till ~5 nm. Andra fall av denna reaktion inkluderar akrolein , citral , bensalaceton och pent-3-en-2-on. Aktiviteten och selektiviteten hos guldkatalysatorer för denna reaktion har kopplats till nanopartiklarnas morfologi, som i sin tur påverkas av stödet. Till exempel tenderar runda partiklar att bildas på TiO 2 , medan ZnO främjar partiklar med tydliga aspekter, som observerats av TEM . Eftersom den runda morfologin ger en högre relativ mängd lågkoordinerade metallytor , förklaras den högre aktivitet som observerats med Au/TiO 2 jämfört med Au/ZnO. Slutligen har en bimetallisk Au- In /ZnO-katalysator observerats förbättra selektiviteten mot hydrering av karbonyl i akrolein. Det observerades i HRTEM- bilder att tunna indiumfilmer dekorerar några av aspekterna av guldnanopartikeln. Den främjande effekten på selektivitet kan bero på det faktum att endast Au-webbplatserna som främjar bireaktioner är dekorerade av In.
En strategi som i många reaktioner har lyckats förbättra guldets katalytiska aktivitet utan att försämra dess selektivitet är att syntetisera bimetalliska Pd -Au- eller Pt -Au-katalysatorer. För hydreringen av 1,3-butadien till butener studerades modellytor av Au( 111 ), Pd-Au( 111 ), Pd-Au( 110 ) och Pd( 111 ) med LEED , AES och LEIS . En selektivitet på ~100 % uppnåddes på Pd 70 Au 30 ( 111 ) och det föreslogs att Au kunde främja desorptionen av produkten under reaktionen. Ett andra exempel är hydreringen av p -klornitrobensen till p -kloranilin , där selektiviteten lider med typiska hydreringskatalysatorer på grund av den parallella vätedekloreringen till anilin . Pd-Au/Al 2 O 3 (Au/Pd ≥20) har dock visat sig tre gånger så aktiv som den rena Au-katalysatorn, samtidigt som den är ~100 % selektiv för p -kloranilin. I en mekanistisk studie av hydrering av nitrobensener med Pt-Au/TiO 2 identifierades dissociationen av H 2 som hastighetskontrollerande , därav inkorporeringen av Pt, en effektiv hydreringsmetall, mycket förbättrad katalytisk aktivitet. Diväte dissocierade på Pt och den nitroaromatiska föreningen aktiverades på Au-TiO2- gränsytan . Slutligen möjliggjordes hydrering genom spridning av aktiverade H-ytor från Pt till Au-ytan.
Teoretisk bakgrund
Bulk metalliskt guld är känt för att vara inert och uppvisar ytreaktivitet vid rumstemperatur endast mot ett fåtal ämnen såsom myrsyra och svavelhaltiga föreningar, t.ex. H 2 S och tioler . Inom heterogen katalys adsorberas reaktanter på ytan av katalysatorn och bildar sålunda aktiverade mellanprodukter. Men om adsorptionen är svag, såsom i fallet med bulkguld, uppstår inte en tillräcklig störning av reaktantens elektroniska struktur och katalys hindras ( Sabatiers princip) . När guld deponeras som nanostora kluster på mindre än 5 nm på metalloxidbärare, observeras en markant ökad interaktion med adsorbater, vilket resulterar i överraskande katalytiska aktiviteter. Uppenbarligen gör nanoskalning och spridning av guld på metalloxidsubstrat guld mindre ädelt genom att justera dess elektroniska struktur, men de exakta mekanismerna bakom detta fenomen är ännu osäkra och därför studerade brett.
Det är allmänt känt att en minskning av storleken på metallpartiklar i någon dimension till nanometerskalan kommer att ge kluster med en betydligt mer diskret elektronisk bandstruktur i jämförelse med bulkmaterialet. Detta är ett exempel på en effekt i kvantstorlek och har tidigare korrelerats med en ökad reaktivitet som gör att nanopartiklar kan binda gasfasmolekyler starkare. I fallet med TiO 2 -stödda guldnanopartiklar, Valden et al. observerade öppningen av ett bandgap på ungefär 0,2-0,6 eV i den elektroniska guldstrukturen när tjockleken på de avsatta partiklarna minskade under tre atomlager. De tvåskiktiga tjocka guldklustren visade sig också vara exceptionellt aktiva för CO-förbränning, baserat på vilken man drog slutsatsen att kvantstorlekseffekter som inducerar en metallisolatorövergång spelar en nyckelroll för att förbättra guldets katalytiska egenskaper. Men att minska storleken ytterligare till ett enda atomlager och en diameter på mindre än 3 nm rapporterades återigen minska aktiviteten. Detta har senare förklarats av en destabilisering av kluster som består av mycket få atomer, vilket resulterar i för stark bindning av adsorbater och därmed förgiftning av katalysatorn.
Egenskaperna hos metall-d-bandet är centrala för att beskriva ursprunget till katalytisk aktivitet baserat på elektroniska effekter. Enligt d-bandsmodellen för heterogen katalys bildas substrat-adsorbatbindningar när de diskreta energinivåerna hos adsorbatmolekylen interagerar med metallens d-band och bildar således bindande och antibindande orbitaler. Styrkan hos den bildade bindningen beror på läget för d-bandets centrum så att ett d-band närmare Fermi-nivån ( att resultera i starkare interaktion. D-bandscentrumet för bulkguld ligger långt under vilket kvalitativt förklarar den observerade svaga bindningen av adsorbater eftersom både bindnings- och antibindningsorbitaler som bildas vid adsorption kommer att vara upptagna, vilket resulterar i ingen nettobindning. Men eftersom storleken på guldkluster minskar under 5 nm, har det visats att guldets d-bandscentrum skiftar till energier närmare Fermi-nivån, så att den antibindande orbitalen som bildas kommer att pressas till en energi över , vilket minskar dess fyllning. Förutom en förskjutning i d-bandets centrum av guldkluster, storleksberoendet av d-bandets bredd samt 5 spin-orbit splitting har studerats utifrån katalytisk aktivitet. Eftersom storleken på guldklustren minskar under 150 atomer (diameter ca. 2,5 nm), inträffar snabba fall i båda värdena. Detta kan tillskrivas d-bandsavsmalning på grund av det minskade antalet hybridiserande valenstillstånd för små kluster såväl som det ökade förhållandet mellan högenergikantatomer med låg koordination och det totala antalet Au-atomer. Effekten av den minskade spin-omloppsdelningen samt den smalare fördelningen av d -bandstillstånd om guldklustrens katalytiska egenskaper kan inte förstås via enkla kvalitativa argument som i fallet med d-bandscentrummodellen. Ändå ger de observerade trenderna ytterligare bevis för att en betydande störning av Au elektroniska strukturen inträffar vid nanoskalning, vilket sannolikt kommer att spela en nyckelroll i förbättringen av de katalytiska egenskaperna hos guldnanopartiklar.
Ett centralt strukturellt argument som förklarar den höga aktiviteten hos metalloxidunderstödda guldkluster är baserat på konceptet med periferiplatser som bildas vid korsningen mellan guldklustret och substratet. När det gäller CO-oxidation har det antagits att CO adsorberas på kanterna och hörnen av guldklustren, medan aktiveringen av syre sker vid de perifera platserna. Den höga aktiviteten hos kant- och hörnplatser mot adsorption kan förstås genom att beakta den höga koordinativa omättnaden hos dessa atomer i jämförelse med terrassatomer. Den låga graden av koordination ökar ytenergin på hörn- och kantställen, vilket gör dem mer aktiva mot bindande adsorbater. Detta är ytterligare kopplat till den lokala förskjutningen av de omättade Au-atomernas d-bandscentrum mot energier närmare Fermi-nivån, vilket i enlighet med d-bandsmodellen resulterar i ökad substrat-adsorbatinteraktion och sänkning av adsorptionsdissociationen energibarriärer. Lopez et al. beräknade adsorptionsenergin för CO och O 2 på Au( 111 )-terrassen där Au-atomerna har ett koordinationstal på 9 samt på ett Au 10- kluster där de mest reaktiva platserna har en koordination på 4. De observerade att bindningsstyrkorna ökar i allmänhet med så mycket som 1 eV, vilket indikerar en signifikant aktivering mot CO-oxidation om man antar att aktiveringsbarriärerna för ytreaktioner skalar linjärt med adsorptionsenergierna ( Brønsted-Evans-Polanyi-principen) . Observationen att halvklotformade guldkluster i två lager med en diameter på några nanometer är mest aktiva för CO-oxidation är väl i linje med antagandet att kant- och hörnatomer fungerar som de aktiva platserna, eftersom för kluster av denna form och storlek förhållandet av kantatomer till det totala antalet atomer är verkligen maximerat.
Den föredragna aktiveringen av O 2 vid perimeterställena är ett exempel på en stödeffekt som främjar den katalytiska aktiviteten hos guldnanopartiklar. Förutom att möjliggöra en korrekt spridning av de deponerade partiklarna och därmed ett högt förhållande mellan yta och volym, stör metalloxidstödet också direkt den elektroniska strukturen hos de deponerade guldklustren via olika mekanismer, inklusive töjningsinducerande och laddningsöverföring. För guld avsatt på magnesia (MgO) har en laddningsöverföring från enkelladdade syrevakanser ( F-centra) vid MgO-ytan till Au-klustret observerats. Denna laddningsöverföring inducerar en lokal störning i den elektroniska strukturen av guldklustren vid perimeterställena, vilket möjliggör bildandet av resonanstillstånd när den antibindande syrebanan interagerar med metallen d-band. När den antibindande orbitalen är upptagen försvagas och sträcks OO-bindningen avsevärt, dvs aktiveras. Aktiveringen av O 2 vid perimeterställena observeras även för defektfria ytor och neutrala guldkluster, men i betydligt mindre utsträckning. Den aktivitetshöjande effekten av laddningsöverföring från substratet till guld har också rapporterats av Chen och Goodman i fallet med ett gulddubbelskikt som stöds på ultratunn TiO 2 på Mo ( 112 ). Förutom laddningsöverföring mellan substratet och guldnanopartiklarna, har stödmaterialet observerats öka den katalytiska aktiviteten hos guld genom att inducera spänning som en konsekvens av gallerfelpassning. De inducerade stammarna påverkar särskilt Au-atomerna nära substrat-klustergränssnittet, vilket resulterar i en förskjutning av det lokala d-bandscentret mot energier närmare Fermi-nivån. Detta bekräftar periferihypotesen och skapandet av katalytiskt aktiva bifunktionella platser vid klusterstödsgränssnittet. Dessutom påverkar stöd-kluster-interaktionen direkt storleken och formen på de deponerade guldnanopartiklarna. Vid svag interaktion bildas mindre aktiva 3D-kluster, medan om interaktionen är starkare bildas mer aktiva 2D-strukturer med få lager. Detta illustrerar förmågan att finjustera den katalytiska aktiviteten hos guldkluster genom att variera bärarmaterialet såväl som den underliggande metallen på vilken substratet har odlats.
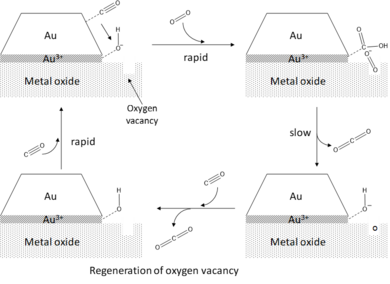
Slutligen har det observerats att den katalytiska aktiviteten hos understödda guldkluster mot CO-oxidation förstärks ytterligare av närvaron av vatten. Genom att åberopa periferihypotesen främjar vatten aktiveringen av O 2 genom samadsorption på perimeterställena där det reagerar med O 2 för att bilda adsorberade hydroxyl (OH*) och hydroperoxo (OOH*) arter. Reaktionen av dessa intermediärer med adsorberad CO är mycket snabb och resulterar i effektiv bildning av CO 2 med åtföljande återvinning av vattenmolekylen.
Se även
- ^ a b c d e Haruta, Masatake (1997). "Storleks- och stödberoende vid katalys av guld". Katalys idag . 36 (1): 153–166. doi : 10.1016/s0920-5861(96)00208-8 .
- ^ a b c d e f g h i j k l Haruta, Masatake (2011-10-04). "Spiers Memorial Lecture: Rollen av perimetergränssnitt i katalys av guldnanopartiklar". Faraday-diskussioner . 152 : 11–32, diskussion 99–120. Bibcode : 2011FaDi..152...11H . doi : 10.1039/c1fd00107h . ISSN 1364-5498 . PMID 22455036 .
- ^ a b c d e f van Santen, Rutger Anthony; Neurock, Matthew (2006). Molekylär heterogen katalys. Ett konceptuellt och beräkningsmässigt tillvägagångssätt . Weinheim, Tyskland: Wiley-VCH. s. 53–60. ISBN 978-3-527-29662-0 .
- ^ a b Valden, M.; Lai, X.; Goodman, DW (1998-09-11). "Början av katalytisk aktivitet av guldkluster på Titania med utseendet av icke-metalliska egenskaper". Vetenskap . 281 (5383): 1647–1650. Bibcode : 1998Sci...281.1647V . doi : 10.1126/science.281.5383.1647 . ISSN 0036-8075 . PMID 9733505 .
- ^ a b Chen, MS; Goodman, DW (2004-10-08). "Strukturen av katalytiskt aktivt guld på Titania". Vetenskap . 306 (5694): 252–255. Bibcode : 2004Sci...306..252C . doi : 10.1126/science.1102420 . ISSN 0036-8075 . PMID 15331772 . S2CID 19323471 .
- ^ a b c d e Landman, Uzi; Yoon, Bokwon; Zhang, Chun; Heiz, Ueli; Arenz, Matthias (2007-06-01). "Faktorer i guld nanokatalys: oxidation av CO i den icke-skalbara storleksregimen". Ämnen i Katalys . 44 (1–2): 145–158. CiteSeerX 10.1.1.459.9120 . doi : 10.1007/s11244-007-0288-6 . ISSN 1022-5528 . S2CID 17560286 .
- ^ a b c d Mavrikakis, M.; Stoltze, P.; Nørskov, JK (2000-02-01). "Gör guld mindre ädelt". Katalysbokstäver . 64 (2–4): 101–106. doi : 10.1023/A:1019028229377 . ISSN 1011-372X . S2CID 96863829 .
- ^ Ciriminna, Rosaria; Falletta, Ermelinda; Della Pina, Cristina; Teles, Joaquim Henrique; Pagliaro, Mario (2016). "Industriella tillämpningar av guldkatalys". Angewandte Chemie International Edition . 55 (46): 1433–7851. doi : 10.1002/anie.201604656 . hdl : 2434/463818 . PMID 27624999 . S2CID 28730917 .
- ^ Nijamudheen, A.; Datta, Ayan (2020). "Guldkatalyserade korskopplingsreaktioner: en översikt över designstrategier, mekanistiska studier och tillämpningar". Kemi: A European Journal . 26 (7): 1442–1487. doi : 10.1002/chem.201903377 . PMID 31657487 . S2CID 204947412 .
- ^ Haruta, Masatake (2011). "Spiers Memorial Lecture: Rollen av perimetergränssnitt i katalys av guldnanopartiklar". Faraday-diskussioner . 152 : 11–32, diskussion 99–120. Bibcode : 2011FaDi..152...11H . doi : 10.1039/c1fd00107h . ISSN 1359-6640 . PMID 22455036 .
- ^ a b c d e f g Hashmi, A. Stephen K.; Hutchings, Graham J. (2006-12-04). "Guldkatalys". Angewandte Chemie International Edition . 45 (47): 7896–7936. doi : 10.1002/anie.200602454 . ISSN 1521-3773 . PMID 17131371 .
- ^ a b Haruta, Masatake (oktober 2005). "Guldrush". Naturen . 437 (7062): 1098–1099. doi : 10.1038/4371098a . ISSN 1476-4687 . PMID 16237427 . S2CID 4347776 .
- ^ a b c d Zhang, Yan; Cui, Xinjiang; Shi, Feng; Deng, Youquan (2012-04-11). "Nano-Gold Catalysis in Fine Chemical Synthesis". Kemiska recensioner . 112 (4): 2467–2505. doi : 10.1021/cr200260m . ISSN 0009-2665 . PMID 22112240 .
- ^ a b Serna, Pedro; Concepción, Patricia; Corma, Avelino (2009-07-01). "Design av högaktiva och kemoselektiva bimetalliska guld-platinahydreringskatalysatorer genom kinetiska och isotopiska studier". Journal of Catalysis . 265 (1): 19–25. doi : 10.1016/j.jcat.2009.04.004 . ISSN 0021-9517 .
- ^ Turner, Mark; Golovko, Vladimir B.; Vaughan, Owain PH; Abdulkin, Pavel; Berenguer-Murcia, Angel; Tikhov, Mintcho S.; Johnson, Brian FG; Lambert, Richard M. (augusti 2008). "Selektiv oxidation med dioxygen av guld nanopartikelkatalysatorer härledda från 55-atomkluster". Naturen . 454 (7207): 981–983. Bibcode : 2008Natur.454..981T . doi : 10.1038/nature07194 . ISSN 1476-4687 . PMID 18719586 . S2CID 4355469 .
- ^ a b c Hammer, B.; Norskov, JK (juli 1995). "Varför är guld den ädlaste av alla metaller". Naturen . 376 (6537): 238–240. Bibcode : 1995Natur.376..238H . doi : 10.1038/376238a0 . ISSN 1476-4687 . S2CID 4334587 .
- ^ a b Lopez, N (2004). "Om ursprunget till den katalytiska aktiviteten hos guldnanopartiklar för lågtemperatur CO-oxidation". Journal of Catalysis . 223 (1): 232–235. doi : 10.1016/j.jcat.2004.01.001 .
- ^ a b Jiang, T.; Mowbray, DJ; Dobrin, S.; Falsig, H.; Hvolbæk, B.; Bligaard, T.; Nørskov, JK (2009-06-18). "Trender i CO-oxidationshastigheter för metallnanopartiklar och täta, trappade och knäckta ytor" . Journal of Physical Chemistry C . 113 (24): 10548–10553. doi : 10.1021/jp811185g . ISSN 1932-7447 .
- ^ a b Visikovskiy, Anton; Matsumoto, Hisashi; Mitsuhara, Kei; Nakada, Toshitaka; Akita, Tomoki; Kido, Yoshiaki (2011). "Elektroniska d-bandsegenskaper hos guld nanokluster odlade på amorft kol". Fysisk granskning B . 83 (16): 165428. Bibcode : 2011PhRvB..83p5428V . doi : 10.1103/physrevb.83.165428 .