Sabatier princip
Sabatierprincipen är ett kvalitativt begrepp inom kemisk heterogen katalys uppkallad efter den franske kemisten Paul Sabatier . Den anger att växelverkan mellan katalysatorn och substratet bör vara "precis rätt"; det vill säga varken för stark eller för svag. Om interaktionen är för svag kommer molekylen inte att binda till katalysatorn och ingen reaktion kommer att äga rum. Å andra sidan, om interaktionen är för stark, misslyckas produkten att dissociera.
Principen kan visas grafiskt genom att plotta reaktionshastigheten mot en egenskap såsom adsorptionsvärmet för reaktanten av katalysatorn. Sådana tomter passerar genom ett maximum, ser ungefär ut som en triangel eller en inverterad parabel, och kallas vulkanplottar på grund av sin form. Analoga tredimensionella diagram kan också byggas mot två olika egenskaper, såsom adsorptionsvärmen för de två reaktanterna för en tvåkomponentsreaktion. I det fallet visas plottet i allmänhet som en konturplot och kallas en vulkanyta . Vulkantomter introducerades av Balandin.
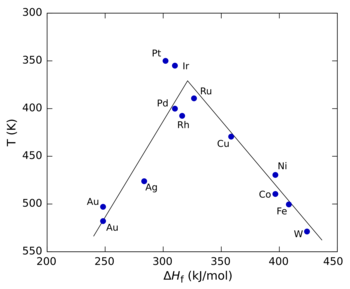
Figuren till höger visar ett vulkandiagram för nedbrytning av myrsyra med olika övergångsmetaller som katalysatorer. I detta fall bildningsvärmet (Δ H f ) för metallformiatsaltet för x-axeln eftersom studier visade att reaktionsmellanprodukten var ett ytformiat. För y-axeln användes temperaturen vid vilken reaktionen når en specifik hastighet (y-axeln är ritad omvänt för att bevara den konventionella "vulkan"-formen). Vid låga värden på AHf är reaktionen långsam (med andra ord kräver högre temperaturer ) eftersom adsorptionshastigheten är långsam och hastighetsbegränsande . Vid höga värden på AHf blir desorption det hastighetsbegränsande steget. Den maximala hastigheten , som observeras för platinagruppmetallerna i detta fall, kräver mellanliggande värden på AHf, varvid hastigheten är en kombination av adsorptionshastigheten och desorptionshastigheten.