Barrelene
|
|
|||
| Namn | |||
|---|---|---|---|
|
Föredraget IUPAC-namn
Bicyklo[2.2.2]okta-2,5,7-trien |
|||
| Identifierare | |||
|
3D-modell ( JSmol )
|
|||
| ChemSpider | |||
|
PubChem CID
|
|||
| UNII | |||
|
CompTox Dashboard ( EPA )
|
|||
|
|||
|
|||
| Egenskaper | |||
| C8H8 _ _ _ | |||
| Molar massa | 104,15 | ||
| Densitet | 1,013 g/ml | ||
| Kokpunkt | 153,7 °C (308,7 °F; 426,8 K) | ||
|
Om inte annat anges ges data för material i standardtillstånd (vid 25 °C [77 °F], 100 kPa).
|
|||
Barrelene är en bicyklisk organisk förening med den kemiska formeln C 8 H 8 och det systematiska namnet bicyklo[2.2.2]okta-2,5,7-trien. Först syntetiserades och beskrevs av Howard Zimmerman 1960, namnet härrör från likheten med en tunna , med stavarna som är tre etenenheter fästa vid två metingrupper . Det är den formella Diels-Alder- addukten av bensen och acetylen . På grund av dess ovanliga molekylära geometri är föreningen av stort intresse för teoretiska kemister.
Iptycenes , med alkengrupperna en del av en arenes , är besläktade föreningar. Det är också ett utgångsmaterial för många andra organiska föreningar, såsom semibulvalen .
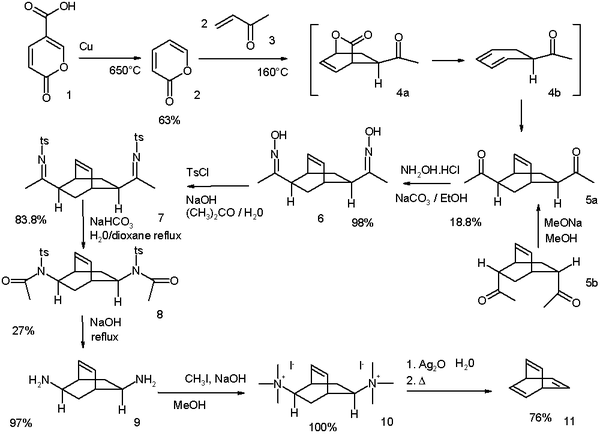
Den ursprungliga Zimmerman, syntesmodifierad 1969, utgår från kumalsyra :
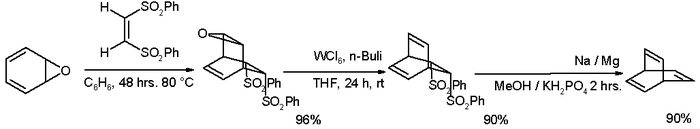
Många alternativa vägar har utarbetats sedan dess, en av dem utgår från bensenoxid :
En alternativ väg som tillåter syntes av moderbarrensystemet och en mängd substituerade barrelener har också rapporterats
Barrelene reaktioner
Barrelene hydreras med vätgas och Adams katalysator i etanol till den fullständigt mättade bicyklo[2.2.2]-oktanen . Bromering med brom i tetraklormetan ger en dibromo-addukt eftersom en kopplingsreaktion ingriper:
Epoxidation av barrelen med oxon ger trioxatrishomobarrelen som vid omlagring med bortrifluorid (drivkraft: avlastning av spänningsenergi ) omvandlas till trioxatrishomokuban:
Denna förening kan föreställas som en kubane med tre syreatomer insatta i tre motsatta kanter eller som 9-krona-3 med två metinenheter . Molekylen är kiral och de separata enantiomererna har isolerats.
Vissa barrelener har använts som en monomer i en ringöppningsmetatespolymerisation :
Katalysatorn är en Fischer-karben (en molybden-bis-(hexafluoro-tert-butoxi) karbenkatalysator) och den långa alkylkedjan fäst vid monomeren krävs för löslighet. Oxidation av polymeren med DDQ ger naftalenhänget av poly(p-fenylenvinylen) .
Isopentanlösningar av barrelen genomgår fotolytisk isomerisering när aceton tillsätts som fotosensibilisator för att producera semibulvalen . Långvarig bestrålning resulterar i ytterligare isomerisering för att bilda cyklooktatetraen .
- ^ International Union of Pure and Applied Chemistry (2014). Nomenklatur för organisk kemi: IUPAC-rekommendationer och föredragna namn 2013 . Royal Society of Chemistry . sid. 1257. doi : 10.1039/9781849733069 . ISBN 978-0-85404-182-4 .
- ^ Syntes och fysikaliska egenskaper hos barrelene, en unik Möbius-liknande molekyl Howard E. Zimmerman, Gary L. Grunewald, Robert M. Paufler, Maynard A. Sherwin J. Am. Chem. Soc. ; 1969 ; 91(9); 2330–2338. doi : 10.1021/ja01037a024
- ^ Reaktionsschema: dekarboxylering av kumalsyra (1) sker vid 650 °C med koppar för att ge α- pyron (2). Reaktionen med metylvinylketon (3) är en tandem Diels–Alder /retro-Diels–Alder/Diels–Alder-sekvens, som ger diketon 5 som en blandning av två isomerer . Det är möjligt att omvandla endo-isomeren 5b till exo-isomeren 5a genom en epimeriseringsprocess genom enolen . Ketongrupperna omvandlas till oximgrupper i 6 genom reaktion med hydroxylamin och sedan till tosylatgrupper i 7 genom reaktion med tosylklorid . En grundläggande Beckmann-omlagring tar schemat för att ge amid 8 och dess hydrolys till diaminen 9 sker med natriumhydroxid . Slutligen ger en Hofmann-eliminering genom ammoniumsalt 10 barrelen 11.
- ^ Barrelene, en ny bekväm syntes Sergio Cossu, Simone Battaggia och Ottorino De Lucchi J. Org. Chem. ; 1997 ; 62(12) sid 4162-4163; doi : 10.1021/jo962267f
- ^ Steg ett i denna reaktion mellan oxepin (en av de möjliga tautomererna ) med ( Z )-1,2-bis(fenylsulfonyl)etylen är en Diels-Alder-reaktion . Reagenserna för de-epoxidation är volframhexaklorid och butyllitium . Den andra elimineringsreaktionen äger rum med natriumamalgam i Julia-olefineringsstil .
- ^ Syntes av substituerade bicyklo[2.2.2]oktatriener Michael W. Wagaman, Erika Bellmann, Michèle Cucullu och Robert H. Grubbs J. Org. Chem. ; 1997 ; 62(26) sid 9076-9082; doi : 10.1021/jo971039y
- ^ endo, exo,syn-3,7,10-Trioxapentacyklo[3.3.3.0 2,4 .0 6,8 .0 9,11 ]undekan
- ^ 4,7,11-Triheterotrishomocubanes - Propellerformade högst symmetriska kirala molekyler härledda från Barrelene Sergei I. Kozhushkov et al. European Journal of Organic Chemistry Volym 2006 , nummer 11 , sidorna 2590-2600 Sammanfattning
- ^ Syntes av Poly(1,4-naphthylenevinylenes): Metatespolymerisation av Benzobarrelenes Lin Pu, Michael W. Wagaman och Robert H. Grubbs Macromolecules ; 1996 ; 29(4) sid 1138-1143; (Artikel) doi : 10.1021/ma9500143
- ^ Syntes av organiska och vattenlösliga poly(1,4-phenylenevinylenes) som innehåller karboxylgrupper: Levande ringöppnande metatespolymerisation (ROMP) av 2,3-Dicarboxybarrelenes Michael W. Wagaman och Robert H. Grubbs Macromolecules ; 1997 ; 30(14) sid 3978-3985; (Artikel) doi : 10.1021/ma9701595
- ^ Zimmerman, HE; Grunewald, GL (1966). "Kemin av Barrelene. III. En unik fotoisomerisering till Semibullvalene". J. Am. Chem. Soc. 88 (1): 183–184. doi : 10.1021/ja00953a045 .