Fischer karben
En Fischer- karben är en tvåvärd organisk ligand i en metallorganisk förening . I en Fischer-karben är karbenliganden en σ-donator π-acceptorligand. Eftersom π-backdonation från metallcentret i allmänhet är svag, är karbenkolet elektrofilt .
Fischer-karbener är uppkallade efter Ernst Otto Fischer .
Strukturera
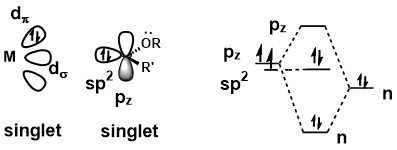
Ett metallkarbenkomplex skulle kunna betraktas som en Fischer-karben när karbenen är i singletttillstånd . Delokalisering av det ensamma paret från substituenten på karbenkol höjer energin hos pz orbital , vilket tvingar de två elektronerna i karben att stanna som ett elektronpar. Bindning mellan karben och metallcentrum innebär en stark σ-donation från sp 2 -orbital till en tom d-orbital på metallcentrum och en svag π-backdonation från metallcentrum till den tomma pz- orbital . Eftersom π-donationen är svag är karbenkolet elektrofilt till sin natur.
På grund av denna bindningsegenskap har Fischer-karbener ofta:
- metallcentrum med lågt oxidationstillstånd
- mellan- och sena övergångsmetaller Fe(0), Mo(0), Cr(0)
- π-acceptor metallligander
- π-donatorsubstituenter på karbenatomen såsom alkoxi och alkylerade aminogrupper.
Förberedelse
Den vanligaste strategin för att framställa Fischer-karben är reaktion mellan metallkarbonylkomplex med organolitiumföreningar. Den motsvarande litiumenolatliknande strukturen är mycket stabiliserad och måste därför släckas av ett mycket elektrofilt alkyleringsreagens såsom Meerweins salt. Alkylering med MeI skulle kunna göras med fasöverföringssystem. Alternativt kan litiumkatjon bytas ut mot en tetraalkylammoniumkatjon för att ge ett mer reaktivt enolat. Detta tetraalkylammoniumsalt kunde acyleras för att ge en mycket elektrofil blandad anhydridliknande Fischer-karben som kunde genomgå nukleofil substitution med alkohol.
Fischer-karbener med a-väte framställs genom reaktion av en metallkarbonylanjon med en formamid. Behandling av mellanprodukten med överskott av trimetylsilylklorid ger denna speciella grupp av Fischer-karbenkomplex.
Utarbetning av Fischer-karbener
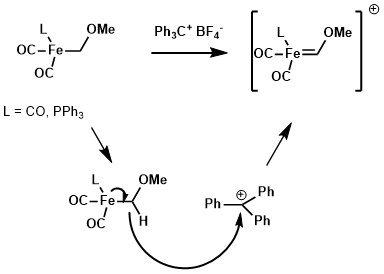
Med ett lämpligt hydridabstrerande reagens, såsom tritylkatjon, skulle hydriden på alkylliganden av ett metallkomplex kunna abstraheras för att bilda en Fischer-karben.
Dekarbonylering från en ostabiliserad metallkarbenoid
Nyligen rapporterade forskare i Spanien att Fischer-karben effektivt kunde framställas från en dekarbonylerande process av en metallkarbenoid som härrör från en stabiliserad diazoförening.
Reaktivitet
Karbonylliknande reaktivitet
Karbenkolet i Fischer-karben är elektrofilt till sin natur. Således uppvisar Fischer-karben liknande reaktivitet jämfört med karbonylföreningar. Många av reaktionerna kan förstås genom att använda den karboxyliska ekvivalenta strukturen såsom transesterifiering, Michael-addition och aldolreaktion. Cr(CO) 5 -delen är en stark elektronbortdragande grupp som gör a-protonen mycket sur. En metoxikromkarben med en metylsidokedja har ett pKa på 12,5 i vattenhaltig acetonitril (volymförhållande 1:1). Som jämförelse har metylacetat ett pKa på 25,6, vilket visar den starka elektronborttagande naturen hos Cr(CO) 5 -delen.
Fischer-karbenens starka elektronåterdragande natur återspeglas också i många reaktioner. Till exempel fullbordades Diels-Alder-reaktionen mellan metylakrylat och isopren på 7 dagar vid rumstemperatur med låg para-meta-selektivitet. Å andra sidan slutade Fischer-karbenmotsvarigheten på 3 timmar vid rumstemperatur med mycket högre para-meta-selektivitet.
Urotropin, en svag nukleofil, skulle kunna delta i en Michael-addition till en alkynyl Fischer-karben, vilket ger en intressant dubbeltillsatsprodukt.
Den enolatliknande strukturen, erhållen genom deprotonering av Fischer-karben, kunde alkyleras. Men eftersom karbanjonen är mycket stabiliserad behövs ett reaktivt alkyleringsreagens, såsom metylfluorsulfonat ("magisk metyl"-reagens) eller metylbromacetat.
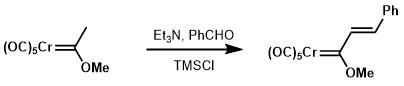
Aldolkondensation av Fischer-karbener kunde uppnås genom att använda mycket svagare baser jämfört med dess karbonylmotsvarighet, såsom trietylamin.
Avmetallering
Fischer-karbener kunde oxideras till motsvarande karbonylföreningar med hjälp av milda oxidanter såsom ceriumammoniumnitrat (CAN).
Om sidokedjan av Fischer-karben bär en a-proton, kan den deprotoneras reversibelt med en svag bas såsom pyridin. Detta underlättar bildningen av kromhydridtyper, som kan genomgå reduktiv eliminering för att ge cis-enoleter.
Fotokemiska egenskaper hos Fischer karben
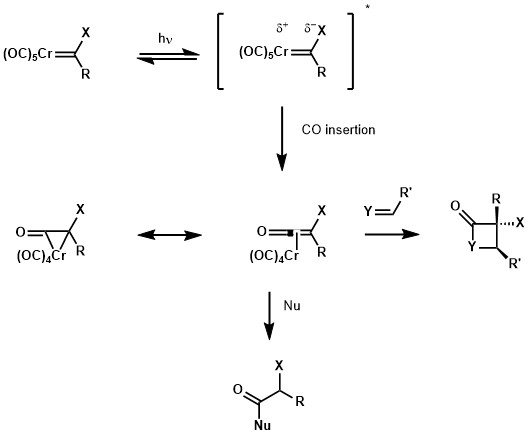
UV-VIS- spektrum av en Fischer-karben visade ett metall-till-ligand-laddningsöverföringsband i det nära ultravioletta ljuset. Å ena sidan främjar denna excitation en elektron från en metallcentrerad orbital till en ligandcentrerad orbital, vilket gör karbenkolet mer elektronrikt. Å en annan sida blir metallcentret, som redan är elektronfattigt på grund av karbonylliganderna, mer elektronfattigt, vilket underlättar den migrerande insättningen till CO-liganden. Denna migrerande insättning ger en krommetallacyklopropanon, som är en resonansform av metalliserad keten. Med ketenreaktivitet kan arten fångas av flera nukleofiler såsom alkoholer och aminer, eller kan reagera i [2+2] cykloaddition med alkener, iminer eller aldehyd vilket ger motsvarande cyklobutan-, β-laktam- och β-laktonaddukter.